千金藤素通过MAT2B调节MAPK信号通路对宫颈癌细胞增殖和凋亡的影响
尹杨峰,蒋磊
·论著·
千金藤素通过MAT2B调节MAPK信号通路对宫颈癌细胞增殖和凋亡的影响
尹杨峰,蒋磊
230001 合肥,安徽省第二人民医院药学部
研究千金藤素对人宫颈癌细胞增殖和凋亡的影响,并探讨其分子机制。
不同浓度的千金藤素作用于宫颈癌细胞 SiHa 后,四甲基偶氮唑蓝(MTT)法检测细胞活力变化,流式细胞术检测细胞凋亡,实时荧光定量 PCR(qRT-PCR)和 Western blot 检测 MAT2B表达水平的变化,确定最佳药物浓度。将蛋氨酸腺苷转移酶 2B(MAT2B)小干扰 RNA(si-MAT2B)转染 SiHa 细胞,检测细胞活力和凋亡情况。将 MAT2B 过表达载体(pcDNA-MAT2B)转染 SiHa 细胞,经千金藤素处理后,检测细胞活力、凋亡情况以及磷酸化的 p38 分裂原激活蛋白激酶(p-p38 MAPK)和磷酸化细胞外信号调节激酶 1/2(p-ERK1/2)表达变化。
在不同给药时间下,随着千金藤素浓度的增加,SiHa 细胞活力逐渐降低,细胞凋亡率逐渐升高,MAT2B 的表达水平逐渐降低,确定 20 mg/L 为最佳有效浓度。si-MAT2B 转染后 SiHa 细胞活力显著降低,细胞凋亡率显著升高(< 0.05)。千金藤素处理后 SiHa 细胞 p-p38 MAPK 和 p-ERK1/2 蛋白的表达显著降低(< 0.05)。pcDNA-MAT2B 转染并经千金藤素处理后,SiHa 细胞活力显著升高,细胞凋亡率显著降低,p-p38 MAPK 和 p-ERK1/2 蛋白的表达显著升高(< 0.05)。
千金藤素通过下调 MAT2B 抑制宫颈癌细胞增殖,促进细胞凋亡,其机制与抑制MAPK 信号通路有关。
千金藤素; 宫颈癌; 蛋氨酸腺苷转移酶 2B; MAPK 信号通路; 细胞增殖; 凋亡
宫颈癌是第三常见的妇科恶性肿瘤,占女性癌症相关死亡的10% ~ 15%[1]。目前手术治疗主要用于宫颈癌早期患者,对于晚期或复发转移患者多采用化疗。化疗的毒副反应、耐药性是导致化疗失败的主要原因。因此,寻找新的安全、低毒、高效的抗肿瘤药物是亟待解决的重大问题。千金藤素(cepharanthine,CEP)是从防己科植物千金藤根中提取的天然生物碱,大量研究表明 CEP 具有多种抗肿瘤作用,包括抑制细胞增殖、抑制血管生成[2]、诱导细胞自噬[3]、抑制肿瘤转移[4]以及化疗增敏作用[5]。已有研究显示,CEP 通过调节基因表达诱导肺癌[6]、子宫内膜癌[7]等多种癌细胞凋亡,但 CEP 对宫颈癌的抗肿瘤作用并未完全阐明。蛋氨酸腺苷转移酶(methionine adenosyltransferase,MAT)2B 基因属于 MAT 家族成员之一,其最初在肝癌中被证实发挥癌基因作用,随后其在结肠癌[8]、三阴性乳腺癌[9]等肿瘤发生中的作用被逐步揭示,靶向 MAT2B 有望成为肿瘤治疗的重要手段。但 MAT2B 在宫颈癌中作用尚不清楚,CEP 能否调节 MAT2B 表达进而调控宫颈癌细胞增殖和凋亡也尚未可知。因此,本研究通过观察 CEP 对宫颈癌细胞 SiHa 增殖和凋亡的影响,检测细胞内 MAT2B 表达变化,探讨 CEP 调控宫颈癌细胞增殖和凋亡的分子机制,以期为 CEP 在宫颈癌治疗中的应用提供科学依据。
1 材料与方法
1.1 材料
人子宫颈鳞癌 SiHa 细胞购于武汉普诺赛生命科技有限公司;DMEM 培养基、胎牛血清和青链霉素双抗购于美国 Gibco 公司;千金藤素(纯度 > 98%,CAS 号 481-49-2)和紫杉醇(paclitaxel,PTX,纯度 > 98%,CAS 号 33069-62-4)购于上海源叶生物有限公司;小干扰 RNA 对照(si-con)、MAT2B 小干扰 RNA(si-MAT2B)、空载体(pcDNA)、MAT2B 过表达载体(pcDNA-MAT2B)以及 PCR 引物均由上海吉玛公司提供;四甲基偶氮唑蓝(MTT)试剂盒、膜联蛋白 V 异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒购于北京索莱宝生物科技公司;Trizol 试剂、RIPA 细胞裂解液、二喹啉甲酸(BCA)蛋白定量试剂盒、聚偏二氟乙烯(PVDF)膜购于上海碧云天生物科技有限公司;兔源 MAT2B 抗体、辣根过氧化物酶标记的山羊抗兔II 抗购于武汉菲恩生物科技有限公司;兔源 p38 分裂原激活蛋白激酶(p38 MAPK)、细胞外信号调节激酶 1/2(ERK1/2)、磷酸化的 p38 MAPK(p-p38 MAPK)、磷酸化的 ERK1/2(p-ERK1/2)、肌动蛋白(β-actin)抗体购于美国 CST 公司。
1.2 方法
1.2.1 细胞培养 采用 DMEM 培养基(添加 10% 胎牛血清和 1% 的青链霉素双抗)培养 SiHa 细胞。培养条件为 37 ℃、5% CO2的细胞培养箱。
1.2.2 细胞分组和处理 将 SiHa 细胞随机分为 CEP 0 mg/L、CEP 10 mg/L、CEP 20 mg/L、CEP40 mg/L、PTX 5 mg/L 组、si-con 组、si-MAT2B 组、CEP + pcDNA 组和CEP + pcDNA-MAT2B 组。CEP 处理组分别采用不同浓度的 CEP 孵育培养 24、48 和 72 h。PTX 组为阳性对照,采用 PTX 浓度为 5 mg/L 的培养液处理细胞 48 h。si-con 组、si-MAT2B 组为分别转染 si-con、si-MAT2B 的 SiHa细胞。CEP + pcDNA 组、CEP + pcDNA-MAT2B 组为将 pcDNA、pcDNA-MAT2B 分别转染 SiHa 细胞后采用 CEP(20 mg/L)处理 48 h。细胞转染参照脂质体 Lipofectamine2000 说明书。
1.2.3 MTT 法检测细胞活力 选取生长状态良好的 SiHa 细胞,按照 5 × 103个/孔密度接种于 96 孔板,培养箱内过夜后,分别加入不同浓度的 CEP,在作用 24、48 和 72 h 时间点,每孔加入20 μl 5% 的 MTT 溶液,混匀后继续培养 4 h,弃去上清后每孔加入 150 μl 的 DMSO,振荡混匀后,酶标仪检测 490 nm 波长处吸光度值。或者在si-con、si-MAT2B 转染至 SiHa 细胞 24、48 和72 h 时间点,按照上述步骤检测细胞活力。同时,将转染 pcDNA、pcDNA-MAT2B 48 h 的 SiHa 细胞接种至 96 孔板,培养 24 h 后,弃去原有培养基,采用 20 mg/L CEP 的培养液孵育细胞 48 h,按照上述方法检测细胞存活情况。每组设置 3 个复孔,实验重复 3 次。
1.2.4 流式细胞术检测细胞凋亡 收集按照 1.2.2 分组进行相应处理的各组细胞,1000 ×离心 5 min,弃去上清液,采用 PBS 洗涤各组细胞3 次。向离心管内加入 100 μl 的结合缓冲液重悬细胞,分别加入 5 μl 的 Annexin V-FITC 和 5 μl 的PI 染液,混匀后,室温避光孵育15 min,补充400 μl 的结合缓冲液后立即进行流式细胞仪检测。每组设置 3 个平行实验,重复 3 次。
1.2.5 qRT-PCR 检测 MAT2B mRNA 的表达水平 收集不同浓度 CEP 处理 48 h 的各组SiHa 细胞,Trizol 法提取各组细胞的总 RNA,紫外分光光度计测定总 RNA 浓度和纯度。将 RNA 逆转为 cDNA 后,采用 qRT-PCR 检测各组 SiHa 细胞中 MAT2B mRNA 表达情况,以 β-actin 为内参,采用 2-ΔΔCt法计算 MAT2B mRNA 的表达水平。MAT2B 上游引物序列5' ACAGAGAGGAAGACA TACCAG 3',下游引物序列5' GTTCATTGCCAGA CCAGTG 3';β-actin 上游引物序列 5' CCAACCGC GAGAAGATGA 3',下游引物序列 5' CCAGAGGC GTACAGGGATAG 3'。每组设置 3 个平行实验,重复3 次。
1.2.6 Western blot 检测 MAT2B、MAPK/ERK 信号通路相关蛋白的表达水平 收集按照1.2.2 分组进行相应处理的各组细胞,RIPA 细胞裂解液裂解细胞,12 000 ×离心 10 min,收集上清 BCA 法定量。取 30 μg 蛋白进行聚丙烯酰胺凝胶电泳,电泳结束后,采用电转装置将蛋白转移至 PVDF 膜,然后采用 5% 脱脂牛奶侧摆摇床室温封闭1 h,加入一抗(MAT2B 稀释比例为 1:800;p-p38 MAPK、p38 MAPK、ERK1/2 和 β-actin 稀释比例为1:1000;p-ERK1/2 为 1:2000),4 ℃孵育过夜,TBST 洗膜 3 次,加入二抗室温孵育 1 h,TBST 洗膜 3 次后,采用增强化学发光法进行显影拍照,随后进行灰度分析。每组设置 3 个平行实验,重复 3 次。
1.3 统计学处理
2 结果
2.1 不同浓度的千金藤素对宫颈癌细胞 SiHa 活力的影响
分别采用不同浓度(0、10、20、40 mg/L)的千金藤素处理 SiHa 细胞。作用 48 和 72 h 时,与 0 mg/L 组比较,千金藤素处理组宫颈癌细胞 SiHa 活力显著降低(< 0.05),并呈一定的剂量依赖性(图 1)。当千金藤素浓度达到 20 mg/L 时,其对宫颈癌细胞 SiHa 的增殖抑制作用已具有统计学意义,因此选择 20 mg/L 作为最佳浓度进行后续研究。
2.2 不同浓度的千金藤素对宫颈癌细胞 SiHa 凋亡的影响
分别采用不同浓度(0、10、20、40 mg/L)的千金藤素处理 SiHa 细胞 48 h,与 0 mg/L 组比较,千金藤素处理组 SiHa 细胞凋亡率显著增加(< 0.05),并呈一定的剂量依赖性(图 2)。当千金藤素浓度达到 20 mg/L 时,已有显著差异,因此选择 20 mg/L作为最佳浓度进行后续研究。
2.3 不同浓度的千金藤素对宫颈癌细胞 SiHa 中 MAT2B 表达的影响
分别采用不同浓度(0、10、20、40 mg/L)的千金藤素处理 SiHa 细胞 48 h,与 0 mg/L 组比较,千金藤素处理组 SiHa 细胞 MAT2B mRNA 和 MAT2B 蛋白的表达水平显著降低(< 0.05),并呈一定的剂量依赖性(图 3)。当药物浓度达到20 mg/L 时已有显著差异,后续选择 20 mg/L 千金藤素浓度进行研究。
2.4 沉默 MAT2B 对宫颈癌细胞 SiHa 活力和细胞凋亡的影响
图 4 显示,与 si-con 组比较,si-MAT2B 组 SiHa 细胞 MAT2B 蛋白的表达水平显著降低,在 24、48、72 h 时间点细胞活力显著降低,细胞凋亡率显著升高(< 0.05)。
2.5 过表达 MAT2B 部分逆转千金藤素对宫颈癌细胞 SiHa 的促进作用
图 5显示,与 NC 组比较,CEP 组 SiHa 细胞 MAT2B 蛋白的表达水平显著降低,SiHa 细胞在 24、48、72 h 时间点细胞活力显著降低,细胞凋亡率显著升高;与 CEP + pcDNA 组比较,CEP + pcDNA-MAT2B 组 SiHa 细胞 MAT2B 蛋白的表达水平显著升高,SiHa 细胞在 24、48、72 h 时间点细胞活力显著升高,细胞凋亡率显著降低(< 0.05)。
Figure 2 Effect of cepharanthine on apoptosis of cervical cancer cells SiHa (A: Flow cytometry detects apoptosis of SiHa; B: Cervical cancer cell SiHa apoptosis rate;*< 0.05)

图 3 千金藤素对宫颈癌细胞SiHa MAT2B mRNA和蛋白表达的影响(A:对MAT2B mRNA 表达的影响;B:对MAT2B 蛋白表达的影响;*P < 0.05)
Figure 3 Effect of cepharanthine on expression of mRNA and protein of MAT2B in cervical cancer cells SiHa (A: Effect on MAT2B mRNA expression; B: Effect on MAT2B protein expression;*< 0.05)

图 4 沉默MAT2B 对宫颈癌细胞SiHa 活力和细胞凋亡的影响(A:对MAT2B 蛋白表达的影响;B:对细胞活力的影响;C:宫颈癌细胞SiHa 凋亡率;D:流式检测宫颈癌细胞SiHa 凋亡;*P < 0.05)
Figure 4 Effect of silencing MAT2B on the viability and apoptosis of cervical cancer cells SiHa (A: Effect on MAT2B protein expression; B: Effect on cell viability; C: Cervical cancer cells SiHa apoptosis rate; D: Flow cytometry detects cervical cancer cells SiHa apoptosis;*< 0.05)
2.6 千金藤素调控 MAT2B 表达抑制宫颈癌细胞 SiHa 中 MAPK/ERK 信号通路
图 6 显示,与 NC 组比较,CEP 组 SiHa 细胞 p-p38 MAPK 和 p-ERK1/2蛋白的表达显著下调;与 CEP+pcDNA 组比较,CEP+pcDNA-MAT2B 组 SiHa 细胞 p-p38 MAPK 和 p-ERK1/2 蛋白的表达显著上调(< 0.05)。
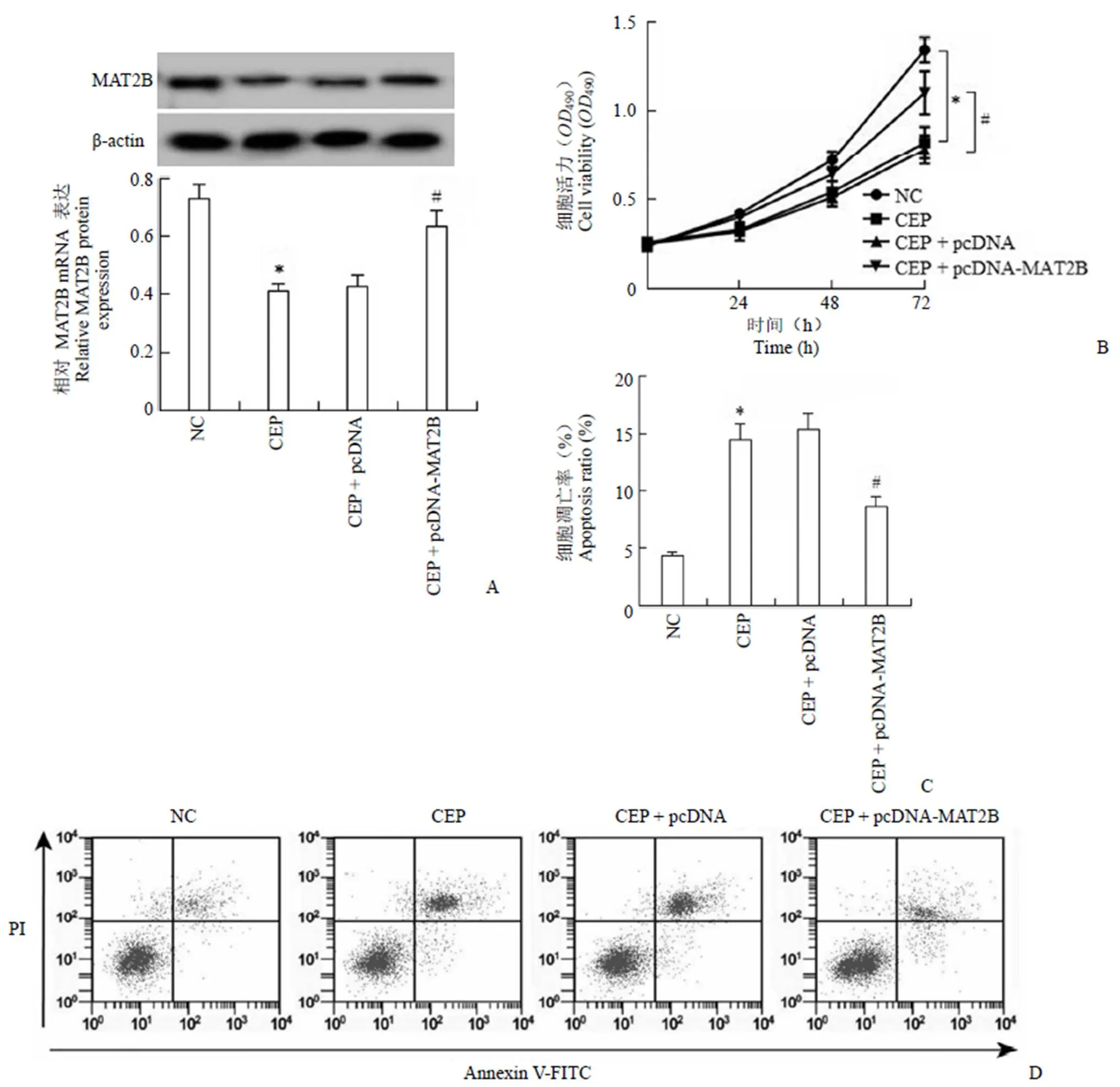
图 5 过表达MAT2B 逆转千金藤素对宫颈癌细胞SiHa 活力和细胞凋亡的影响(A:对MAT2B 蛋白表达的影响;B:对细胞活力的影响;C:宫颈癌细胞SiHa 凋亡率;D:流式检测宫颈癌细胞SiHa 凋亡)
Figure 5 Overexpression of MAT2B reverses the effect of cepharanthine on activity and apoptosis of cervical cancer cells (A: Effect on MAT2B protein expression; B: Effect on cell viability; C: Apoptosis rate of cervical cancer cells SiHa; D: Flow cytometry detects cervical cancer cells SiHa apoptosis)
3 讨论
目前宫颈癌主要采用手术为主、放化疗为辅的治疗方案,然而晚期或复发性宫颈癌对常规治疗无效的问题仍未得到解决。因此,有必要探索新的抗宫颈癌药物,以改善患者预后和生活质量。
CEP 具有抗炎、免疫调节等多种生物活性,在日本已被广泛应用于化学预防和治疗包括白细胞减少症在内的多种疾病,且并未出现严重的毒副作用。近年来CEP 的抗肿瘤作用被不断揭示。例如,CEP 可降低卵巢癌细胞中cyclin A 和cyclin D 表达,增加 p21 表达,引起细胞周期 G1 期阻滞,诱导卵巢癌细胞凋亡[10];CEP 还可诱导细胞产生活性氧,激活 c-Jun N 末端激酶(JNK),进而抑制人脉络膜黑色素瘤细胞增殖,诱导细胞死亡[11];此外,CEP 通过抑制 PI3K/Akt 信号通路可逆转紫杉醇耐药 A2780 细胞中 p 糖蛋白介导的多药耐药[12]。本研究结果证实,CEP 可抑制 SiHa 细胞增殖,促进细胞凋亡,并呈一定的剂量依赖性。PTX 是一线化疗药物,本研究结果显示,CEP 对 SiHa 细胞的抗肿瘤作用与 PTX 的作用相一致。以上结果提示 CEP 是潜在的抗宫颈癌药物。
MAT 又叫腺苷甲硫氨酸(SAM)合成酶,其在催化蛋氨酸和ATP 形成 SAM 中发挥关键作用。SAM 是一种重要的甲基供体,可将 DNA 甲基化,进而影响基因表达,是控制基因表达的重要开关。MAT2B 隶属 MAT 家族,MAT2B 通过与MAT2A 二聚体结合降低 SAM 的i 值和蛋氨酸的m 值来调控 MAT II 的活性,从而影响体内 SAM 含量。既往研究表明,MAT2B 具有多种与肿瘤发生相关功能。在黑色素瘤中,MAT2B 基因敲低通过上调促凋亡基因表达和下调抗凋亡基因表达来抑制生长[13];在肝癌和结肠癌中,MAT2B 与 G 蛋白偶联受体激酶结合蛋白相互作用调节 MEK1/ERK1/2 活性,从而促进细胞生长和肿瘤发生[14]。此外,MAT2B 通过靶向表皮生长因子受体和增殖细胞核抗原,促进骨肉瘤细胞增殖和抑制凋亡[15]。本研究显示,CEP 呈浓度依赖性地抑制 SiHa 细胞中 MAT2B 表达。于是推测 CEP 通过下调 MAT2B 表达发挥抗宫颈癌作用。进一步研究发现,抑制 MAT2B 表达可抑制 SiHa 细胞增殖,促进其凋亡,与 CEP 的抗宫颈癌作用相一致,过表达 MAT2B 可部分逆转 CEP 对 SiHa 细胞增殖和凋亡的影响。以上结果提示,CEP 通过下调 MAT2B 表达进而抑制 SiHa 细胞增殖,诱导其凋亡。

图 6 千金藤素调控MAT2B 表达抑制宫颈癌细胞SiHa 中MAPK/ERK 信号通路(A:对MAPK/ERK 信号通路蛋白表达的影响;B:MAPK/ERK 信号通路蛋白表达)
Figure 6 Cepharanthine regulates MAT2B expression to inhibit MAPK/ERK signaling pathway in cervical cancer cell SiHa
(A: Effect on MAPK/ERK signaling pathway protein expression; B: MAPK/ERK signaling pathway protein expression)
MAPK/ERK 信号通路在恶性肿瘤的进展中发挥重要作用。既往研究表明,CEP 通过抑制 MAPK/ERK 信号通路活化进而抑制人结肠癌细胞裸鼠异体移植肿瘤的增殖[16]。本研究显示,CEP 可抑制 SiHa 细胞中 p38 MAPK 和 ERK1/2 蛋白的磷酸化,抑制 MAPK/ERK 信号通路活化,而过表达 MAT2B 可部分逆转 CEP 对 MAPK/ERK 信号通路的抑制作用。提示千金藤素下调 MAT2B 表达发挥抗宫颈癌作用与抑制 MAPK/ERK 信号通路有关。在后续研究中将探讨千金藤素对宫颈癌细胞迁移侵袭能力的影响。
综上所述,千金藤素通过下调 MAT2B 表达可抑制宫颈癌细胞增殖,促进细胞凋亡,其机制与抑制 MAPK/ERK 信号通路活化有关。本研究发现为千金藤素开发为宫颈癌临床治疗的药物提供了理论依据。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin, 2011, 61(2):69-90.
[2] Lyu J, Yang EJ, Head SA, et al. Pharmacological blockade of cholesterol trafficking by cepharanthine in endothelial cells suppresses angiogenesis and tumor growth. Cancer Lett, 2017, 409:91-103.
[3] Gao S, Li X, Ding X, et al. Cepharanthine induces autophagy, apoptosis and cell cycle arrest in breast cancer cells. Cell Physiol Biochem, 2017, 41(4):1633-1648.
[4] Ma L, Xu YT, She YJ. Effect of Cepharanthine on migration and invasion of osteosarcoma MG-63 cells in vitro. Mod J Integr Traditional Chin West Med, 2016, 25(13):1388-1390, 1394. (in Chinese)
马亮, 许永涛, 佘远举. 千金藤素对骨肉瘤MG-63细胞迁移、侵袭能力影响的体外研究. 现代中西医结合杂志, 2016, 25(13):1388- 1390, 1394.
[5] Peng YM, Wang N, Wang YF, et al. Correlation between reversing effect of cepharanthine hydrochloride on multidrug resistance and P-glycoprotein expression and function of K562/ADR cells. Acta Pharm Sinica, 2012, 47(5):594-599. (in Chinese)
彭有梅, 王宁, 王亚峰, 等. 盐酸千金藤碱逆转K562/ADR细胞多药耐药性及其机制. 药学学报, 2012, 47(5):594-599.
[6] Hao RM, Xie SY, Han WH, et al. Cepharanthine promotes A549 cell apoptosis by regulating miR-150 and miR-182. Chin J Pathophysiology, 2017, 33(11):1987-1992. (in Chinese)
郝瑞敏, 谢书阳, 韩婉虹, 等. 千金藤素通过调节miR-150和miR-182促进A549细胞凋亡. 中国病理生理杂志, 2017, 33(11):1987-1992.
[7]Li MX, Zhang HH. Cepharanthine promotes apoptosis of RL-952 cells by regulating eIF4E-related miR-215. Chin J Pathophysiology, 2018, 34(9):1586-1592. (in Chinese)
李美霞, 张菡菡. 千金藤素通过调节eIF4E相关miR-215促进RL-952细胞凋亡. 中国病理生理杂志, 2018, 34(9):1586-1592.
[8] Peng H, Dara L, Li TW, et al. MAT2B-GIT1 interplay activates MEK1/ERK 1 and 2 to induce growth in human liver and colon cancer. Hepatology, 2013, 57(6):2299-2313.
[9] Xu J, Wu D, Wang S, et al. MAT2B expression correlates with poor prognosis in triple-negative breast cancer. Cancer Manag Res, 2019, 11:5501-5511.
[10] Payon V, Kongsaden C, Ketchart W, et al. Mechanism of cepharanthine cytotoxicity in human ovarian cancer cells. Planta Med, 2019, 85(1): 41-47.
[11] Zhu Q, Guo B, Chen L, et al. Cepharanthine exerts antitumor activity on choroidal melanoma by reactive oxygen species production and c-Jun N-terminal kinase activation. Oncol Lett, 2017, 13(5):3760-3766.
[12] Huang CZ, Wang YF, Zhang Y, et al. Cepharanthine hydrochloride reverses Pglycoprotein-mediated multidrug resistance in human ovarian carcinoma A2780/Taxol cells by inhibiting the PI3K/Akt signaling pathway. Oncol Rep, 2017, 38(4):2558-2564.
[13] Lei Y, Zhang B, Zhang Y, et al. Lentivirus-mediated downregulation of MAT2B inhibits cell proliferation and induces apoptosis in melanoma. Int J Oncol, 2016, 49(3):981-990.
[14] Peng H, Dara L, Li TW, et al. MAT2B-GIT1 interplay activates MEK1/ERK 1 and 2 to induce growth in human liver and colon cancer. Hepatology, 2013, 57(6):2299-2313.
[15] Yuan Y, Wang Y, Liu Z, et al. MAT2B promotes proliferation and inhibits apoptosis in osteosarcoma by targeting epidermal growth factor receptor and proliferating cell nuclear antigen. Int J Oncol, 2019, 54(6):2019-2029.
[16] Gao JL, He TC, Lyu GY. Bioluminescent monitoring the influence of cepharanthine on colon cancer growth in mouse xenograft tumor model. J Zhejiang Chin Med Univ, 2013, 37(9):1055-1059, 1072. (in Chinese)
高建莉, 何通川, 吕圭源. 千金藤素对人结肠癌细胞HCT116裸鼠异体移植肿瘤模型肿瘤增殖的影响及机制初探. 浙江中医药大学学报, 2013, 37(9):1055-1059, 1072.
Effect of cepharanthine on proliferation and apoptosis of cervical cancer cells by regulating MAPK signaling pathway through MAT2B
YIN Yang-feng, JIANG Lei
Department of Pharmacy, Anhui NO.2 Provincial People's Hospital, Hefei 230001, China
To investigate the effects of cepharanthine on proliferation and apoptosis of human cervical cancer cells and its molecular mechanism.
SiHa cells were treated with cepharanthine at different concentrations. Cell viability was tested by methyl thiazolyl tetrazolium (MTT) assay, apoptosis was examined by flow cytometry, and the expression of methionine adnosyltransferase 2B (MAT2B) was detected by real-time quantitative PCR (qRT-PCR) and Western blot, respectively. The optimal drug concentration was also screened. MAT2B small interfering RNA (si-MAT2B) was transfected into SiHa cells and then cell viability and apoptosis were measured. The MAT2B over-expression vector (pcDNA-MAT2B) was transfected into SiHa cells, and the viability, apoptosis, the expression level of phosphorylated p38 mitogen-activated protein kinase (p-p38 MAPK) and phosphorylated extracellular signal-regulated protein kinases 1/2 (p-ERK1/2) were detected after treatment with cepharanthine.
At different times of treatment, with the increasing concentrations of cepharanthine, the viability of SiHa cells was gradually decreased, the apoptosis rate was gradually increased, and the expression level of MAT2B was gradually decreased. It was determined that the optimal concentration was 20 mg/L. After Si-MAT2B transfection, the proliferation of SiHa cells was significantly decreased, and the apoptosis rate was significantly increased (< 0.05). The expression of p-p38 MAPK and p-ERK1/2 protein in SiHa cells was significantly decreased after treatment with cepharanthine (< 0.05). After transfection with pcDNA-MAT2B and then treatment with quercetin, the viability of SiHa cells was significantly increased, the apoptosis rate was significantly decreased, and the expression of p-p38 MAPK and p-ERK1/2 protein was significantly increased (< 0.05) as compared with the group of pcDNA and quercetin.
Cepharanthine inhibits the proliferation and promotes apoptosis of cervical cancer cells by down-regulating MAT2B, and its mechanism is related to the inhibition of MAPK signaling pathway.
Cepharanthine; Cervical cancer; Methionine adnosyltransferase 2B; MAPK signaling pathway; Cell proliferation; Apoptosis
YIN Yang-feng, Email: 4576584@qq.com
尹杨峰,Email:4576584@qq.com
10.3969/j.issn.1673-713X.2020.02.016
2019-10-11

