阿魏酸对2型糖尿病小鼠心肌损伤的影响
王一春,王丽娟,刘萍△
近年来,糖尿病(diabetes mellitus,DM)发病率逐年升高,已成为危害人类健康的主要慢性疾病之一[1]。国际糖尿病联盟研究项目报道,2017 年全球糖尿病患者约有4.51亿,预计2045年全球糖尿病患者 将 达 到 6.93 亿[2]。 糖 尿 病 心 肌 病(diabetic cardiomyopathy,DCM)作为糖尿病并发症之一,主要病理改变为心肌细胞凋亡和左心室肥厚,间质和血管周围组织纤维化,最终发展为心力衰竭,已成为糖尿病患者的主要致死原因[3]。DCM发病机制尚不清楚,高血糖、炎症反应、心肌细胞肥大及纤维化、氧化应激、血管内皮损伤等多种因素均可能参与DCM的发生发展[4-5],因此,寻找安全、有效控制 DCM 的药物,已成为研究的焦点。阿魏酸(ferulic acid)是从阿魏、川芎、木贼、升麻等多种中药提取出的有效单体,具有较强的抗氧化能力,在抗肿瘤、抗氧化、解毒、保肝等方面发挥着巨大的作用,因其性质稳定、毒性低受到人们的广泛关注[6]。有研究报道,阿魏酸具有抗氧化和降血糖作用,对大鼠氧化应激介导的糖尿病心肌病有一定的治疗作用[7]。本研究通过动物实验,探讨阿魏酸对2 型糖尿病小鼠心肌损伤的保护作用及其作用机制,为阿魏酸临床应用提供理论依据。
1 材料与方法
1.1 材料 阿魏酸(128707)购自美国Sigma公司,糖基化终末代谢产物(advanced glycation end products,AGEs)ELISA 试剂盒(JYM0171MO)购自武汉基因美生物技术有限公司,Toll样受体4(Toll-like receptor 4,TLR-4)抗体(ab22048)、核转录因子-ĸB(nuclear factor kappa B,NF-ĸB)抗体(ab16502)均购自英国Abcam公司,核苷酸结合寡聚化结构域样受体3抗体(NACHT-LRR-PYD-containing protein 3,NALP3,A12694)购自中国ABclonal公司,β-actin抗体均购自北京博奥森生物技术有限公司,辣根过氧化物酶标记山羊抗兔IgG(H+L)抗体(ZB-2301)、兔二步法试剂盒(PV-6001)均购自北京中杉金桥生物技术有限公司,蛋白提取试剂盒(R0050)、Masson试剂盒(G1345)均购自北京索莱宝生物技术有限公司,逆转录试剂盒(K1622)、ECL化学发光试剂盒(32106)均购自赛默飞世尔生物技术有限公司,实时荧光定量PCR(Q-PCR)试剂盒(RR820A)购自宝日医生物技术(北京)有限公司,全自动生化分析仪(IDEXX Cataiyst One)购自爱德士缅因生物制品贸易(上海)有限公司,Q-PCR仪(CFX96)、湿转印仪、垂直电泳仪均购自美国Bio-Rad公司。
1.2 方法
1.2.1 实验动物与分组 2 型糖尿病db/db 小鼠和正常db/m小鼠均购自北京华阜康生物科技股份有限公司,体质量18~21 g,4~6周龄,雄性,SPF级。饲养与实验均在宁夏医科大学实验动物中心。db/db 小鼠适应性饲养1 周后,检测血糖,筛选出糖尿病小鼠20只,按小鼠体质量进行编号,随机数字表法分为模型组和阿魏酸组,每组10只;采用相同方法随机抽取10只同周龄的db/m小鼠作为对照组。对照组和模型组灌胃蒸馏水,阿魏酸组灌胃阿魏酸(30 mg/kg)至8周,每天灌胃1 次,8 周后处死[8],取出完整小鼠心脏,称量心脏质量,计算心脏质量指数(心脏质量指数=小鼠心脏质量/小鼠体质量)。
1.2.2 心肌HE 染色、Masson 染色 取相同部位心脏组织,10%福尔马林固定,梯度乙醇脱水,石蜡包埋,3 μm 连续切片,二甲苯脱蜡,梯度乙醇水化,蒸馏水浸洗。常规HE、Masson染色,400倍光镜下观察心脏组织形态变化。
1.2.3 外周血血糖(BG)、肌酸激酶(CK)和肌酸激酶同工酶(CK-MB)、AGEs 检测 末次给药后,吸入麻醉小鼠,迅速摘取眼球取血,分离血清。用全自动生化分析仪测定血清中BG、CK和CK-MB的水平,采用酶联免疫吸附法测定AGEs表达水平。
1.2.4 Q-PCR检测 采用Trizol一步法从心脏组织中提取总RNA,采用反转录试剂盒反转录为cDNA,取反转录产物2 μL作为模板,应用 Q-PCR 仪进行扩增。TLR-4、NF-ĸB 和NALP3部分片段的引物采用Premier 5.0软件进行设计,引物序列见表1。反应条件如下:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s共40个循环,最后72 ℃延伸10 min,-20 ℃保存,以GAPDH 为内参,每组样本设置3 个复孔,采用2-ΔΔCt法表示TLR-4、NF-ĸB、NALP3 mRNA相对表达量,实验重复3次后进行统计分析。
1.2.5 免疫组化染色检测 石蜡包埋的心脏组织经二甲苯脱蜡,梯度乙醇水化,蒸馏水浸洗,抗原修复后,滴加TLR-4(1∶50)、NF-ĸB(1∶200)、NALP3(1∶100)4 ℃孵育过夜;室温复温漂洗后,滴加相对应的二抗37 ℃孵育30 min,4 ℃孵育过夜,磷酸盐缓冲液(PBS)冲洗3 次,DAB 显色,蒸馏水冲洗终止反应,复染,梯度乙醇脱水,二甲苯使切片透明,中性树胶封片,400倍光镜下观察TLR-4、NF-ĸB、NALP3表达情况,阳性反应为棕黄色或黄色颗粒。应用Image-Pro Plus 6.0 图像处理系统测量TLR-4、NF-ĸB、NALP3蛋白的平均光密度值。
1.2.6 Western blot 检测 提取100 mg小鼠心脏组织,加入1mL RIPA裂解液、5 μL磷酸酶抑制剂、5 μL蛋白酶抑制剂,震荡离心30 s,冰上静置 5 min,重复4 次,12 000 r/min 离心15 min后取上清液,BCA法测定总蛋白浓度。定量上样蛋白60 μg,加5×上样缓冲液,蛋白变性、电泳、转膜,含5%脱脂牛奶的 PBST 封闭缓冲液封闭 2 h,加入 TLR-4(1∶500)、NF-ĸB(1∶1 000)、NALP3(1∶500)、β-actin(1∶1 000)抗体,4 ℃孵育过夜,TBST 漂洗 3 次,对应的二抗(1∶5 000)温室孵育 1 h,TBST 漂洗3 次,加入超敏ECL 化学发光剂显影。采用Image J图像处理系统计算样本条带灰度值。

Tab.1 Primer sequence表1 引物序列
1.3 统计学方法 采用SPSS 22.0 进行统计学分析,计量资料均采用均数±标准差()表示,多组样本均数间的比较采用方差分析,组间多重比较采LSD-t法。检验水准α=0.05。
2 结果
2.1 各组小鼠心脏质量指数比较 模型组小鼠体质量、心脏质量和心脏质量指数较对照组明显增高(均P<0.05),阿魏酸干预后,体质量、心脏质量和心脏质量指数较模型组明显降低(均P<0.05),见表2。
Tab.2 Heart mass index of three groups of mice表2 各组小鼠心脏质量指数 (n=10,)

Tab.2 Heart mass index of three groups of mice表2 各组小鼠心脏质量指数 (n=10,)
**P<0.01;a与对照组相比较,b与模型组相比较,P<0.05
组别对照组模型组阿魏酸组F体质量(g)22.819±1.725 44.835±2.575a 41.049±1.911ab 313.578**心脏质量(mg)92.477±6.486 216.930±22.641a 172.607±22.475ab 112.630**心脏质量指数(mg/g)4.057±0.157 4.830±0.282a 4.194±0.370b 21.156**
2.2 各组小鼠心脏组织形态学改变 HE和Masson染色显示,对照组心肌细胞形态完整,心肌纤维排列整齐,横纹清晰,细胞核大小一致,无明显结构改变和间质纤维化。模型组心肌细胞肿胀肥大,心肌纤维排列紊乱,细胞核大小不一,可见明显纤维增生。阿魏酸组心肌细胞肿胀情况较模型组明显减轻,细胞形态较完整,心肌纤维排列较整齐,心肌纤维增生情况明显好转,见图1。
2.3 各组小鼠血清BG、CK、CK-MB、AGEs 水平比较 模型组血清BG、CK、CK-MB、AGEs表达水平明显高于对照组(均P<0.05),阿魏酸干预后,血清BG、CK、CK-MB、AGEs 表达水平较模型组明显降低(均P<0.05),见表3。
2.4 Q-PCR 检 测 心 脏 组 织 中 TLR-4、NF- ĸB、NALP3 mRNA 表达情况 模型组TLR-4、NF-ĸB、NALP3 mRNA 表达水平较对照组明显升高(均P<0.05),阿魏酸干预后,TLR-4、NF-ĸB、NALP3 mRNA表达水平较模型组明显降低(均P<0.05),见表4,图2。
2.5 免疫组化染色检测 TLR-4、NF-ĸB、NALP3 蛋白表达情况 模型组TLR-4、NF-ĸB、NALP3蛋白表达水平明显高于对照组(均P<0.05),阿魏酸干预后,TLR-4、NF-ĸB、NALP3 蛋白表达水平较模型组明显降低(均P<0.05),见表5,图3。
2.6 Western blot 检测 TLR-4、NF-ĸB、NALP3 蛋白表达情况 模型组TLR-4、NF-ĸB、NALP3蛋白表达水平明显高于对照组(均P<0.05),阿魏酸干预后,TLR-4、NF-ĸB、NALP3蛋白表达水平较模型组明显降低(均P<0.05),见表6,图4。
Tab.3 Expression levels of serum BG,CK,CK-MB and AGEs in three groups of mice表3 各组小鼠血清中BG、CK、CK-MB、AGEs水平 (n=5,)
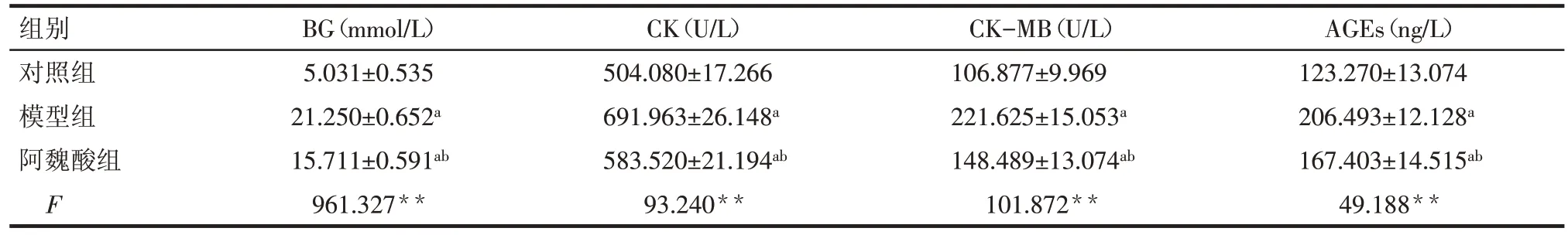
Tab.3 Expression levels of serum BG,CK,CK-MB and AGEs in three groups of mice表3 各组小鼠血清中BG、CK、CK-MB、AGEs水平 (n=5,)
**P<0.01;a与对照组相比较,b与模型组相比较,P<0.05
组别对照组模型组阿魏酸组F BG(mmol/L)5.031±0.535 21.250±0.652a 15.711±0.591ab 961.327**CK(U/L)504.080±17.266 691.963±26.148a 583.520±21.194ab 93.240**CK-MB(U/L)106.877±9.969 221.625±15.053a 148.489±13.074ab 101.872**AGEs(ng/L)123.270±13.074 206.493±12.128a 167.403±14.515ab 49.188**
Tab.4 The expressions of TLR-4,NF-ĸB and NALP3 mRNA in heart cells detected by Q-PCR表4 Q-PCR检测心脏组织TLR-4、NF-ĸB、NALP3 mRNA表达情况 ()
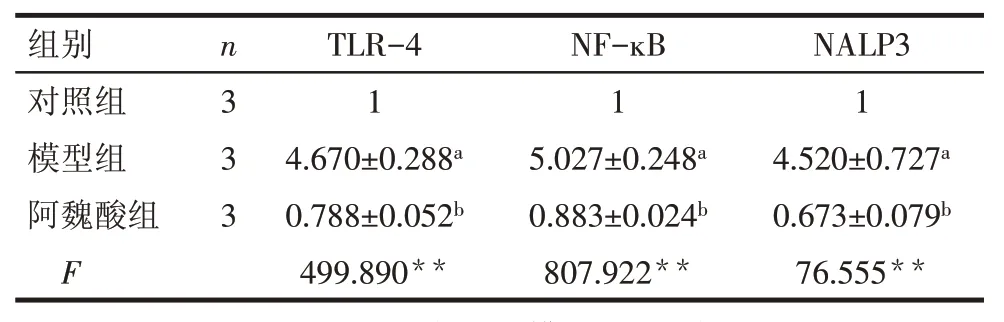
Tab.4 The expressions of TLR-4,NF-ĸB and NALP3 mRNA in heart cells detected by Q-PCR表4 Q-PCR检测心脏组织TLR-4、NF-ĸB、NALP3 mRNA表达情况 ()
**P<0.01;a与对照组相比较,b与模型组相比较,P<0.05
组别对照组模型组阿魏酸组F n3 3 3 TLR-4 1 4.670±0.288a 0.788±0.052b 499.890**NF-ĸB 1 5.027±0.248a 0.883±0.024b 807.922**NALP3 1 4.520±0.727a 0.673±0.079b 76.555**
Tab.5 The expressions of TLR-4,NF-ĸB and NALP3 protein in heart tissues detected by immunohistochemical staining表5 免疫组织化学染色检测心脏组织中TLR-4、NF-ĸB、NALP3蛋白表达情况 ()
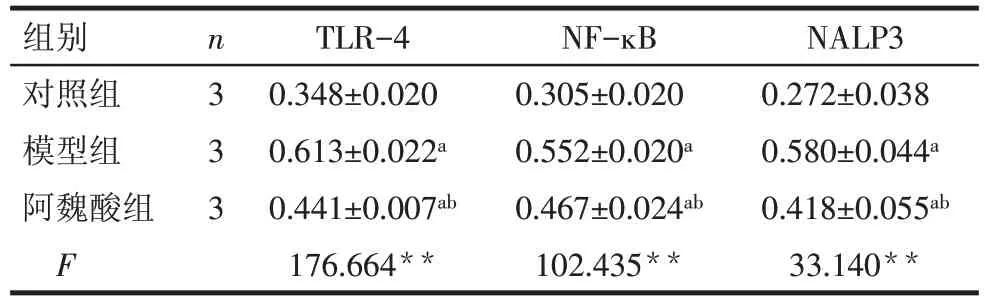
Tab.5 The expressions of TLR-4,NF-ĸB and NALP3 protein in heart tissues detected by immunohistochemical staining表5 免疫组织化学染色检测心脏组织中TLR-4、NF-ĸB、NALP3蛋白表达情况 ()
**P<0.01;a与对照组相比较,b与模型组相比较,P<0.05
组别对照组模型组阿魏酸组F n3 3 3 TLR-4 0.348±0.020 0.613±0.022a 0.441±0.007ab 176.664**NF-ĸB 0.305±0.020 0.552±0.020a 0.467±0.024ab 102.435**NALP3 0.272±0.038 0.580±0.044a 0.418±0.055ab 33.140**
Tab.6 The expressions of TLR-4,NF-ĸB and NALP3 protein in heart tissues detected by Western blot assay表6 Western blot 法检测心脏组织中TLR-4、NF-ĸB、NALP3蛋白表达情况 ()
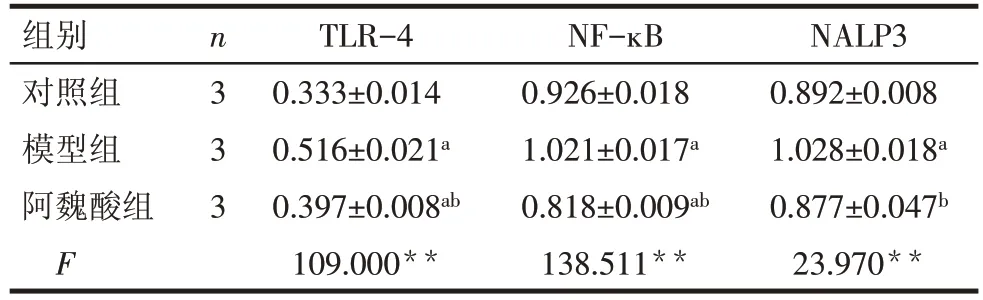
Tab.6 The expressions of TLR-4,NF-ĸB and NALP3 protein in heart tissues detected by Western blot assay表6 Western blot 法检测心脏组织中TLR-4、NF-ĸB、NALP3蛋白表达情况 ()
**P<0.01;a与对照组相比较,b与模型组相比较,P<0.05
组别对照组模型组阿魏酸组F n3 3 3 TLR-4 0.333±0.014 0.516±0.021a 0.397±0.008ab 109.000**NF-ĸB 0.926±0.018 1.021±0.017a 0.818±0.009ab 138.511**NALP3 0.892±0.008 1.028±0.018a 0.877±0.047b 23.970**
3 讨论
3.1 阿魏酸对糖尿病进展影响的研究现状 近年来,糖尿病发病率逐年上升,已成为除肿瘤、冠心病、脑血管病之外第四大威胁人类健康的慢性疾病[9],可引起心肌细胞代谢紊乱、心肌细胞坏死及组织纤维化,最终导致糖尿病心肌病的发生[10],糖尿病患者心血管疾病和心力衰竭的发病率是非糖尿病患者的2~3 倍[11]。阿魏酸在保护心肌缺血、增加冠脉血流量等方面发挥着重要的作用[6]。糖尿病心肌病发病机制复杂,高血糖导致的氧化应激引起的血管内皮细胞和平滑肌细胞损伤是糖尿病心肌病形成的关键,长期高血糖状态会抑制心肌细胞对葡萄糖的利用,促进脂肪酸氧化,进而引起心肌细胞损伤[12]。本研究发现,阿魏酸干预后,糖尿病小鼠血糖水平明显降低,提示阿魏酸可能具有一定的降糖作用。
3.2 阿魏酸对2 型糖尿病小鼠心肌损伤的保护作用 本研究显示,糖尿病可导致小鼠心脏质量指数升高、心肌细胞肥大和心肌纤维化,而阿魏酸干预后,心脏质量指数明显降低,心肌细胞肿胀和纤维增生情况明显好转,提示阿魏酸可能缓解2 型糖尿病造成的心肌细胞纤维化,对心肌细胞损伤具有一定的治疗作用,这与Chowdhury 等[7]的研究结果一致,但本研究并未探讨阿魏酸对糖尿病小鼠心肌肥厚情况的影响,有待进一步研究。CK、CK-MB 是特异性心肌酶,被广泛认为是心肌损伤的重要标志物,其升高程度与心肌损伤程度密切相关,可以反映心肌细胞损伤程度[13]。高血糖环境下AGEs 产生增多,AGEs会引起心肌细胞凋亡和内质网应激反应,而心肌细胞凋亡和内质网应激反应是糖尿病心肌病发生发展的重要环节,AGEs在糖尿病心肌病中发挥着重要的作用[14-15]。本研究发现阿魏酸对糖尿病引起的心肌损伤具有一定的治疗作用,它可能通过抑制AGEs表达,阻止AGEs对心脏血管的损害,进而达到改善糖尿病小鼠心肌损伤的作用,。
3.3 阿魏酸对2 型糖尿病小鼠心肌组织中TLR-4、NF-ĸB、NALP3 表达的影响 TLR-4 作为一种模式识别受体,在心血管内皮细胞和心肌细胞中广泛分布。大量研究表明,TLR-4/NF-ĸB 信号通路与心血管疾病的发生密切相关,TLR-4 可经细胞内传导通路进入细胞核内,激活NF-κB,诱导细胞释放大量炎性因子,导致炎症反应的发生,引起心肌细胞坏死、心肌梗死面积增大、心功能降低[16]。本研究提示阿魏酸可能通过抑制TLR-4/NF-ĸB/NALP3信号通路,使心肌细胞中TLR-4、NF-ĸB、NALP3 活性降低,抑制炎症反应,减少心肌损害,进而达到保护心肌的作用。此外,本研究并未检测小鼠血清中炎症因子的表达情况,TLR-4/NF-ĸB/NALP3信号通路在心肌损伤保护作用中的具体作用机制有待进一步研究证实。
综上所述,阿魏酸具有改善2 型糖尿病小鼠血糖水平,减轻心肌细胞损伤及心肌纤维化的作用,它可能通过抑制TLR-4/NF-ĸB/NALP3信号通路,抑制炎症反应,减少心肌损害,进而达到保护心肌的作用。

