云南药用野生稻幼穗离体培养研究
王玲仙 王波 陈越 付坚 钟巧芳 陈玲 丁明亮 赵才美 雷涌涛 程在全*
(1 云南省农业科学院生物技术与种质资源研究所/云南省农业生物技术重点实验室/农业农村部西南作物基因资源与种质创制重点实验室,昆明650205;2 云南省农业科学院粮食作物研究所,昆明650205;3 云南大学生命科学学院,昆明650091;第一作者:2913380597@qq.com;*通讯作者:czquan-99@163.com)
药用野生稻(Oryza officinalis Wall. ex watt)为多年生禾本科植物,长期处于野生状态,经受各种灾害和地理生态因素的作用,形成了各种抗性和耐受不良环境等优异性状,是天然的基因库[1],具有大穗、宽叶片、粗茎秆等农艺性状,为普通水稻遗传改良提供了重要物质基础。植物愈伤诱导与分化受到多种因素的影响,如:基因型、外植体选择、培养基类型以及它们之间的互作[2]。尽快发掘和利用有利基因,必须建立野生稻高效快繁绿苗培养体系,过去不同学者对野生稻提高绿苗分化率方法上曾做过一些研究[3-5]。本文利用药用野生稻幼穗,重复实验,多组合激素配比筛选出愈伤诱导培养、分化培养和生根培养的培养基。短期内实现遗传背景一致的药用野生稻材料规模化生产,满足以大量药用野生稻为实验材料进行抗性基因和新种质育种研究的需要,为品种资源保存和育种苗提供足够保障。
1 材料与方法
1.1 样品材料
1.1.1 样品来源和采集
样品来源于云南省孟定县,采集当年药用野生稻第二次枝梗原基和颖花原基分化期的幼穗。
1.1.2 幼穗前处理和灭菌处理
将采集的幼穗用保鲜膜包裹好,置于4℃冰箱保鲜层中,低温前处理3~5 d 后将幼穗取出,用70%酒精表面灭菌1 min,再用0.1%的氯化汞灭菌12 min,无菌水清洗6~7 遍,吸水纸吸干多余水分,待用。
1.2 实验方法
1.2.1 幼穗接种预培养
将幼穗剥出,接入不添加激素培养基上进行幼穗预培养,20~35 d 后幼穗萌动出现透明白点,到透明白点增多,待转接。
1.2.2 愈伤组织诱导培养
将增多的透明白点转接到2,4-D 浓度为1.0~10.0 mg/L 的愈伤诱导培养基上进行愈伤诱导培养,每组接种30~35 个萌发白点,35 d 后,愈伤呈透明颗粒状,待转接到增殖培养基中进行增殖培养。
1.2.3 愈伤组织增殖培养
当愈伤长成膨松透明颗粒时,转接到2,4-D 浓度为4.0 mg/L 增殖培养基中进行60 d 增殖培养,30 d 更换1 次培养基,增殖愈伤数量增多时,待转接到继代培养基中进行继代培养。
1.2.4 愈伤继代培养
将数量增多的增殖愈伤转接到2,4-D 浓度为2.0 mg/L 中进行继代培养3 次,每30 d 换1 次培养基,直到长出小芽,待转接进行分化培养;愈伤预培养、诱导、增殖和继代培养,添加培养材料和培养基为:N6、植物凝胶2.8 g/L、蔗糖30.0 g/L、pH 值5.8;愈伤诱导、增殖和继代培养条件为:28℃的人工气候箱中进行暗培养。幼穗接种预培养条件为:光照强度3 000 lx 培养20 d,再下调至1 000 lx 培养35 d。

表1 不同2,4-D 浓度条件下诱导愈伤组织的生长情况
1.2.5 愈伤组织分化成小苗
将愈伤长出的小芽接入6-BA 浓度为0.1~3.0 mg/L 分化培养基进行分化培养,每组接种30~35 个,30 d后,转接到6-BA 浓度为0.5 mg/L 增殖培养基和6-BA浓度为0.2 mg/L 的继代培养基中进行增殖和继代各培养30 d、60 d 后,长出小苗进行壮苗培养。
1.2.6 分化壮苗培养
将继代小苗接种在6-BA 浓度为0.3 mg/L 的壮苗培养基上进行壮苗培养32 d,小苗长至3~4 cm 时,茎秆增粗,叶色油绿,进行生根培养。分化、增殖、继代、壮苗培养基添加激素和培养基为:N6、NAA 0.3 mg/L、ZT 2.0 mg/L、KT 3.0 mg/L;壮苗培养基另外添加TDZ 3.0 mg/L;添加培养材料为:植物凝胶2.8 g/L、蔗糖30 g/L,pH 值5.8;培养条件为:培养温度28℃,光照强度3 000 lx,光照时间12 h/d。
1.2.7 生根培养
将3~4 cm 的壮苗分别接在1/2 N6、NAA 浓度为0.1~2.0 mg/L 的生根培养基上进行生根培养,每组接种10~16 苗,15 d 后,根芽露白、根芽长出,28~36 d 统计主根、须根长、根粗和根数,观察植株生长情况。当生根苗长至7~10 cm 时进行苗锻炼培养。
1.2.8 苗锻炼培养
将长至7~10 cm 的生根苗揭膜加水培养,3 d 后将苗从培养基中取出,自来水冲洗干净根部培养基后加水淹没根部。
生根添加培养材料和培养基为:1/2 N6、植物凝胶2.8 g/L、蔗糖15.0 g /L,pH 值5.8;培养条件为:生根和苗锻炼培养温度28 ℃,光照强度2 000 lx,光照时间12 h/d。
1.2.9 苗的温室定植
苗锻炼培养7 d,将苗从培养箱中取出,单苗移栽在装有珍珠岩、泥炭、蛭石(按3∶2∶1 比例混匀)的盆中进行定植生长,水淹没根部,培养1 周后,将水放干,定根生长7 d,再加水进行培养。
1.2.10 苗的田间移栽和管理
定根苗定植生长40 d 后,将苗移栽到大田,注意有效固根,中期保证水、保肥,注意病虫害的防治,生长中后期进行追施尿素肥1 次,直到种子成熟。
2 结果与分析
2.1 幼穗前处理和幼穗接种预培养
幼穗经过4℃低温前处理3~5 d,利于幼穗萌发。剥离的幼穗接入零培养基上,先强光,再弱关进行幼穗预培养,20 d 后幼穗萌动出现透明白点,继续培养35 d,透明白点增多,有少许白点增大。
2.2 不同2,4-D 浓度对诱导愈伤组织的影响
由表1 可见,设置10 个组合不同浓度激素的N6愈伤诱导培养基,35 d 后,愈伤呈透明颗粒状,在愈伤组织上出现粒状结构的胚状体,与舒理慧等[6]报道类似,此时2,4-D 浓度为2.0 mg/L 的培养基愈伤诱导出愈率最高,达100%(图1)。接入2,4-D 浓度为4.0 mg/L的培养基愈伤,经过60 d 的增殖培养,愈伤颗粒膨大,愈伤数量增多,出愈率在96.7%。增殖愈伤在2,4-D 浓度为3.0 mg/L 的培养基继代培养90 d,愈伤长至1.5~2.0 cm,愈伤透明、膨松,颜色由原来黄绿色变成深绿紧实颗粒愈伤。当2,4-D 浓度为12.0 mg/L 时,愈伤出愈最差,只达到18.8%,褐化严重。

表2 不同6-BA 浓度条件下再生苗的分化生长情况
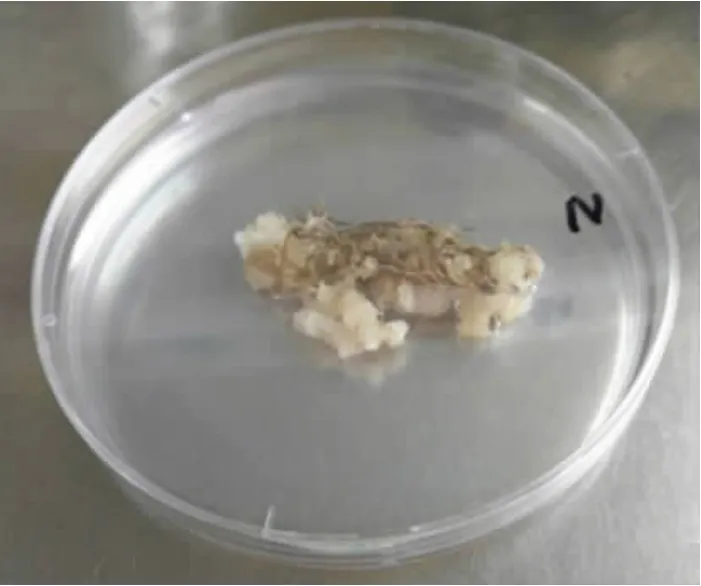
图1 药用野生稻愈伤诱导培养

图2 药用野生稻分化培养
2.3 不同6-BA 浓度对再生苗分化生长的影响
设置10 个组合不同浓度激素的N6 分化培养基,经过90 d 的分化、增殖和继代培养,从表2 可以看出,愈伤在浓度为6-BA 0.1~1.0 mg/L 的分化培养基中都能够分化出苗,成苗率在3.0%~22.9%之间,最佳的分化培养基浓度为6-BA 0.4 mg/L,成苗率达到22.9 %(图2);其次浓度为6-BA 0.5 mg/L 时,成苗率达到15.6%,丛芽增多,此培养基作增殖培养最好。当浓度为6-BA 1.0 mg/L 时,成苗率低,只达到3.0%;小苗生长缓慢、无循环丛芽长出,用于保种、继代培养最适宜;以浓度为6-BA 0.3 mg/L 添加TDZ 3.0 mg/L 作为壮苗培养较好,经过壮苗培养的小苗健壮,油绿。在浓度为6-BA 2.0~3.0 mg/L 的培养基中未分化出绿苗。从10 个组合培养基来看都产生白化苗,最高的白化苗占接种数的25.7%。污染数最高占接种数的17.1%。
2.4 不同NAA 浓度对生根苗生长的影响
设置10 个组合不同浓度激素的1/2 N6 生根培养基,从表3 可以看出,当NAA 的浓度为0.1~0.2 mg/L时,药用野生稻幼穗的平均主根长及生根率均随着激素的增高而增高,主根、须根增粗;NAA 浓度在0.2 mg/L 时,须根最多,生根率最高,达到90.9%(图3);当NAA 的浓度为0.3~0.9 mg/L 时,药用野生稻幼穗的生根率随着激素浓度的增高而逐渐下降,平均主根长也随之降低,平均根粗和须根数量无规律变化,须根根系分蘖强,根系发达;当NAA 的浓度为1.0 mg/L 时,生根率最差,只达到7.1%,平均根长最短、根粗最细。
2.5 苗锻炼及移栽管理
组培苗和自然生长苗生存环境存在着很大差异,组培苗由室内环境逐渐过渡到室外,生长环境由无菌状态变成有菌状态,培养温度和光照条件同样发生了改变。本实验结果表明,生根苗从揭膜、适应常温、温室定植到田间移栽,经历57 d 循序渐进的过程,苗的成活率达到97.0%。
3 讨论
3.1 2,4-D 浓度对药用野生稻幼穗愈伤组织诱导的影响
在药用野生稻幼穗离体培养中,形成愈伤组织和胚性愈伤组织是离体培养中的重要环节。植物生长素是影响水稻愈伤组织诱导的关键因素之一,2,4-D 是诱导水稻组织产生愈伤组织不可缺少的关键激素成分[7-8]。本实验结果表明,幼穗接种预培养后,透明白点增多,应尽快接入诱导培养基中进行愈伤诱导培养。当2,4-D 浓度<1.0 mg/L 或>6.0 mg/L 时都不利于药用野生稻幼穗愈伤和胚性愈伤组织的形成。在幼穗的不同发育时期,都有着不同的生理状态与形态发生规律,其愈伤组织诱导率都会存在一定的差异[9]。本实验发现,在诱导愈伤时,愈伤大约0.3 cm 时会长出细根,说明野生稻根系是比较发达的,愈伤继代几次必须观察愈伤由透明膨松愈伤变成黄绿凸起的紧实颗粒愈伤,此时愈伤用于分化最佳。

表3 不同激素浓度对生根苗的生长情况

图3 药用野生稻生根培养
3.2 生长调节剂对紧穗野生稻幼穗分化成苗的影响
植物生长调节剂是影响愈伤组织再分化的关键性因素之一,细胞分裂素在组织培养中促进细胞分裂和分化,可促进植物细胞的分裂和不定芽的形成,打破顶端优势形成丛生芽,有利于芽的增殖和继代培养[10-12]。6-BA 是诱导水稻愈伤组织再生植株时常用的细胞分裂素[13]。周玲艳等[14-15]认为,6-BA 有利于水稻愈伤组织的分化,选择生长素NAA 与一定比例的细胞分裂素诱导腋芽及不定芽的产生,也是相符合的[16]。在分化培养基中添加KT、ZT 促进成苗而不利于分化[17]。本实验中,与6-BA 搭配使用,芽分化增多,苗分化率明显得到提高。人们发现TDZ 在芽分化、愈伤组织诱导、体胚发生、生根等方面都表现出很强的活性[18]。在药用野生稻分化壮苗培养基中添加TDZ,并与多激素配比,也有利于分化率的提高和壮苗培养。本实验得出,利用生长素和几种细胞分裂素适合的比例联合使用,促进了愈伤绿色凸起增多、丛生芽和新愈伤长出,成苗率得到提高,是药用野生稻幼穗分化的最佳选择。不同品种材料在选择培养基及激素搭配和比例配比时,必须对症下药,方可见效,以免适得其反。
3.3 生长调节剂对紧穗野生稻幼穗生根苗的影响
众所周知,生长素NAA 其主要作用是诱导愈伤组织的形成、胚状体的产生以及试管苗的生根。NAA 浓度0.2 mg/L 时,是最佳的生根培养基,生根率达到90.9%。促进了主根的增长,增多须根,须根分枝强,有利于根系吸收水分和养分。
3.4 苗锻炼及移栽管理
苗的锻炼及大田移栽,从揭膜、放置常温、温室定植到田间移栽经历57 d 这样一个循序渐进的过程,苗的成活率可以达到97.0%。
4 结论
本研究对药用野生稻幼穗离体培养、培养条件、培养方法进行了有效改进;根据不同的生长需要,筛选出适合药用野生稻幼穗愈伤诱导培养、分化培养、生根培养的培养基。4℃低温前处理和幼穗预培养有利于白点萌发的增多和增大,更利于愈伤的出愈率,优质的愈伤提高了药用野生稻幼穗的分化率,高质量的分化率又获得了健壮的药用野生稻幼穗生根苗,实现了建立药用野生稻幼穗离体保存库关键技术的突破。

