麻醉恢复室24例严重低氧血症的回顾性分析
刘晓辉, 刘敬敬, 付广华, 王金平 (山东省聊城市人民医院麻醉科, 山东 聊城 252000)
麻醉恢复室(PACU)是对麻醉后患者进行严密观察和监测, 继续治疗直至患者的生命体征恢复稳定的单元。 尽管多数患者的麻醉恢复过程平稳, 一旦突发术后并发症常可危及患者生命安全。 PACU常见并发症有呼吸系统并发症、 循环系统并发症、 神经系统并发症、 术后出血、 低体温等[1]。 研究显示, PACU患者呼吸系统相关并发症发生率高达22.1%[2], 其中低氧血症是最常见的并发症之一[3]。 患者在一个大气压下呼吸空气时动脉血氧分压(PaO2)低于60 mmHg 或呼吸空气时脉搏血氧饱和度(SpO2)低于90%作为判断低氧血症的标准[4]。 一般PACU低氧血症通常通过唤醒患者, 轻抬下颌, 改善通气并吸氧, 可恢复正常。 但在危急情况下时, 患者SpO2低于90%并进行性下降, 达85%, 口唇发绀, 呼之不应, 需紧急开放气道, 加压通气甚至建立人工气道得以恢复正常SpO2。 如抢救不及时, 可威胁患者生命。 然而, 目前缺乏明确低氧血症的分级标准, 对于威胁生命或难治性低氧血症也没有一个公认的定义[5]。 为此, 我们将PACU严重低氧血症定义为, 麻醉结束后患者已恢复自主呼吸, 由于各种原因在PACU出现SpO2进行性下降, 需要开放气道、 正压通气或建立人工气道才得以恢复正常SpO2的紧急情况。 PACU严重低氧血症影响患者的生命安全, 增加患者非预期转入重症监护病房(ICU)和二次非计划气管插管几率, 增加患者术后呼吸系统并发症, 延长住院时间。 因此, 我科质量与安全管理小组对2015~2017年发生的PACU严重低氧血症病例进行分析, 提出改进措施, 以期为保证围术期患者生命安全, 改进PACU工作质量提供临床指导。
1 资料和方法
应用Docare手术麻醉系统, 回顾2015-01-01/2017-12-31期间收入我院PACU的32 991例患者, 发生严重低氧血症的患者24例, 在科室质量与安全管理小组会议上, 小组成员实施头脑风暴、 进行根因分析, 查找原因并拟定预防措施。
在手术间, 手术结束后满足拔除气管导管条件的全身麻醉患者, 拔除气管导管后转入PACU。 依次进行如下护理: 常规面罩吸氧2~4 L/min; 通过Philip50监护仪连续监测SpO2、 无创动脉血压、 心电图和体温(体温低于35.5 ℃即给予温毯机等保温)。 通过Docare手术麻醉系统实时记录; 采用数字评分法等进行疼痛评估, 疼痛评分>3分给予合适的镇痛措施; 梳理患者各引流管道并评估引流情况; 调整舒适卧位; 同时麻醉医生进行术中麻醉手术的详细床边交接。 恢复过程中在PACU出现SpO2进行性下降, 并需要开放气道、 正压通气或建立高级气道者均视为发生PACU严重低氧血症, 并通过Docare手术麻醉系统不良事件上报模块进行上报, 每月初对上月发生的不良事件在质量与安全管理会议上进行讨论分析。
2 结果
2.1 PACU严重低氧血症发生概况
转入PACU的32 991例患者中, 有25 405例为全麻患者, 且均为拔除气管导管后转入PACU, 共发生严重低氧血症 24例, 占PACU总转入患者的0.07%, 占全身麻醉患者的0.09%, 24例PACU严重低氧血症的基本信息汇总见表1。 24例PACU严重低氧血症患者中有22例经开放气道、 手控正压通气后改善症状, 2例经二次气管插管后改善症状并顺利拔管返回病房。
表1 24例PACU严重低氧血症患者基本资料
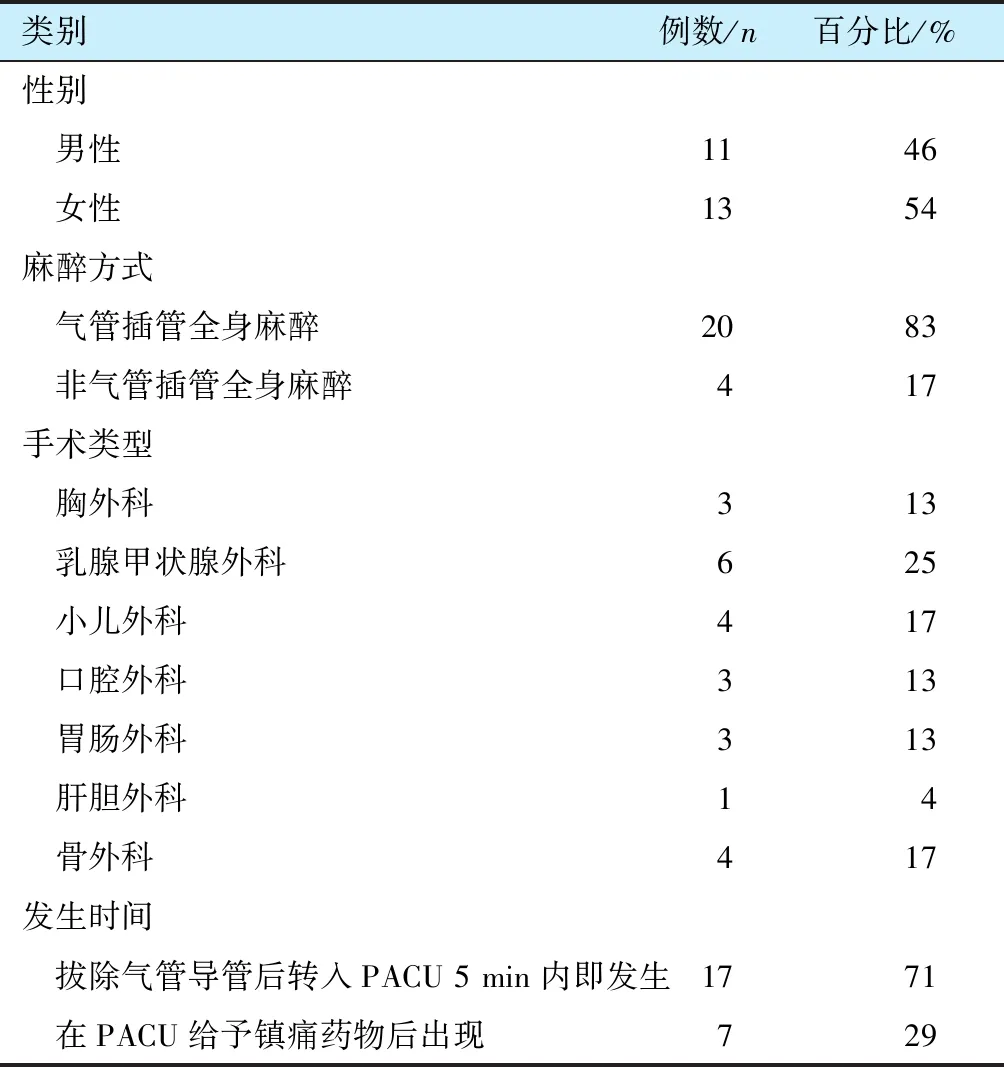
类别例数/n百分比/%性别 男性1146 女性1354麻醉方式 气管插管全身麻醉2083 非气管插管全身麻醉417手术类型 胸外科313 乳腺甲状腺外科625 小儿外科417 口腔外科313 胃肠外科313 肝胆外科14 骨外科417发生时间 拔除气管导管后转入PACU 5 min内即发生1771 在PACU给予镇痛药物后出现729
2.2 根因分析
针对PACU严重低氧血症患者24例, 质量与安全管理小组成员集思广益, 开展头脑风暴, 将PACU内引起低氧血症可能的诱发因素进行分析, 并制作鱼骨图(图1)。 总结24例PACU严重低氧血症的发生原因如下。
2.2.1 术前呼吸系统疾病是PACU严重低氧血症的诱发因素 4例患者中有3例患儿因感冒未痊愈、 口咽分泌物较多诱发喉痉挛出现SpO2进行性下降, 最低至67%, 口唇发绀, 经开放气道, 正压通气后口唇转红润, SpO2恢复至100%。
2.2.2 肌松药物残留可导致PACU严重低氧血症的发生 13例患者(口腔外科手术、 乳腺区段手术)由于手术时间较短, 药物代谢不完全, 肌松药物残留体内, 拔管时机不当而导致呼吸抑制发生低氧血症, 再次给予肌松拮抗, 辅助呼吸后恢复正常。 其中1例患儿行口腔手术, 气管拔管后上级医生嘱静脉注射地塞米松2 mg, 下级医生误将肌松药静脉推注, 入PACU后呼吸停止, 导致严重低氧血症的发生。 发现后立即行气管插管机械通气改善SpO2, 待肌松药代谢完全, 自主呼吸恢复后, SpO2达100%, 拔除气管导管。
2.2.3 应用舒芬太尼处理爆发痛引起的呼吸抑制或胸壁肌肉僵硬 7例患者在PACU出现爆发痛, 疼痛评分(数字评分法)>6分, 给予芬太尼或舒芬太尼后出现呼吸抑制, 其中6例患者置入口咽通气道或鼻咽通气道后症状改善, 1例患者由于连续多次给予阿片类药物, 经气管插管机械通气后改善低氧症状, 待病情稳定顺利拔除气管导管后返回病房。 1例患者因麻醉结束前停止泵注瑞芬太尼, 少部分瑞芬太尼残留在输液管内, 在拔除气管导管转入PACU交接时均全部输入血管, 引起胸壁肌肉僵硬影响呼吸导致PACU严重低氧血症的发生, 通过开放气道正压通气后症状缓解。
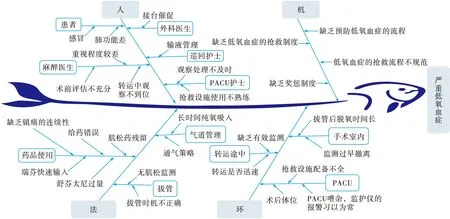
图1 PACU严重低氧血症根因分析
3 讨论
PACU严重低氧血症是非常严重的围术期并发症, 如果处理不及时, 很可能导致患者致残、 致死。 本研究回顾性分析了引起PACU严重低氧血症的原因主要包括术前呼吸系统合并症、 阿片类药物的不规范使用、 缺乏肌松监测肌松药残留、 用药错误等, 针对这些原因, 采取措施, 加强围术期的管理可以确保患者安全, 提高围术期管理质量。
陈潮金等[6]指出, 上呼吸道感染的患儿苏醒期易诱发呼吸道不良事件。 因呼吸系统疾病导致麻醉后气道分泌物增多诱发喉痉挛等也可引起低氧血症的发生。 一项前瞻性观察性研究[7]显示, 麻醉术前评估门诊约6%的患者合并其他疾病, 其中合并呼吸系统疾病的患者达5%。 因此, 麻醉前应正确评估患者的气道情况, 并警惕术前分泌物较多的患者, 建议开展麻醉术前评估门诊, 在术前访视单中注明评估意见, 以规范麻醉前访视流程, 完善麻醉前准备, 提高麻醉前评估质量, 降低围术期相关并发症发生率[8]。
7例患者因爆发痛给予镇痛药物后出现PACU严重低氧血症, 可能与阿片类药物静脉注射后抑制呼吸有关[9]。 手术伤口疼痛是患者发生低氧血症的危险因素之一[10], 正确的疼痛评估、 规范使用镇痛药物、 注重个体化镇痛是预防低氧血症发生的重要环节。 而常用的芬太尼、 吗啡等阿片类药物虽可提供完善的镇痛效果, 但均有较强的呼吸抑制作用。 多模式镇痛是手术后疼痛管理的有效改善方法, 包括超声引导下的外周神经阻滞与切口周围浸润、 非甾体类抗炎药物等的结合[11]。 根据不同手术后预期的疼痛强度实施多模式镇痛, 可使患者镇痛药的需要量明显减少, 药物不良反应发生率降低, 疼痛程度降低[12]。 因此, 建议参照急性疼痛处理指南, 排除禁忌, 把非甾体类药物作为基础用药, 再加用少量的阿片类药物。 同时注意术中镇痛和术后镇痛的连续性, 尤其停用短效瑞芬太尼后长效镇痛药的衔接; 术前或手术结束后, 气管导管拔除前可行超声引导下的外周神经阻滞有效避免急性疼痛的发生并减少阿片类药物的用量; 恢复期使用镇痛药物后还应加强呼吸功能监测, 并备好急救设施。
本研究中13例患者由于肌松药残留导致PACU严重低氧血症的发生。 齐艳艳等[13]在不良事件报告中指出由于拔管时间早, 易致PACU患者低氧或二氧化碳潴留的发生。 由于肌松药个体差异较大, 拔除气管导管前应全面正确评估患者的呼吸功能是否恢复。 拔除气管导管前在没有新斯的明禁忌证的情况下, 常规进行拔管前肌松药的拮抗, 新斯的明0.04~0.07 mg/kg, 阿托品一般为新斯的明的半量, 视患者心率情况进行调整。 拔除气管导管后充分吸净口鼻腔分泌物, 在保证呼吸良好的情况下进行转运。 研究报道[14], 在麻醉过程中实施肌松监测, 有助于麻醉医生选择正确的拔管时机, 减少因拔管后肌松药残留、 拔管不当而导致低氧血症的发生。 建议拔管时根据肌松监测严格掌握拔管指征, 充分评估肌松药残余情况, 尽量避免浅麻醉下反复气管内吸痰刺激气道或拔除气管导管。
24例PACU严重低氧血症患者中有17例患者入PACU 5 min 内即发生低氧血症, 可能与拔管后氧储备不足有关。 气管导管拔除后的转运过程虽然时间较短, 离PACU路程较近, 但均应持续不间断供氧及生命体征监测, 以减少氧气中断的时间; 1例因给药错误发生PACU严重低氧血症, 提醒临床给药时必需遵循双人核对、 三查十对制度, 严格执行安全用药指南, 加强规章制度培训, 严防用药错误的发生。
通过不良事件的回顾性分析, PACU严重低氧血症可防可控, 麻醉前呼吸系统疾病、 阿片类药物的不规范使用、 肌松药残留等是PACU严重低氧血症的诱发因素。 科室质量与安全管理小组运用质量评价工具, 分析原因持续质量改进, 通过麻醉前正确评估, 优化术前访视流程, 针对个体化的多模式镇痛, 加强麻醉监测, 以期降低PACU严重低氧血症的发生, 提高患者恢复质量, 保障患者安全, 改进麻醉工作质量。

