NKX2.5基因c.63 A>G多态性与先天性心脏病关联性的荟萃分析
刘倩,裴建赢,樊文娟,易彬
(甘肃省妇幼保健院 a.科研中心,b.儿科,兰州730050)
先天性心脏病(congenital heart disease,CHD)是由心脏和/或大血管的结构异常导致心功能出现障碍的出生缺陷,每年影响数百万新生儿的健康,其中,以房间隔缺损(atrial septal defect,ASD)最为常见[1]。被称为心脏特异性同源盒的NKX2.5基因是心脏发育过程中最早表达的转录因子,贯穿于心脏发育的全过程,在心脏功能和形态的发生及发育过程中起着重要作用[2]。NKX2.5基因定位于5q3511,互补脱氧核糖核酸 (cDNA)全长1 585 bp,可编码含有324个氨基酸的蛋白质,是与DNA相应的启动子区结合的必需结构[3]。大量证据表明,NKX2.5基因c.63 A>G多态性与CHD遗传易感存在相关,但多数研究结论存在差异,无法得出确定的结论。本研究采用荟萃(meta)分析及系统评价方法探讨NKX2.5基因c.63 A>G多态性与CHD的关联性,以期通过综合分析,为临床提供可靠的实验证据。
1 资料与方法
1.1文献检索纳入与排除标准 计算机检索PubMed、Web of Science、中国知网、万方等数据库,并追查检索文献的参考文献。英文检索主题词为“NKX2.5”,“NKX2-5”,“NK2homeobox 5”,“NK2 transcription factor-related,locus 5”,“congenital heart disease”,“congenital heart defects”,“atrial septal defect”,“ventricular septal defect”,“genetic polymorphism”,“gene polymorphism”。中文检索词为“NKX2.5基因”,“先天性心脏病”,“室间隔缺损”,“房间隔缺损”,“基因多态性”;收集国内外公开发表的NKX2.5基因c.63 A>G多态性与CHD相关的文章,检索时间截止2019年5月31日。纳入标准:(1)已经公开发表的中文和英文文章;(2)评估NKX2.5基因c.63 A>G多态性与CHD发病的关联性;(3)直接或间接报告了等位基因频率和基因型分布的数据,可计算OR值和95%CI;(4)病例-对照研究,包括回顾性/巢式实验对照研究;(5)研究样本量不限制。排除标准:(1)数据缺少或不全;(2)会议摘要和综述;(3)重复发表的文献;(4)非以中文或英文刊出的文献。
1.2资料提取 制定原始信息提取表,收集内容如下:(1)第一作者;(2)发表年份;(3)研究人群的国别;(4)病例组/对照组样本量;(5)CHD具体分型;(6)GG、GA、AA基因型及等位基因频率;(7)进行Hardy-Weinberg平衡(HWE)检验结果;(8)纳入文献质量评分。
1.3文献质量评价 纳入文献的质量评价参考Newcastle-Ottawa Scale(NOS)评分标准[4]。该量表的评分范围为0~9分,当评分≥7分认为是高质量研究。筛选文献、提取数据、质量评价工作由两人独立完成,出现意见不统一时共同讨论解决或由第三人协商直至达成一致。
1.4统计学分析NKX2.5基因c.63 A>G多态性与CHD的关系以各研究合并后的OR值及其95%CI为效应指标,并对此OR值进行Z检验,判断其是否具有统计学意义。异质性检验用Q检验和I2值表示,当I2>50%或P≤0.1时结果存在异质性,使用随机效应模型;反之,使用固定效应模型分析。根据人群国别和CHD分型进行亚组分析寻找异质性来源,采用漏斗图和Egger′s检验对发表偏倚进行识别。敏感性分析采取依次排除单个文献后重新进行meta分析,估计效应大小。所有统计分析均由Stata 12.0软件完成,检验水准α=0.05。
2 结果
2.1纳入文献及特征 共检索相关文献186篇,通过阅读题目和摘要后排除重复的且与NKX2.5基因多态性及CHD无关的文献,并经仔细阅读全文最终纳入18篇文献[5-22]。纳入文献的基本特征见表1。所纳入中文文献8篇[14-21],英文文献10篇[5-13,22],2篇印度人群[6-7],1篇埃及人群[22],15篇中国人群[5,8-21],未检索到欧洲人群相关研究。其中,关于研究NKX2.5基因c.63 A>G多态性与CHD室间隔缺损(ventricular septal defect,VSD)和房间隔缺损(ASD)相关性的文献分别有7篇[5,9,16,18,20-22]和6篇[5,15,18,20-22]。
2.2Meta分析结果 异质性检验结果(表2)表明,该meta分析中GG vs AA基因模型存在异质性(I2=57.4%,P=0.003),同时GA vs AA基因模型(I2=63.3%,P<0.001)以及G vs A等位基因模型也存在异质性(I2=81%,P<0.001),均使用随机效应模型进行合并分析。
进一步对纳入的所有研究进行meta分析结果(表2)表明,NKX2.5基因c.63 A>G多态性与CHD发病风险无关联(GG vs AA:OR=1.13,95%CI:0.79~1.61,POR=0.494;GA vs AA:OR=1.05,95%CI:0.75~1.49,POR=0.77;G vs A:OR=1.09,95%CI:0.88~1.35,POR=0.415)。按照国别进行亚组分析结果显示,NKX2.5基因c.63 A>G多态性与CHD易感性与中国人群(GG vs AA:OR=1.14,95%CI:0.82~1.58,POR=0.432;GA vs AA:OR=0.99,95%CI:0.71~1.37,POR=0.929;G vs A:OR=1.07,95%CI:0.90~1.29,POR=0.444)及非中国人群(GG vs AA:OR=1.28,95%CI:0.06~25.45,POR=0.873;GA vs AA:OR=1.26,95%CI:0.23~6.91,POR=0.787;G vs A:OR=1.44,95%CI:0.35~5.83,POR=0.611)均无相关性;按照先心病具体类型进行亚组分析结果显示,NKX2.5基因c.63 A>G多态性与VSD发病风险无关联(GG vs AA:OR=1.10,95%CI:0.71~1.69,POR=0.669;GA vs AA:OR=0.95,95%CI:0.73~1.23,POR=0.692;G vs A:OR=1.07,95%CI:0.79~1.46,POR=0.654);携带有GA(GA vs AA:OR=0.41,95%CI:0.19~0.89,POR=0.024)基因型的人群ASD发病风险低于AA基因型。
注:ASD,房间隔缺损;VSD,室间隔缺损;HWE,哈迪-温伯格平衡;Y,符合哈迪-温伯格平衡;NA,文章未具体说明。
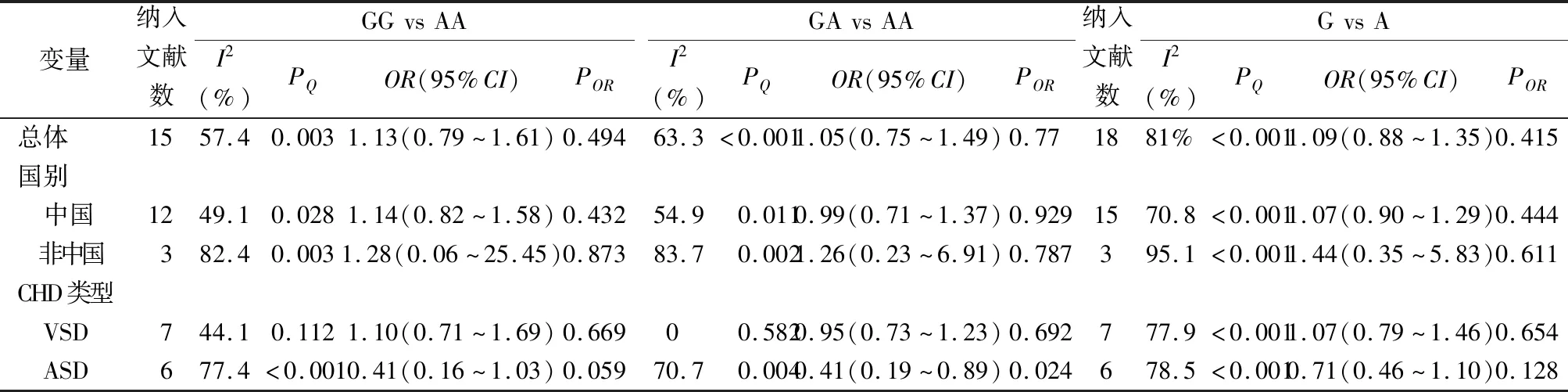
表2 NKX2.5基因c.63 A>G单核苷酸多态性与CHD相关性的分析结果
注:ASD,房间隔缺损;VSD,室间隔缺损;PQ,异质性检验中Q检验的P值;POR,OR进行Z检验的P值。
2.3发表偏倚及敏感性分析 用漏斗图(图1)和Egger′s检验来评价文献发表偏倚,3种遗传模式下的漏斗图对称性较好,Egger′s检验也证实各研究结果之间没有明显的发表偏倚(GG vs AA:t=-0.75,P=0.250;GA vs AA:t=-1.66,P=0.129;G vs A:t=-1.36,P=0.095)。敏感性分析结果表明,依次单独剔除1篇文献后,各遗传模型合并效应量无明显改变,异质性未发生改变,结果与剔除前总体趋势一致,meta分析结果稳定可靠。

注:A,GG/AA与CHD;B,GA/AA与CHD;C,G/A与CHD。
3 讨论
本研究从循证医学的角度入手,利用meta分析对研究目的、内容、类型相同但结果又存在争议的18项研究进行综合分析,结果显示NKX2.5基因c.63 A>G多态性与CHD发病风险无关联。这与以往研究结果不一致[8,18,21]。按照国别进行亚组分析显示,NKX2.5基因c.63 A>G多态性与CHD易感性与中国及非中国人群均无相关性,这与Wang等[23]的meta分析结论不同,考虑到本研究纳入的样本量大于上述文献,且纳入的中国人群研究更多,可能本研究结果更有说服力。本研究进一步按照CHD疾病分型进行亚组分析结果显示NKX2.5基因c.63 A>G多态性与ASD的发病风险相关,这与赵晓波[20]的研究结论一致,结果均显示携带有GA基因型的人群ASD发病风险低于AA基因型。
本研究发现NKX2.5基因c.63 A>G单核苷酸多态性与CHD之间无明显相关性,但与先天性房间隔缺损遗传可能存在相关性。本研究利用漏斗图和Egger′s检验显示不存在明显的发表偏倚,但是由于本研究纳入的文献仅限于中文和英文,且纳入的部分文章研究的样本量较少,可能会造成某些偏倚。不同的地域、生活环境以及膳食结构会导致基因多态性的分布频率存在差异,进而表现出遗传易感性差异,同时,缺乏环境对基因以及基因相互作用的有关数据,限制了交互作用的分析。因此,有必要在多中心、更大样本的高质量病例-对照研究中得出更可信的结论。

