Wnt/β-catenin信号通路在1,25-二羟基维生素D3诱导人急性早幼粒细胞HL-60单核系分化中的作用*
耿逸云,谢晋烨,王伟佳
(1.遵义医科大学珠海校区,广东珠海 519000;2.中山市人民医院检验科,广东中山 528400)
本课题组前期研究发现,甾醇类新药(代号:NSC67657)可通过β连环蛋白相关蛋白1(ICAT)与β连环蛋白(β-catenin)的结合,从而抑制人早幼粒细胞系HL-60的细胞增殖,并促进其向单核细胞分化[1]。1,25-二羟基维生素D3 [1,25-(OH)2-hydroxyvitamin D3,1,25-(OH)2D3]是一种脂溶性维生素,有学者发现,1,25-(OH)2D3可以抵抗肿瘤增殖,并诱导白血病、乳腺癌和结肠癌等细胞分化[2-4]。但1,25-(OH)2D3是否通过ICAT/β-catenin及其下游转录因子T细胞因子1(T-cell factor 1,TCF1)发挥诱导HL-60细胞单核系分化的作用目前尚不明确。本研究旨在探讨β-catenin信号通路在1,25-(OH)2D3诱导HL-60细胞单核系分化中的作用,以期明确介导HL-60细胞单核系分化的关键分子。
1 材料与方法
1.1细胞系、主要试剂及仪器 人髓系白血病细胞系HL-60购自上海细胞库生命科学研究所;1,25-(OH)2D3(美国Sigma公司);细胞培养基IM-DM、胎牛血清(美国Gibco公司);细胞周期试剂盒(美国BD公司);兔抗人c-Myc、cyclin D1、p-pRB、p-β-catenin抗体、兔抗人pRB、TCF1、β-catenin抗体及辣根过氧化物酶HRP标记的羊抗兔IgG二抗(美国CST公司);兔抗人ICAT抗体(美国Abcam公司);CD14-FITC流式抗体及对照抗体(美国BD公司);4′,6-二脒基-2-苯基吲哚DAPI核荧光染料、异硫氰酸荧光素(FITC)标记的驴抗兔二抗(美国Thermo Fisher公司);细胞蛋白抽提纯化试剂盒(上海生工公司);BCA蛋白浓度测定试剂盒(上海碧云天公司)。BX-63正置显微镜(日本Olympus公司);二氧化碳恒温细胞培养箱(美国Thermo公司);L500-A台式低速离心机(湖南湘仪实验室仪器公司);CytoFLEX S流式细胞仪(美国Beckman Coulter公司);ChemicDoc Touch化学发光成像系统(美国Bio-Rad公司);Sunrise酶联仪(奥地利Tecan公司)。
1.2细胞培养 HL-60细胞培养于含10%胎牛血清的IMDM培养基(含100 U/mL青霉素与100 μg/mL链霉素)中,置于37 ℃、5% CO2、饱和湿度恒温培养箱中培养,每3天传代1次。取对数生长期的细胞,调节细胞浓度为5×104/mL,以每孔2 mL的体积将HL-60接种至6孔细胞培养板中,分别以加入2 μL和20 μL 1,25-(OH)2D3储存液(100 μmol/L)作为0.1 μmol/L和1 μmol/L 1,25-(OH)2D3实验组,以加入2 μL的95%乙醇作为对照组。每组设3个复孔。
1.3最适药物浓度及作用时间筛选
1.3.1最适药物浓度的筛选 分别收集0.1 μmol/L和1 μmol/L 1,25-(OH)2D3实验组及对照组培养72 h的细胞,150×g离心5 min,PBS洗涤3次,使用含1%胎牛血清的PBS重悬,配置成1×106/mL细胞悬液。分别取500 μL单细胞悬液,加入5 μL CD14-FITC(1∶100稀释)流式抗体,室温避光温育40 min,使用CytoFlex S流式细胞仪于488 nm通道检测1×104个细胞。采用FlowJo 7.6软件进行分析,以CD14阳性的细胞比例作为1,25-(OH)2D3诱导单核细胞分化效率的检测指标。公式:CD14+(%)=CD14阳性细胞数/10 000×100%,以检测1,25-(OH)2D3诱导HL-60细胞单核系分化的最适浓度。
1.3.2作用时间的筛选 分别使用0.1 μmol/L 1,25-(OH)2D3处理HL-60细胞24、48、72和96 h,收集细胞,重悬为1×106/mL细胞悬液,采用流式细胞术检测CD14阳性细胞比例,以确定1,25-(OH)2D3诱导HL-60细胞单核系分化的最佳作用时间。
1.4流式细胞技术检测细胞周期 收集0.1 μmol/L 1,25-(OH)2D3实验组和对照组处理72 h后的细胞,重悬为1×106/mL的单细胞悬液,PBS洗涤3次,250 μL PBS重悬细胞,将细胞逐滴加入-20 ℃预冷的75%乙醇(750 μL)中,置于-20 ℃固定过夜。150×g离心10 min,弃上清,按照细胞周期检测试剂盒说明书操作,加入50 μL PI/RNase染液重悬细胞,避光温育15 min,2 h内经CytoFlex S流式细胞仪检测,激发波长561 nm。使用FlowJo7.6软件进行作图分析。公式:G0/G1期细胞比例=G0/G1期细胞数/10 000×100%,M期细胞比例=M期细胞数/10 000×100%,S期细胞比例=S期细胞数/10 000×100%。
1.5CCK-8试验检测细胞活力 分别取0.1 μmol/L 1,25-(OH)2D3实验组和对照组细胞,重悬为5×104/mL的单细胞悬液,以每孔200 μL的体积接种于96孔细胞培养板中,每组设5个复孔。继续培养72 h后,加入20 μL CCK-8溶液,37 ℃温育1 h,使用Sunrise酶联仪于450 nm波长检测吸光度(A450 nm)值,并计算细胞活力。细胞活力(%)=(实验组A值-对照组A值)/对照组A值×100%。
1.6瑞氏染色检测单核细胞 收集0.1 μmol/L 1,25-(OH)2D3处理72 h后的HL-60细胞,重悬为1×106/mL的单细胞悬液,取10 μL均匀进行细胞涂片,采用瑞氏染色法染色玻片,静置10 min,流水冲洗,干燥后在光学显微镜下观察细胞形态。公式:单核细胞比例(%)=单核细胞数/100×100%。
1.7western blot检测 收集0.1 μmol/L 1,25-(OH)2D3实验组和对照组处理72 h后的HL-60细胞,重悬为1×106/mL的单细胞悬液,PBS洗涤3次,150×g离心5 min,沉淀加入200 μL RIPA细胞裂解液裂解细胞,按照细胞蛋白抽提纯化试剂盒收集核蛋白,使用BCA蛋白质浓度测定试剂盒检测蛋白质浓度。取60 μg蛋白质进行10% SDS-PAGE凝胶电泳,将凝胶上的蛋白质电转移(300 mA恒流180 min)至PVDF膜上,用70 g/L脱脂牛奶封闭90 min,加入兔抗人c-Myc、cyclin D1、p-pRB、p-β-catenin抗体,兔抗人pRB、TCF1、β-catenin、ICAT抗体(均为1∶1 000稀释)4 ℃振摇过夜。PBS洗膜3次,每次10 min,后加入HRP标记的羊抗兔IgG二抗(1∶3 000稀释)4 ℃温育4 h。采用化学发光法显色,化学发光成像系统进行密度分析。公式:校准灰度值比值=(1,25-(OH)2D3组灰度值/1,25-(OH)2D3组β-actin灰度值)/(对照组灰度值/对照组β-actin灰度值)。
1.8免疫荧光检测β-catenin蛋白的表达与定位 分别收集0.1 μmol/L 1,25-(OH)2D3实验组和对照组处理72 h后的HL-60细胞,重悬为1×106/mL的单细胞悬液,4%多聚甲醛固定15 min,15%小牛血清封闭,PBS洗涤3次后,加入兔抗人β-catenin抗体(1∶200稀释)4 ℃振荡温育过夜。再次洗涤后,加入FITC标记的驴抗兔二抗(1∶200稀释)37 ℃(避光)温育1 h,加入DAPI染料(5 mg/mL,1∶10 000稀释)复染15 min,PBS洗涤3次,晾干后加抗淬灭剂后盖玻片封片。在激光共聚焦显微镜镜下观察β-catenin(绿色标记)的荧光强度并拍照。公式:校准荧光值强度比值=(1,25-(OH)2D3组荧光值/1,25-(OH)2D3组area值)/(对照组荧光值/对照组area值)。

2 结果
2.1最适药物浓度和诱导时间的确定 流式细胞技术检测结果表明,0.1 μmol/L 1,25-(OH)2D3诱导72 h时CD14+%最高,为最适药物浓度,见表1。使用0.1 μmol/L 1,25-(OH)2D3作用细胞72 h时的细胞分化效率最高,为最适诱导时间,见表2。
表1 不同浓度1,25-(OH)2D3诱导HL-60细胞单核系CD14+(%)值的比较

浓度(μmol/L)均值标准差tP01.631.020.196.933.8433.990.00091.094.701.0599.150.0001
表2 不同时间0.1 μmol/L 1,25-(OH)2D3诱导HL-60细胞单核系CD14+(%)值分化的比较

时间(h)均值标准差tP01.601.06247.573.362.400.1384854.7310.957.830.0167292.137.3318.830.0039688.836.6020.130.003
2.21,25-(OH)2D3抑制HL-60细胞增殖及细胞活力结果 流式细胞术检测结果显示,1,25-(OH)2D3作用HL-60细胞后,G0/G1期细胞数比例较对照组明显升高[(65.2±5.3)% vs(49.4±2.2)%],两组间差异有统计学意义(t=4.769,P=0.009)。CCK-8试验结果显示,实验组细胞增殖抑制率较对照组显著升高[(51.4±10.5)% vs(5.36±12.7)%],两组间差异亦有统计学意义(t=4.84,P=0.008)。
2.31,25-(OH)2D3诱导HL-60细胞单核系分化结果 瑞氏染色结果表明,与对照组 [成熟单核细胞比例(0.8±0.2)%]相比,0.1 μmol/L 1,25-(OH)2D3处理72 h后,成熟单核细胞比例为(61.2±13.6)%,两组间差异有统计学意义(t=7.49,P=0.001)。
2.41,25-(OH)2D3下调c-Myc、cyclin D1蛋白的表达水平 western blot结果显示,与对照组相比,1,25-(OH)2D3下调HL-60细胞增殖相关蛋白c-Myc(t=54.64,P=0.001 9)和cyclin D1的表达水平(t=29.24,P=0.001 2),并降低p-pRB/pRB比值(t=150.6,P<0.001),见图1。

图1 细胞分化前后HL-60细胞增殖相关蛋白的表达
2.51,25-(OH)2D3下调核内β-catenin蛋白的表达水平 与对照组相比,1,25-(OH)2D3作用HL-60细胞后,其ICAT蛋白表达上调(t=9.917,P=0.01),TCF1蛋白表达下调(t=54.54,P=0.0003);细胞内β-catenin蛋白的表达水平无明显变化(P>0.99),但其在核内表达下降(t=9.77,P=0.01);p-β-catenin/β-catenin表达水平无明显变化(t=2.511,P=0.129),见图2。

图2 β-catenin相关蛋白的差异表达
2.61,25-(OH)2D3抑制β-catenin入核 1,25-(OH)2D3作用HL-60细胞后,β-catenin(绿色标记)荧光强度减弱(t=16.15,P=0.003 8)。见图3。
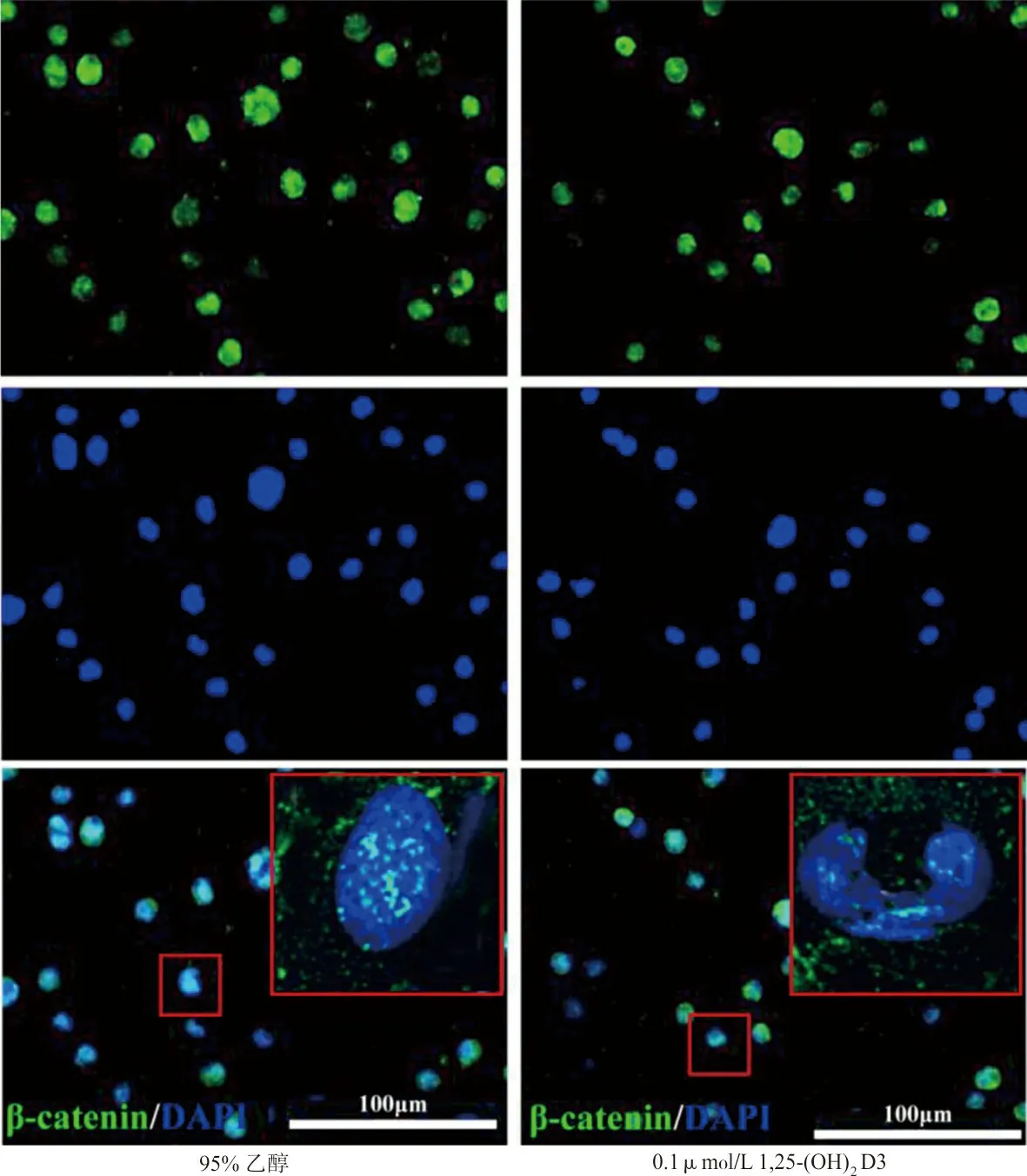
图3 激光共聚焦显微镜下观察β-catenin的表达和定位
3 讨论
1,25-(OH)2D3是一种可以诱导HL-60细胞单核系分化的高效诱导剂[5],常被用于患者完全缓解后维持治疗的唯一药物,可有效延长高危AML患者生存期、降低复发率[6]。1,25-(OH)2D3诱导HL-60细胞单核系分化的机制目前已有多项报道,如其可以直接与维生素D受体(vitamin D receptor,VDR)结合[7],或通过上调CCAAT/增强子结合蛋白(C/EBP) β的表达使HL-60细胞单核系分化[2]。但Wnt/β-catenin信号通路是否参与调控1,25-(OH)2D3诱导HL-60细胞单核系分化的过程目前尚未见报道。Wnt/β-catenin信号通路是本课题组前期研究时采用比较蛋白组学技术在甾醇类新药NSC67657诱导HL-60细胞单核系分化中筛选获得[8],故而本研究拟对其在1,25-(OH)2D3诱导细胞单核系分化中进行验证。
本研究采用流式细胞技术及细胞化学染色技术检测并分析细胞的分化方向,结果发现0.1 μmol/L的1,25-(OH)2D3作用后的HL-60细胞后,其CD14阳性率升高,单核细胞比例升高(P<0.01),提示1,25-(OH)2D3能够诱导其向单核系分化。进一步通过细胞增殖试验及weatern blot检测后发现,0.1 μmol/L 1,25-(OH)2D3实验组细胞增殖抑制率较对照组显著升高(P<0.01),且细胞增殖相关c-Myc,cyclin D1,TCF1蛋白的表达水平和pRB蛋白的磷酸化水平显著下降。此外,本研究还发现,Wnt/β-catenin信号通路相关蛋白ICAT表达上调,细胞核内β-catenin蛋白表达减少,但是细胞内β-catenin蛋白及β-catenin蛋白的磷酸化水平未见明显变化,提示Wnt/β-catenin信号通路参与了1,25-(OH)2D3诱导HL-60细胞单核系分化的进程,与本课题组前期研究结论较为一致[1]。
Wnt/β-catenin信号通路的异常激活是肿瘤发生的重要机制之一,β-catenin的过表达是此通路激活的主要表现[9-11]。研究表明,磷脂酶D1(PLD1)抑制剂作用于结肠癌细胞,上调ICAT蛋白表达,下调β-catenin/TCF4蛋白表达,抑制c-Myc蛋白的表达[12]。另有学者证实,白藜芦醇可使胃癌细胞中β-catenin/TCF4蛋白表达下调,抑制肿瘤细胞的增殖与侵袭[13]。而敲除TCF1能抑制白血病细胞在裸鼠中的存活和扩增[14-15]。以上研究提示,Wnt/β-catenin信号通路可能是肿瘤治疗,尤其是白血病化疗的新靶点。
目前临床用于AML治疗有效的靶向药物较少,且缺乏早期诊断、化疗耐药监测的标志物。本研究证实1,25-(OH)2D3通过抑制Wnt/β-catenin信号通路,抑制HL-60细胞增殖并促进其单核系分化,为AML的诱导分化和精准治疗提供了思路,但1,25-(OH)2D3是否通过ICAT抑制Wnt/β-catenin信号通路目前尚未确认,其在早期诊断和化疗耐药中的地位仍需进一步探讨,也是我们今后工作的研究重点。

