冬季干旱胁迫后复水对鼠茅草生理特性的影响
曹雨欣,张广娜,*,王芸,林祥杰,于军香,郑亚琴
(1.临沂大学农林科学学院,山东临沂 276005;2.山东省水土保持与环境保育重点实验室,临沂大学资源环境学院,山东临沂 276005;3.临沂大学药学院,山东临沂 276005)
干旱胁迫对植物的外部形态、内源激素、光合作用等多方面产生影响[5-6]。长期而严重的干旱胁迫可抑制植株生长,并引起外观形态和生物量的变化,甚至会导致植物死亡[7];而短期干旱胁迫后复水,使部分生理指标得到不同程度的恢复,既保证了植物的生长发育需求,又做到了节水[8-9]。国内外关于干旱胁迫对植物影响的研究主要集中在膜结构与功能、光合作用、细胞器超微结构、酶活性及物质代谢等生理过程及生理机制方面,并取得了明显的进展[10-12]。近几年的研究结果表明,植物会作出包括基因表达在内的各种适应性调节反应,使自身作出最优化的选择来提前抵御干旱胁迫造成的植物各器官的损伤。因此,干旱会触发植物抵御干旱胁迫的主动保护机制,并诱导植物各组分含量的变化。植物因水分胁迫引起了代谢上的变化与调整,可能与自身相关基因的调控有关[13-14]。前人对鼠茅草的研究多集中于鼠茅草作为生草品种对果园土壤及小气候的影响方面[15-17],而对于鼠茅草本身受环境影响而产生变化的研究较少。
临沂市是山东省果业大市,水果种植面积大,产量高。截至2017 年,山东省临沂市水果园面积10.8 万hm2,总产量达到299 万t。其中主栽果树面积如下:桃4.67 万hm2、苹果2.53 万hm2、山楂0.68 万hm2、葡萄0.39 万hm2、梨0.34 万hm2、樱桃0.27 万hm2。近年来,临沂市在多个现代农业产业技术体系示范推广基地进行了鼠茅草生草示范,但因果园多分布在丘陵山地,冬季灌溉条件差。本文针对鼠茅草生草冬季缺水问题,设计了鼠茅草冬季断水试验,探讨了鼠茅草冬季断水后复水对鼠茅草生理指标的影响,以期为鼠茅草后期在丘陵山地的推广提供理论依据和数据支撑,对于解决鼠茅草在干旱胁迫条件下的越冬问题,指导果园实际生产及生态可持续发展具有重要意义。
1 材料和方法
1.1 试验材料
供试材料为鼠茅草,种子购于嘉禾源硕公司购得。PVC 管内径25 cm,采用商品花卉用栽培基质,根据PVC管高度适当填充。
1.2 试验设置
盆栽试验于2018 年10 月中旬在室外种植。设置干旱胁迫、正常水分处理,每个处理重复3 次,每管播种20粒,每15 d 浇水一次,每次200 mL。1 月中旬临沂市各地最低气温降至0 ℃以下,结冰状态下丘陵山地无法进行冬季灌溉时,试验进行断水,对照处理(水分处理)仍隔15 d 浇水200 mL,干旱胁迫处理不浇水。鼠茅草干旱胁迫处理断水60 d 后,干旱胁迫处理与对照处理均每隔15 d 浇水200 mL,复水35 d(复水后浇水两次,第二次浇水后第5 d),采集鼠茅草叶片测定各项生理指标,如叶绿素含量、电解质渗透率、丙二醛(MDA)含量和可溶性蛋白含量,并测定地上部分及地下部分生物量,每个重复采集一株鼠茅草进行根系扫描。
1.3 鼠茅草生长生理指标测定
采集干旱胁迫后复水处理(DF)及正常水分处理(WF)的鼠茅草样品,鼠茅草叶片叶绿素含量采用95%的乙醇避光浸提,用Agilent Cary 100 紫外-可见分光光度计在波长665 nm 和649 nm 处测定吸光度,通过计算得出叶绿素a、叶绿素b 和总叶绿素含量[18]。可溶性蛋白含量采用考马斯亮蓝法测定[19];叶片电解质渗透率采用电导法测定[20];MDA 含量采用硫代巴比妥酸法(TBA)进行测定[21-22];鼠茅草地上部、地下部生物量参考杨丽辉等[23-24]的方法测定;鼠茅草根系采用EPSON Expression 1680 根系扫描仪进行扫描,WinRHIZO Pro 2005 软件进行根系形态与结构分析。
1.4 数据分析与作图
叶绿素含量计算公式见式(1)(2)(3)。叶绿体色素的含量计算公式见式(4)。
式中,Chla、Chlb分别为叶绿素a、b 的含量,Chl为总叶绿素的含量;A665nm和A649nm分别为叶绿体色素提取液在波长665、649 nm 处的吸光度。
采用软件SPSS 16.0 对所得数据进行统计分析,处理间各指标差异采用t 检验方法进行分析,显著性水平为0.05。
2 结果与分析
2.1 冬季干旱胁迫后复水对鼠茅草叶片叶绿素的影响
植物体进行光合作用的强弱可以通过测定植物体内叶绿素含量的变化进行推断。因此,叶绿素含量是反应植物光合效率的重要指标[25],不仅可以体现干旱胁迫下光合作用受到抑制的程度,也可以体现植株在复水后恢复能力的大小。图1 显示了干旱胁迫复水后与正常水分处理下鼠茅草叶片叶绿素含量,由图可知,在干旱复水后,鼠茅草叶片的叶绿素a 和总叶绿素含量均显著低于同期对照处理下的鼠茅草叶片的叶绿素含量,分别减少了53.53%、25.84%;两处理的叶绿素b 含量差异不显著。
当今中国社会提倡“全民创业,万众创新”,高职院校应积极响应,将创新创业教育贯穿人才培养全过程, 以学生创新精神、创业意识和创新创业能力培养为重点,组建创新型社团,结合高职院校创新创业教育课堂主渠道作用,促进专业教育与创新创业教育有机融合,深化课上、课下融通改革,提高学生的实践与就业能力、创新与创业能力,学生整体素质全面提升的同时,促进了校园文化建设。
2.2 冬季干旱胁迫后复水对鼠茅草可溶性蛋白的影响
植物体内积累的可溶性蛋白越高,细胞的渗透势就会越低,并有利于抵抗干旱胁迫中水分亏缺对植物生命活动的威胁。由图2 可知,干旱胁迫复水后鼠茅草叶片可溶性蛋白含量显著高于对照处理,DF 处理叶片可溶性蛋白含量高出WF 处理的49.3%。
2.3 干旱协迫后复水对鼠茅草电解质渗透率的影响
电解质渗透率的大小反映了细胞膜破坏程度大小和植株受损程度的高低。电解质渗透率越大说明膜透性越大,细胞膜的流动性越差,植物损伤越严重。由图3 可知,复水后的鼠茅草叶片电解质渗透率显著高于同期对照的,增加了65.30%,说明干旱胁迫对植株造成的伤害在复水后未完全缓解。植株的渗透调节机制在干旱胁迫下受到了一定程度的损伤,复水后并不能迅速恢复。
2.4 冬季干旱胁迫后复水对鼠茅草丙二醛含量的影响
MDA 含量的高低在一定程度上能反映膜脂过氧化作用水平和膜结构受害程度的大小。因此膜的受损程度可以通过MDA 含量间接推测出来。MDA 大量增加时,表明干旱胁迫越严重,对细胞膜伤害程度也就越严重,体内细胞受损程度越高。由图4 可知,复水处理的鼠茅草叶片中过氧化物MDA 的含量显著大于同期对照,表明干旱引起细胞氧化作用,复水后细胞内环境还不够稳定,自身调节机制受损,不能很快恢复到正常水平。
2.5 冬季干旱胁迫后复水对鼠茅草生物量的影响
生物量是植物生长状况的综合反映。如图5 所示,复水后鼠茅草地上部分的生物量与地下部分的生物量均显著低于同期对照组的生物量。地下部分的生物量DF 处理和WF 处理相差3.7 倍,地上部分两处理间相差1.7倍,地下部生物量受干旱胁迫影响更明显,说明即使经过复水,干旱对根系生物量的抑制作用还是很大,且程度远大于对地上部分的抑制作用。
2.6 冬季干旱胁迫后复水对鼠茅草根系的影响
根据表1、2(见下页)可以看出,复水后干旱胁迫处理鼠茅草根长及根面积均显著低于对照处理,且3.5~4 mm 和4~4.5 mm 根径范围的根长有缺失。由表2 可知,干旱协迫处理中较粗根系的根表面积未检测出,说明干旱胁迫影响了鼠茅草根系的伸长和变粗,植株正常的生理生长活动受到了损害,即使在复水后仍无法迅速恢复到正常水平。
3 讨论
叶绿体是植物进行光合作用的场所,叶绿素是参与光合作用的主要色素。可能是由于干旱胁迫导致植物失水,从而促进叶绿素a 的分解且影响叶绿素的合成,即叶绿素a 的合成减少和分解加速是叶绿素a 含量在干旱胁迫下降低的主要因素,干旱导致植物叶片叶绿素a 含量降低且复水后并没有得到及时的恢复。复水后叶绿素b的含量高于对照15.29%,可能是因为干旱胁迫抑制了叶片的生长,对叶绿素b 的合成受阻或分解程度影响较小,导致叶绿素b 产生浓缩现象[26],但是与正常水分处理相比,试验处理下未达到显著差异。由此可以推断干旱胁迫对鼠茅草叶绿素a 的破坏程度比较高,叶片叶绿素a含量恢复难度较大;对叶绿素b 的破坏程度较小,叶片叶绿素b 的含量恢复较容易。由于叶绿素a 的功能主要是将收集来的光能转化为化学能,而叶绿素b 的功能则是收集光能[27]。可以推测,干旱胁迫期间光合器官及功能受到严重影响,导致光合速率受到影响后可恢复程度比较差。复水后,鼠茅草叶片可以正常对光能进行捕获,但不能将光能完全转化为化学能,致使光合机构受到光氧化的破坏,降低了转化效率,从而导致光合速率与光合生产力下降,造成恢复困难。
植物在受到干旱胁迫时,植物体内蛋白质的合成受到抑制且蛋白质的降解速度加快,同时植物体会被诱导产生一些抗逆蛋白质,这些新增加蛋白质的种类和数量与植物的抗旱性密切相关。王林蒿等[28]的研究显示,干旱胁迫下,可溶性蛋白含量增加的原因可能是细胞内合成了更加稳定的同工酶。作为调节渗透的物质之一,可溶性蛋白具有很强的吸水性,以小分子状态溶于水或其他溶解剂,并作为一种重要的有机溶剂存在于细胞质中。细胞维持较低的渗透势可以通过提高可溶性蛋白的含量、细胞内溶质浓度、增强蛋白与蛋白之间的水合作用、降低水势等方法,使细胞能从外界继续吸水,抵抗水分胁迫带来的伤害。可溶性蛋白的稳定有利于创造一种起保护作用的水相环境,使植物能正常生长[29]。复水后的鼠茅草叶片中可溶性蛋白含量大于同期对照,说明复水后并没有完全消除干旱胁迫对鼠茅草内部环境的损伤。
渗透调节系统是植物受到干旱胁迫时最重要的自我调节途径之一,各项生理活动的有序进行依赖渗透调节系统。电解质渗透率是能够反映植物细胞膜透性的重要指标。细胞电解质外渗是干旱胁迫下细胞膜受伤后细胞溶质向外渗漏的现象。植物受到逆境伤害时,细胞膜是植物受害的主要部位。自由基生成与膜保护反应之间的动态平衡受到破坏,膜脂由液晶态转变为凝胶态,使得膜流动性下降,透性增加,细胞内物质外渗,电解质渗透率增加,细胞功能下降[30]。电解质渗透率的大小反映了细胞膜破坏程度大小、植株的受损程度的高低。电解质渗透率越大说明膜透性越大,细胞膜的流动性越差,植物受损伤越严重。复水后的鼠茅草叶片电解质渗透率显著高于同期对照的电解质渗透率,说明干旱胁迫对植株造成的伤害在复水后未完全缓解,植株不能迅速恢复。

表1 不同处理条件下鼠茅草根系长度Table 1 The root length of Vulpia myuros C.Gmelin under DF and WF treatments
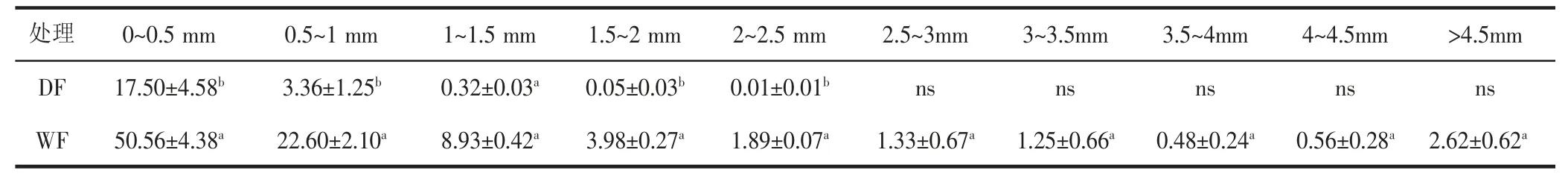
表2 不同处理条件下鼠茅草根表面积Table 2 The root surface area of Vulpia myuros C.Gmelin under DF and WF treatments
受到干旱胁迫后,植物体内就会因为活性氧的产生与清除之间的平衡遭到破坏而产生过量的活性氧[31]。若不及时清除会引起膜脂发生过氧化反应,从而破坏细胞膜。细胞膜不仅作为动态屏障处于细胞内部和外部环境之间,还承担着信息传递与物质交换的作用。MDA 是植物细胞膜脂过氧化反应产生的高活性过氧化物之一,会引起蛋白质、核酸等生命大分子的交联聚合,并影响构成细胞质膜包括叶绿体片层膜在内的物质组分,导致膜结构改变,影响膜的流动性及其与酶的结合力[32];且MDA具有细胞毒性,能够破坏膜系统,使膜透性增大,并损伤多种酶的生理功能。MDA 含量的高低在一定程度上能反映膜脂过氧化作用水平和膜结构受害程度的大小。复水处理的鼠茅草叶片中MDA 的含量显著大于同期对照,表明干旱引起细胞氧化作用,复水后自身调节机制受损,不能很快恢复到正常水平。
生物量是植物生长状态的综合反映。干旱胁迫之所以能抑制植物的生长、发育,进而影响植物的产量,主要是通过抑制植物的光合作用、降低光合效率来实现的[33]。受到干旱胁迫并复水后,虽然地上部分生长受到抑制,降幅较小,但是地下部分根系受到干旱胁迫影响可能更大更直接,所以导致总生物量降幅较大。地下部降幅较大,这可能是在旱胁迫条件下,植物根系吸收不到足够的水分和养分,各器官的生长发育都受到限制,导致地下部分生长受到更大的抑制,鼠茅草生物量更偏向于分配到叶片,增加光的接收面积,从而有效提升地上部分的光合作用效率,产生更多的干物质供生长发育使用,帮助植株更好的恢复,并使根系保持一定的活力。同时,在土壤水分亏缺条件下植物倾向于将更多的资源分配给地上部分,或从地下部分转移到地上部分,以提高竞争生长的能力,故地上部分生物量受影响相对较小[34]。植物对于一定程度的干旱胁迫和复水会做出相应的适应过程,一般为生理上的补偿。但由于复水后鼠茅草地下部分没有得到更好的发育,导致地上部分进行光合作用等各项生理活动时所需营养与水分不能通过根系传递上来,因此鼠茅草复水后并不能很快的恢复,需要一定的时间与过程。
根系是鼠茅草吸收水分的主要器官,干旱来临时最先感知,并迅速产生化学信号向上传递,以促使气孔关闭,减少水分散失,影响着整株的生理生化特性[35]。植物的生理变化也会受到周围环境的影响,一方面环境影响了植物的生理变化,另一方面通过植物的生理变化,使其对于周围环境的适应性加强。因此,植株作为一个整体,需要自身各部分协同作用对外界做出响应,从而更好地适应环境。各个生理生化特性间相互协调、相互制约、相互影响,构成了一个调控网络[36]。因此根系的生长状况可以反映出植株的生长状况。
4 结论
通过模拟冬季干旱胁迫后复水对鼠茅草生长发育的影响,发现冬季干旱胁迫复水后对鼠茅草有显著抑制作用,且对根系的抑制比对地上部分的抑制作用强。即使春季复水,冬季干旱胁迫处理仍然对鼠茅草生理指标有显著影响,如显著增加了电解质渗透率、MDA 含量、可溶性蛋白含量,对鼠茅草地上和地下部生物量有显著抑制作用,说明复水后干旱胁迫对鼠茅草的影响仍然存在。本文研究结果表明在不具备冬季灌溉条件的果园,鼠茅草生草后可冬季适当断水,对其生命不存在较大影响,但春季来临后,应及时灌水以增加鼠茅草的光合作用,促进其生长发育。

