美洲大蠊酶解液冻干粉多糖含量测定及药理活性研究
李佳怿 陶然 陈美琪 王娅玲 王集会


摘 要:研究了美洲大蠊酶解液凍干粉(LPEHPA)多糖含量及对多种肿瘤细胞株增殖的抑制作用、对非洲绿猴肾细胞株的抗氧化作用以及对脂多糖(LPS)诱导的小鼠巨噬细胞的抗炎作用。采用水提酶解法提取美洲大蠊的有效成分,通过苯酚硫酸法测定多糖含量,MTT法测定其对Bel-7402、A549、M231及MCF-7 四种不同的肿瘤细胞株的抑制率;建立过氧化氢诱导的氧化损伤模型,MTT法观察药物介入后的细胞存活率;酶联免疫法检测细胞上清液中炎症因子TNF-α和IL-6的浓度。结果LPEHPA中多糖含量为4.72%;对四种肿瘤细胞最高抑制率分别为65.02%、76.05%、62.92%和65.10%;LPEHPA对非洲绿猴肾细胞株(Vero)有明显保护作用,浓度为1 mg·mL-1时,与对照组相比细胞存活率提升了37.52%;脂多糖诱导炎症后,与模型组相比,加药组TNF-α、IL-6浓度显著减少,与空白组相比具有显著性差异。通过对LPEHPA药理活性结果分析,LPEHPA在机体可承受毒性范围内,具有良好的抗肿瘤、抗氧化及抗炎活性。
关 键 词:美洲大蠊;抗肿瘤;抗氧化;抗炎
中图分类号:TQ 016 文献标识码: A 文章编号: 1671-0460(2020)03-0575-05
Determination of Polysaccharide Content and Pharmacological Activity of Lyophilized Powder Extracted From Periplaneta Americana
LI Jia-yi1, TAO Ran1, CHEN Mei-qi2, WANG Ya-ling1, WANG Ji-hui3*
(1. School of Pharmacy, Shandong University of Traditional Chinese Medicine, Shandong Jinan 250355, China;
2. School of Traditional Chinese Medicine, Shandong University of Traditional Chinese Medicine, Shandong Jinan 250355, China;
3. Experimental Center, Shandong University of Traditional Chinese Medicine, Shandong Jinan 250355, China)
Abstract: To study the content of polysaccharides in the lyophilized powder of enzymatic hydrolysate of Periplaneta americana (LPEHPA) and the inhibitory effect of Periplaneta americana on the proliferation of various cancer cells, the antioxidant effect of Vero cell lines and the anti-inflammatory effect on lipopolysaccharide (LPS)-induced mouse macrophages,the effective components of Periplaneta americana were extracted by water extraction and enzymatic hydrolysis, and the content of polysaccharides was determined by phenol sulfuric acid method. The inhibition rates of Periplaneta americana against four different tumor cell lines Bel-7402, A549, M231 and MCF-7 were determined by MTT method. The oxidative damage model induced by hydrogen peroxide was established, and the cell survival rate after drug intervention was observed by MTT method. The concentration of TNF-α and IL-6 in cell supernatant was measured by enzyme-linked immunoassay. The results showed that, the content of polysaccharides in LPEHPA was 4.72%. The highest inhibition rates of the four tumor cells were 65.02%, 76.05%, 62.92% and 65.10%, respectively. LPEHPA had significant protective effects on African green monkey kidney cells (Vero), and cell viability increased by 37.52% compared with the control group with the concentration of 1 mg·mL-1. After induction of inflammation with LPS, the concentration of TNF-α and IL-6 in the medicated group was significantly reduced compared with the model group, and there was a significant difference compared with the blank group.The analysis results of the pharmacological activity has proved that LPEHPA has good anti-tumor, anti-oxidation and anti-inflammatory activities in the range of sustainable toxicity.
Key words: Periplaneta americana; anti-tumor; antioxidant; anti-inflammatory
美洲大蠊 Periplaneta americana (L.)为昆虫纲,蜚蠊目,蜚蠊科,俗称“蟑螂”。在《神农本草经》、《新修本草》等古籍中均有记载,具有利水消肿、活血散瘀、解毒消疳等多种功效,多项文献记载美洲大蠊具有抗肿瘤、抗氧化、抗菌、增强免疫等多种治疗作用[1]。本实验在前期美洲大蠊水提液总蛋白及总糖胺聚糖工艺优化条件的前提下,重点研究了LPEHPA中多糖的含量以及其对多种肿瘤细胞株的体外增殖抑制效果、对非洲绿猴肾Vero细胞株的抗氧化活性以及对RAW264.7细胞株的抗炎作用等,为进一步研究美洲大蠊药效成分及体内外药理活性提供基础。
1 实验部分
1.1 仪器
PHS-25 型 pH计(上海仪电科学仪器股份有限公司);KQ-500E 型超声波清洗器(昆山市超声仪器有限公司);FA1004N 电子天平(上海精密科学仪器有限公司);ST-16R高速冷冻离心机(赛默飞世尔科技(中国)有限公司);远红外辐射干燥箱(海阳光实验仪器有限公司);EL340i型全自动酶标仪(Molecular Davices);TS100型倒置显微镜(日本尼康);UV9100B型紫外可见分光光度计(北京莱伯泰科仪器有限公司)。
1.2 试剂与材料
胰蛋白酶(上海源叶生物科技有限公司);DMEM培养基(美国Gibco公司);PBS磷酸盐缓冲溶液(美国Hyclone公司);FBS胎牛血清(浙江天杭生物科技股份有限公司);胰酶细胞消化液(美国Hyclone公司);双抗(美国Hyclone公司);小鼠TNF-α、IL-6酶联免疫分析试剂盒(江苏晶美生物科技有限公司);所用试剂均为分析纯。肝癌Bel-7402细胞株、乳腺癌M231细胞株、乳腺癌MCF-7细胞株、肺腺癌A549细胞株、非洲绿猴肾Vero细胞株均由山东省立医院提供。
1.3 材料
美洲大蠊,购于河北安国中药材市场,经山东中医药大学高德民副教授鉴定为蜚蠊目蜚蠊科大蠊属美洲大蠊Periplaneta americana(L.)。
2 实验方法
2.1 LPEHPA制备方法
将美洲大蠊清洗、匀浆、冷冻干燥、粉碎、过40目筛备用。精密称取美洲大蠊冻干粉3份,每份1.000 g,分别加入到100 mL具塞锥形瓶,以固定温度50 ℃ 超声20 min,向超声后美洲大蠊提取液中加入胰蛋白酶2 000 U,在37 ℃,pH=8的条件下,酶解3 h,每小时调一次pH值。酶解液40 ℃条件下超声70 min充分提取有效成分,提取液在
3 000 r·min-1离心10 min,取上清液抽滤,并定容到100 mL 容量瓶中,冷冻干燥[2],得LPEHPA。
2.2 总多糖的测定
2.2.1 标准曲线的绘制
精确称取无水葡萄糖1.250 g,至250 mL容量瓶中加蒸馏水定容,取1 mL于50 mL容量瓶,定容。分别取0、0.2、0.4、0.6、0.8、1.0 mL至试管,并分别加入蒸馏水补足1 mL,分别加入6%苯酚1、5 mL浓硫酸震荡,反应15 min,于490 nm处测定吸光值,得标准曲线回归方程为Y=0.961X+0.019 8( R2=0.998 1),表明葡萄糖标准溶液在吸光度线性范围内线性关系良好[3,4]。
2.2.2 提取率计算
取上述LPEHPA0.5 g,精密称定,定容至100 mL容量瓶中,再从中取1 mL定容至10 mL容量瓶中,并按照上述方法测定吸光度,计算总多糖含量,总多糖的提取率为:
总多糖提取率(%)=Y / m
式中:m —称取冻干粉质量, g;
Y —总多糖的量。
2.3 细胞培养
在37 ℃ 水浴条件下将冻存细胞融化。消毒处理后,取出细胞转移至离心管中,然后以1 000 r/min转速离心3 min。离心结束后弃去上清冻存液,并向各离心管中加入含有10 % 胎牛血清的1640培养基1 mL,混匀成细胞悬液,转移至培养瓶后加入3~4 mL 1640培养基,结束后将其置于条件为37 ℃、含有5 % CO2及适度濕度的培养箱中培养[5,6]。
待细胞成长至80% ~90% 时对培养中5种不同细胞株进行细胞传代,使用PBS缓冲溶液反复清洗3~4次后加入胰蛋白酶溶液进行消化,待培养瓶中细胞消化至细胞蜷缩不再贴付瓶壁时加入RPMI-1640培养基并反复吹打至其成单细胞悬液,再分装至培养瓶中。放置于培养箱中继续培养。
2.4 LPEHPA溶液配制
精密稱取LPEHPA10.00 mg,溶于5 mL 不含胎牛血清的RPMI-1640培养基中配成含水提液冻干粉2 mg·mL-1的初始浓度,消毒后带入超净台中,于超净台中透过0.22 μm的滤膜进行过滤,然后依次加入不同量1640培养基进行稀释,配成2、1.8、1.6、1.4、1.2、1、0.5 mg·mL-1的药物浓度。
2.5 体外抗肿瘤实验方法
将处于对数生长期的4种不同肿瘤细胞株消化后加入含有10 % 胎牛血清的RPMI-1640培养基并稀释成浓度为1×106个·mL-1的细胞悬液,经过反复轻轻吹打混匀后将其接种于96孔板中,每孔中加入100 μL,接入后放入培养箱中培养。待细胞生长至80 %~90 % 后,弃去培养基并按上述药物配置方式将不同浓度LPEHPA稀释液注于各孔,每孔加入药物100 μL,每个药物浓度设置5个复孔,设置仅加入不含胎牛血清的RPMI-1640培养基作为体外抗肿瘤实验的空白组。放入培养箱中培养24 h后,于各孔中加入5 mg·mL-1 MTT溶液20 μL,置于培养箱中避光反应4 h。最后弃去上清液,各孔均加入100 μL DMSO,在酶标仪490 nm波长条件下测定各孔OD值,按下述数据处理方式计算药物对细胞的抑制率,通过对比LPEHPA对不同肿瘤细胞抑制效果对LPEHPA进行抗肿瘤实验测试。
2.6 体外抗氧化实验
2.6.1 细胞铺板
将处于对数生长期的非洲绿猴肾Vero细胞株经过胰蛋白酶消化后稀释成密度约4.5×104/(个·mL-1)的细胞悬液,然后通过反复吹打混匀后导入96孔培养板中进行培养。
2.6.2 加药
设置细胞空白对照,模型组只加过氧化氢,给药组加药干预后加入过氧化氢。
2.6.3 过氧化氢的配置
取33 mL过氧化氢加入到5 mL PBS缓冲溶液中,配至浓度6 400 μmol·L-1,再通过培养基稀释10倍,通过二倍化稀释作为造模条件进行最大浓度摸索。
2.6.4 造模
加药24 h后,将药液吸出,用PBS冲洗两次,每孔加入100 μL过氧化氢,继续培养4 h,正式实验前,筛选最佳造模条件。筛选时,加药过程使用培养基代替,24 h后,去掉培养基,每孔加入不同浓度过氧化氢,通常采用80 μmol·L-1为实验浓度,4 h造模。
2.6.5 加入MTT
造模结束后,加入20 μL的5 mg·mL-1的MTT,静置4 h 后,吸出MTT,加入DMSO并于490 nm波长下进行检测[7,8]。
2.7 体外抗炎实验
2.7.1 细胞培养
将冻存的RAW264.7细胞复苏, 用DMEM高糖培养基 (含10 %胎牛血清、1 %双抗) , 在37 ℃、5% CO2培养箱中培养, 细胞10~15×104(个·mL-1), 铺于24孔板中,每孔1 mL,药物每个浓度设置3个复孔,ELISA法检测其中TNF-α、IL-6的含量[9]。
2.7.2 加药及脂多糖诱导炎症
铺板后24 h后,吸出培养液,加入2 μg·mL-1脂多糖500 μL,并加入对应药物500 μL,其中药物配制浓度及脂多糖浓度始终为方案浓度两倍,加药时两者相互稀释。
2.7.3 TNF-α、IL-6含量测定
酶联免疫法测定上清液中TNF-α、IL-6的浓度,取上述上清液按ELISA试剂盒说明书进行操作,450 nm测其吸光度,并取标准液进行标准曲线的绘制。
2.8 数据分析
数据采用spss17.0软件进行统计分析,计量资料采用单因素方差分析,P<0.05为差异有统计学意义。
3 数据处理
![]()
![]()
4 结果与分析
4.1 LPEHPA总多糖测定
根据2.2方法测定,LPEHPA总多糖含量为4.72 %。
4.2 LPEHPA体外抗肿瘤测试
4.2.1 LPEHPA体外抗肝癌Bel-7402细胞株结果
由图1可知,随给药浓度的增加,当LPEHPA浓度低于1 mg·mL-1时,其水提物对肝癌Bel-7402细胞株并无增殖抑制效果。当LPEHPA应用浓度高于1 mg·mL-1时,与空白组相比产生增殖抑制效果(P<0.01),最高增殖抑制率于1.6 mg·mL-1时达到65.02 %。
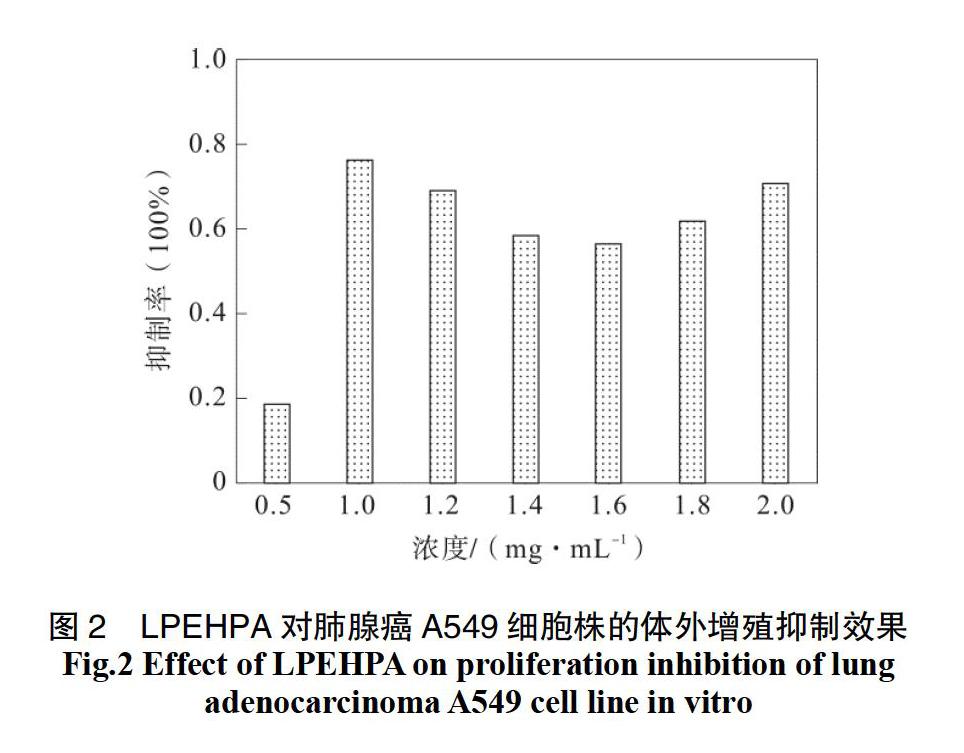
4.2.2 LPEHPA体外抗肺腺癌A549细胞株结果
由图2可知,随给药浓度的增加,LPEHPA于0.5~2 mg·mL-1实验浓度范围内与空白组相比对肺腺癌A549细胞株均具有一定增殖抑制效果(P<0.01),其使用浓度于1 mg·mL-1浓度以下增值效果较弱,当水提物使用浓度高于1 mg·mL-1时,LPEHPA对肺腺癌A549细胞株的增殖抑制效果明显提升,于1 mg·mL-1浓度下抑制率达到最高,为76.05 %。
4.2.3 LPEHPA体外抗乳腺癌M231细胞株实验结果
由图3可知,随给药浓度的增加,于0.5~1.8 mg·mL-1实验浓度范围内,LPEHPA对乳腺癌M231细胞株与空白组相比均具有增殖抑制效果(P<0.01),总体抑制率在实验浓度范围内呈现先增高后降低的趋势,于1.4 mg·mL-1时LPEHPA对乳腺癌M231细胞株的增殖抑制率达到最高,增殖抑制率为62.92 %。
4.2.4 LPEHPA体外抗乳腺癌MCF-7细胞株结果
由图4可知,随给药浓度的增加,在0.5~2 mg·mL-1 实验浓度范围内,LPEHPA对乳腺癌MCF-7细胞株与空白组相比均具有一定的增殖抑制效果(P<0.01),与乳腺癌M231增殖抑制趋势几乎一致,均呈现先升高后降低的趋势,于1.2 mg·mL-1时体外增殖抑制率达到最高,为65.10 %。
4.3 LPEHPA体外抗氧化实验结果
由图5可知,随给药浓度的增加,在0.062 5~1 mg·mL-1浓度范围内,LPEHPA呈现出优良的抗氧化活性,整体呈线性趋势,具有量效依赖关系。与H2O2对照组相比Vero细胞经过0.062 5、0.125、0.25、0.5 mg·mL-1LPEHPA处理后,细胞存活率分别提升至50.72%、54.73%、58.63%、63.76%及82.68%(P<0.01)。同时,通过细胞毒实验筛选,在实验浓度范围内,LPEHPA对Vero细胞无毒。
4.4 LPEHPA体外抗炎实验结果
由图6可知,随给药浓度的增加,在0.125~2 mg·mL-1浓度范围内,LPEHPA分泌IL-6明显少于LPS组。由图7可知,随给药浓度的增加,在0.125~2 mg·mL-1浓度范围内,LPEHPA呈现出优良的抗炎能力,整体呈线性趋势,具有量效依赖关系。与空白对照组相比细胞经过各浓度药物处理后,肿瘤坏死因子分泌量下降(P<0.05),同时,通过细胞毒实验筛选,在药物浓度小于2 mg·mL-1,LPEHPA对RAW264.7细胞无毒。
5 讨 论
本实验是在前期筛选出美洲大蠊最佳水提取总蛋白及总糖胺聚糖工艺的前提下,探究LPEHPA对4种不同肿瘤细胞的体外抗肿瘤细胞株活性及其作用于非洲绿猴肾Vero细胞株的体外抗氧化活性。实验数据表明LPEHPA对4种不同肿瘤细胞均具有优良的抗肿瘤活性,仅从最高肿瘤增殖抑制效果进行比较,笔者认为LPEHPA对肺腺癌A549细胞株的增殖抑制效果最佳,其次为乳腺癌MCF-7细胞株,再次为肝癌Bel-7402细胞株,最后为乳腺癌M231细胞株。其中,药物对肺腺癌A549细胞株的体外抗肿瘤疗效最显著,最高抑制率可达到76.05%;药物对两种不同乳腺癌细胞在实验浓度范围内增殖抑制效果几乎一致,最高增殖抑制效果接近,此实验结果为后期进一步研究美洲大蠊抗肿瘤活性提供了基础;实验结果显示,LPEHPA在较低浓度时对肝癌Bel-7402细胞株无效,而当其使用浓度高于1 mg·mL-1 时具有增殖抑制效果。实验通过对Vero细胞进行体外抗氧化活性研究,显示LPEHPA具有优良的抗氧化活性,与总多糖的浓度呈正相关关系,提示多糖可能为其主要的抗氧化成分。肿瘤坏死因子 TNF-α和IL-6均由活化的巨噬细胞产生, 两者均可引发机体炎症、发热、关节炎等多种疾病,实验结果证明LPEHPA可降低TNF-α、IL-6含量,这为今后进一步研究美洲大蠊的抗炎作用提供了依据。
参考文献:
[1]高洁,沈咏梅,岳碧松.美洲大蠊药理作用及其临床疗效的研究进展[J].中药药理与临床,2018,34(04):203-208.
[2]李佳懌,米士丽,张瑞,等.美洲大蠊中蛋白质和糖胺聚糖双指标的提取工艺研究[J].山东化工,2019,48(07):12-15.
[3]肖培云,杨永寿,李龙星,等.美洲大蠊药材中总糖含量的测定研究[J].时珍国医国药,2011,22(09):2077-2079.
[4] 刘廷丹,杨秀娟,邓君明,等.苯酚-硫酸法测定蛤蚧酒中多糖含量[J].食品工业,2018,39(08):298-301.
[5]王彦多,桑晓,方园,等.复合酶酶解蜈蚣粉工艺优化[J].食品与药品,2018,20(05):367-370.
[6]王奎, 冯颖, 何钊, 等. 美洲大蠊中两个有抑菌活性的单甘酯的研究[J]. 时珍国医国药, 2013, 24(09): 2102-2103.
[7] 王秋举,鞠雪,王清滨,等.L-肉碱对vero细胞抗H_2O_2氧化应激的影响[J].中国畜牧杂志,2014,50(13):42-47.
[8]熊丽丹,唐洁,李利.白果内酯和银杏内酯B对过氧化氢诱导人角质形成细胞氧化损伤的保护作用[J].日用化学工业,2019,49(08):531-536.
[9]黄艳君,王晓,姜健慧,等.脂氧素A4对脂多糖诱导的人滋养细胞炎症细胞因子的影响[J].中华医院感染学杂志,2016,26(23):5395-5397.

