三氯卡班对蚯蚓的氧化胁迫及DNA损伤
李倩倩,李光德,*,闫晓彤,刘斌,李紫薇
1. 山东农业大学资源与环境学院,泰安 271018 2. 山东省高校农业环境重点实验室,泰安 271018
三氯卡班(triclocarban, TCC)是个人护理产品中主要有机成分之一[1],由于其杀菌(细菌和真菌)、无毒、无刺激性、皮肤接触无过敏反应,且与皮肤有良好的相容性等特性被广泛用于厨房洗涤剂、化妆品和儿童玩具等消费产品中[2-3],且经常在自然环境、野生生物和人体组织中被检出[4]。在中国辽河、海河、黄河、长江和珠江等的表层水和沉积物中,TCC的检出率为100%,最高浓度达2 723 ng·L-1[5]。在污水处理厂产生的污泥中,TCC含量高达10.0~70.0 mg·kg-1,有95%的污泥被用作耕地的土壤有机质补给,污泥农用将导致TCC进一步进入土壤中,加剧土壤环境污染[6]。陈凤[7]在广州省、河北省污泥农用土壤中均检测到TCC的存在,并根据生态风险评价得出TCC对陆生生物具有高风险。Yin等[8]已在人类尿液和指甲中检测到TCC的存在,且浓度高达84.66 μg·kg-1和41.05 μg·kg-1,这表明中国人群身体组织中已有TCC的积累。
TCC的物化性质稳定,在环境中较难降解,很容易在土壤、污水处理厂污泥和沉积物等环境介质中富集,是一种潜在的持久性有机污染物(persistent organic pollutants, POPs)。Halden和Paull等[9]发现TCC在沉积物、土壤、水和大气中的半衰期分别为540、120、60和0.75 d。汪贞等[10]通过应用物种敏感性分布方法对我国地表水中TCC进行生态风险评估,得出TCC高风险比例为28.6%,中风险比例高达47.6%,TCC对我国淡水环境的影响应当引起环境管理部门的重视。随着TCC使用量的急剧增加,其对自然环境的污染水平、对生物体的毒性效应和对生态系统造成的潜在影响不容忽视。
多项研究表明,TCC能对人和动植物引起各种不良反应,可通过抗氧化剂生物标志物包括过氧化氢酶(CAT)、谷胱甘肽S-转移酶(GST)和过氧化脂质(LPO)进行监测。由于接触含TCC成分的消费产品的时间更长,女性会更易受TCC的影响[11]。大量研究证明,TCC对动植物和人体的生长发育存在抑制效应,干扰其内分泌以及遗传等。Kajta等[12]将神经元细胞暴露于TCC中24 h后发现,TCC会抑制ESR1和GPER1的mRNA和蛋白质表达,通过基因的甲基化破坏雌激素受体的信号传导。Dong等[13]研究发现,133.3 mg·L-1水平的TCC可使斑马鱼心率降低,抑制膀胱发育,还会抑制其甲状腺激素,并改变甲状腺激素反应基因的表达。杨峰等[14]发现3.57 μmoL·L-1的TCC可抑制肾小管上皮细胞间紧密连接蛋白JAM-1的表达,从而影响肾脏的屏障功能。施金彤等[15]的研究证明,TCC能诱导正常的小鼠乳腺上皮细胞发生癌变;李林朋等[16]通过彗星实验发现,TCC能引起人体肝脏细胞的DNA损伤,且呈现出明显的“剂量-效应”关系。
目前,国际上对TCC的研究主要集中于TCC对水生生物、土壤微生物以及哺乳动物的生态毒性效应及其在环境中的降解、转移等,而TCC对土壤动物蚯蚓的毒性效应研究报道甚少。蚯蚓对土壤污染物质的反应可作为评价土壤污染和土壤质量的指标[17],是土壤污染预警和诊断的一种工具[18-19]。赤子爱胜蚓(Eiseniafoetida)是国际上常用于蚯蚓毒性试验的品种,因此,本文以赤子爱胜蚓为研究对象,使其暴露于不同TCC含量染毒的人工土壤中[20],从细胞水平上研究TCC对蚯蚓抗氧化酶系包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、CAT和GST活性,活性氧(ROS)和丙二醛(MDA)含量的影响,以及对细胞DNA的损伤程度,用以探究TCC的生态毒理学性质,这对评估TCC对环境的影响尤为重要。
1 材料与方法(Materials and methods)
1.1 试验材料
药品试剂:三氯卡班标准品(纯度>99.5%)、L-甲硫氨酸、愈创木酚和琼脂糖购自美国Sigma-Aldrich公司;考马斯亮蓝购自北京瑞泰科技有限公司;核黄素和丙三醇(分析纯)购自天津市凯通化学试剂有限公司;牛血清白蛋白和十二烷基氨酸钠(分析纯)购自上海伯奥生物技术有限公司。
供试生物:赤子爱胜蚓购于日照老兵蚯蚓养殖场,挑选环带明显、大小(体质量300~600 mg)一致的健康成蚓,试验前在配制的人工土壤中驯化一周。
供试土壤:按照经济合作与发展组织(OECD)推荐的标准配制人工土:10%的干燥泥炭藓(pH值5.5~6.0);20%的高岭粘土(约含高岭石成分50%);69%的工业石英砂(约含50%的50~200目细颗粒);1%碳酸钙(调节人工土pH值到6.0±0.5)。
1.2 试验设计
试验TCC染毒设定浓度为0(以丙酮作空白对照)、5、10、20和40 mg·kg-1。染毒试验前,根据试验染毒浓度设置,将TCC溶于丙酮后配制成相应系列浓度的标准工作溶液。按配比称取500 g人工土后放置于l L干燥烧杯中,先取10 g土样与一定量系列浓度标准工作溶液充分混匀,再与490 g土样充分混匀,待丙酮溶剂挥发完全后加适量去离子水,调节水分至土壤干质量的35%左右,明暗时间比为12 h∶12 h。每个浓度处理设3个重复。选取15条符合要求的蚯蚓放入烧杯中,用预先扎孔的保鲜膜封口,将烧杯放置于(20±1) ℃培养箱中,调节光暗。在培养第7、14、21和28天,自烧杯中取出蚯蚓,用生理盐水冲洗干净后放置于放有湿润滤纸的培养皿中,在(20±1) ℃的培养箱中过夜吐泥,取样测定相关指标。
1.3 测试指标及方法
选择SOD、CAT、POD、GST、MDA和ROS作为蚯蚓氧化损伤指标,其中,SOD活性检测采用氮蓝四唑(NBT)光还原法,CAT活性测定采用紫外分光光度计法,POD活性检测采用愈创木酚比色法,MDA含量检测采用硫代巴比妥酸法,GST活性检测采用1-氯-2,4-二硝基苯(CDNB)比色法[21-22]。ROS含量测定采用二氯荧光素(DCFH-DA)荧光法测定[23]。
TCC对蚯蚓体腔细胞DNA损伤的测定采用彗星实验(Comet Assay),又称单细胞凝胶电泳实验(SCGE)。根据Singh等[24]和Song等[25]的研究方法,结合实验情况做适当的调整。溴化乙锭染色后,采用荧光倒置显微镜观察玻片、拍照、存取结果,用CASP软件分析蚯蚓体腔细胞DNA的彗星图片,测定Olive尾矩。
1.4 数据处理
使用Excel 2016对全部数据进行统计分析。通过SPSS 19.0进行单因素方差分析(ANOVA),检测分析不同处理组与空白组之间的差异显著性。显著性差异水平设定为P<0.05。结果以平均值±标准差(mean±SD,n=3)的形式表示。
2 结果(Results)
2.1 TCC对蚯蚓的氧化胁迫效应
2.1.1 TCC对SOD活性的影响
由图1可知,在整个实验周期内,在TCC胁迫作用下,蚯蚓体内的SOD活性大致呈现先激活后被抑制的情况。染毒处理7 d时,SOD活性较空白组变化不大;14 d后,浓度低于20 mg·kg-1的处理组SOD活性均高于空白组,且存在显著性差异(P<0.05),高浓度处理组活性虽高于空白组,但与空白组差异性不显著;处理21 d时,除40 mg·kg-1处理组的SOD活性小于空白组的,其余浓度处理组SOD活性均高于空白组,且与对照组相比有显著差异(P<0.05),但各处理组之间差异性不大;染毒处理28 d时,相比于空白组,各浓度处理组的SOD活性明显受到抑制,且随TCC浓度的升高呈下降趋势。

图1 三氯卡班(TCC)对蚯蚓体内超氧化物歧化酶(SOD)活性的影响注:每组中不同的小写字母表示处理间差异达到显著水平(P<0.05);下同。Fig. 1 Effects of triclocarban (TCC) on activities of superoxide dismutase (SOD) in earthwormsNote: Different small letters meant significant difference among treatments at P<0.05; the same as below.
2.1.2 TCC对CAT活性的影响
由图2可知,在整个实验周期内,高浓度处理组(40 mg·kg-1)CAT活性始终被抑制,其余处理组活性则被激发。在TCC染毒处理7 d时,CAT活性(除40 mg·kg-1处理组)较空白组略有增长,但激活程度不显著;染毒14 d后,各处理组CAT活性被激发;21 d时,各处理组的CAT活性均激活到最高程度,并在10 mg·kg-1处理组活性值达到最大,与空白组相比增加了31.17%,激发效果显著(P<0.05)。第28天时,20 mg·kg-1处理组CAT活性仍高于空白组,但激活程度明显低于5 mg·kg-1和10 mg·kg-1处理组。

图2 TCC对蚯蚓体内过氧化氢酶(CAT)活性的影响Fig. 2 Effects of TCC on activities of catalase (CAT) in earthworms
2.1.3 TCC对POD活性的影响
由图3可知,随着TCC染毒浓度的增加和染毒时间的延长,蚯蚓POD活性也呈现先增加后降低的趋势。在染毒第7~14天,各处理的POD活性均被不同程度地激发,且与空白组相比,差异性显著(P<0.05)。染毒21 d后,5 mg·kg-1和10 mg·kg-1处理组的POD活性被显著激活,但2个不同浓度处理组之间差异性不明显,高浓度处理组(40 mg·kg-1)的POD活性则被抑制。染毒至28 d时,各浓度处理组的POD活性随暴露浓度的增加,抑制作用明显增强。

图3 TCC对蚯蚓体内过氧化物酶(POD)活性的影响Fig. 3 Effects of TCC on activities of peroxidase (POD) in earthworms
2.1.4 TCC对蚯蚓GST活性的影响
由图4可知,GST的活性在染毒初期受到轻微抑制,后逐渐被激活升高,在染毒第14天时达到最高值,最终在染毒28 d时被抑制。在染毒7 d后,各浓度处理组GST活性受到抑制,40 mg·kg-1处理组活性较空白组降低20.1%。染毒14 d时,蚯蚓受TCC刺激变明显,使各处理组的GST活性迅速增加,且在40 mg·kg-1组GST活性达到最高。21 d时,染毒组GST活性虽高于空白组,但较染毒14 d时的GST活性降低。在染毒28 d后,GST活性受抑制,但各浓度处理组间无显著性差异。

图4 TCC对蚯蚓体内谷胱甘肽S-转移酶(GST)活性的影响Fig. 4 Effects of TCC on activities of glutathione transferase (GST) in earthworms
2.1.5 TCC对蚯蚓体内MDA含量的影响
由图5可知,在整个染毒周期内,除个别处理组外,经TCC处理的样品中MDA含量始终高于空白组,且与空白组之间存在显著性差异(P<0.05)。染毒第7天时,各处理组MDA含量开始增加,且在20 mg·kg-1时达到最大值。染毒第14~21天时,除14 d的40 mg·kg-1处理组外,随着暴露浓度的升高,各处理组的MDA含量也随之升高。第28天时,蚯蚓体内MDA含量的增长趋势有所减缓。

图5 TCC对蚯蚓体内丙二醛(MDA)含量的影响Fig. 5 Effects of TCC on contents of malondialdehyde (MDA) in earthworms
2.1.6 TCC对蚯蚓体内ROS含量的影响
由图6可知,不同浓度的TCC均可诱导蚯蚓体内ROS的含量上升,且随着染毒时间的增加,蚯蚓体内ROS含量呈先升高后缓慢降低至空白的趋势。染毒第7天时,5 mg·kg-1处理组ROS含量低于空白组,其余处理组ROS含量则随染毒浓度的增加而增加。第14天时,各处理组ROS含量均显著高于空白组,并在20 mg·kg-1处理组达到最大值,比空白组增加了80.43%;21 d时,各处理组蚯蚓体内ROS依旧呈现高于空白组的状态,但与空白组的差距逐渐变小,且低于14 d时蚯体内ROS的含量;第28天时,各处理组ROS含量略有降低,并接近于空白组。

图6 TCC对蚯蚓活性氧(ROS)含量的影响Fig. 6 Effect of TCC on content of reactive oxygen species (ROS) in earthworms
2.2 TCC对蚯蚓体腔细胞DNA的损伤
不同浓度TCC胁迫对蚯蚓体腔细胞造成的损伤如图2~图7所示。由图7可知,空白组的蚯蚓体腔细胞细胞核头部呈致密的圆形,边缘清晰,无拖尾或尾部极短。经TCC染毒后,染毒组的细胞核结构受到损伤,DNA头部逐渐变小、变松散,在外加电场下,断裂的DNA渐渐地离开细胞核向阳极迁移,呈扫帚状,形成类似彗星拖尾的图案,核DNA的断裂程度和彗星拖尾的长度随染毒浓度的增大而加长。

图7 暴露于TCC的蚯蚓体腔细胞彗星实验图像Fig. 7 Typical comet image of earthworms coelomocyte exposed to TCC
用CASP软件分析彗星图像,得到TCC对蚯蚓体腔细胞的Olive尾矩的影响,如图8所示,Olive尾矩反映蚯蚓体腔细胞DNA的迁移。5~40 mg·kg-1的TCC均可对蚯蚓体腔细胞DNA造成损伤,且Olive尾矩随染毒浓度和时间的增加而增加,与空白组相比差异性显著。第28天时,20 mg·kg-1和40 mg·kg-1处理组的彗星Olive尾矩较21 d时增长幅度减缓,可能是因为蚯蚓在应对外界TCC毒性时,经过一段时间的应激反应后慢慢进行自我修复。

图8 TCC对蚯蚓体腔细胞DNA损伤Olive尾距(OTM)的影响Fig. 8 Effect of TCC on DNA damage Olive tail moment (OTM) in earthworm coelomocyte cells
3 讨论(Discussion)

3.1 TCC对蚯蚓抗氧化酶系和GST活性的影响
CAT是生物防御体系的关键抗氧化酶之一,广泛存在于细胞的过氧化物内。它可清除体内的H2O2,促使其分解为分子氧和水,使机体免受来自H2O2的损害。40 mg·kg-1处理组CAT活性在整个实验周期内始终被抑制,说明高浓度TCC对蚯蚓造成的氧化胁迫程度过大,机体细胞膜受到氧化损伤,导致机体中毒,CAT产生机制受损,并且机体持续累积H2O2的速度大于CAT的清除速度,导致H2O2在机体内累积,抑制了CAT的合成,使机体内的CAT含量降低。除个别浓度处理组外,各浓度处理组的CAT活性始终高于空白组,且随着染毒时间的增加,CAT活性呈现先升高后降低的趋势,染毒处理21 d时,20 mg·kg-1浓度组使CAT活性激发至最大。
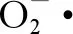
GST是细胞的主要解毒酶,能够催化机体内谷胱甘肽(GSH)与有毒物质结合,使其转化为水溶性化合物随尿液等排出体外,达到解毒目的。染毒7 d时,GST活性受到抑制,可能是由于抗氧化系统应激作用的延迟,TCC胁迫下蚯蚓体内的ROS和H2O2等含量上升,部分GST被消耗,活性降低。高浓度处理组GST活性显著激活,可能是在高浓度作用下,机体中其他抗氧化酶系发挥的作用低于中低浓度组,需刺激GST活性来维持机体的平衡。染毒第28天,GST活性被抑制,浓度越高,受抑制程度越大,表明长时间及高浓度胁迫下,机体内活性氧等有毒物质的产生速率大于其清除速率,累积的有毒物质对蚯蚓产生影响,阻碍了GST酶蛋白的合成,降低了GSH与有毒物质的合成,导致GST的解毒能力下降。
3.2 TCC对蚯蚓MDA和ROS含量的影响
MDA是细胞膜中自由基与不饱和脂肪酸氧化反应的主要产物[32],其含量的多少可直接反映机体脂质过氧化的程度,间接反映自由基对机体的损伤程度[21]。含量越高,表明机体受损伤程度越大[33]。染毒初期,受TCC刺激产生且未被抗氧化酶系及时清除的活性氧自由基与细胞膜发生过氧化反应,脂质过氧化作用增强,导致MDA含量升高。实验后期,除个别浓度组外,蚯蚓体内MDA含量随着时间和TCC浓度的增加而增加,说明在TCC胁迫下蚯蚓机体产生的ROS含量增加,过量的ROS反过来抑制抗氧化防御系统的活性,抗氧化酶系无力应对过量的自由基,从而引起细胞的脂质过氧化作用增强,使MDA的含量增加。
ROS是机体正常代谢的产物。环境中的多数外源污染物都能影响机体内氧化还原系统的平衡,促使机体产生大量的ROS,引起膜脂过氧化作用,导致一系列有害的生理生化变化[25]。ROS在调节细胞分化及死亡过程中起到至关重要的作用[34]。在本实验整个染毒周期内,各处理组ROS含量始终高于空白组,且在14 d时差异性较为显著,表明TCC对蚯蚓机体造成了明显的损伤。Shao等[35]的实验中同样发现离子液体会导致蚯蚓体内ROS含量上升。说明TCC胁迫会导致蚯蚓体内ROS含量增加,打破机体ROS产生和消除的动态平衡,进而直接或间接破坏蚯蚓抗氧化防御系统。21 d后,各处理组ROS含量仍高于空白组,但各浓度处理组ROS相比14 d时呈现出下降的趋势,说明蚯蚓机体具有一定自我修复的能力,且本试验中染毒物质的浓度并未对蚯蚓机体造成不可逆的损害。但在整个实验周期内,染毒浓度对蚯蚓体内ROS含量的影响并无明显规律。
3.3 TCC对蚯蚓DNA损伤的影响
实验设置浓度均可对蚯蚓体腔细胞DNA造成损伤,且低浓度时即可对体腔细胞产生基因毒性效应,说明蚯蚓对TCC有较高的敏感性。随着染毒浓度、染毒时间的增加,损伤也随之增加,这说明DNA损伤程度与TCC的剂量呈正相关。环境中TCC浓度的增加,破坏了细胞的膜结构,导致进入蚯蚓体内的TCC含量增加,大量的TCC对蚯蚓的氧化胁迫作用加强,抑制了蚯蚓机体的解毒能力及自我修复能力,加剧细胞DNA的损伤。染毒第28天,各处理组蚯蚓Olive尾距(OTM)值的增长幅度减缓,与21 d时差距不大,机体ROS含量回落接近于空白水平,表明蚯蚓机体开始自我修复,削弱了TCC对蚯蚓细胞的损伤程度。损伤较轻的细胞通过DNA自我修复机制将损伤逐渐降低,直至恢复至正常水平[36]。
综上所述,TCC能对蚯蚓机体产生一定程度氧化胁迫,刺激蚯蚓机体产生大量的ROS,从而激活体内的抗氧化酶和解毒酶来消除过量的ROS,维持正常的氧化还原应激反应。过量的ROS还会造成细胞膜脂质过氧化,产生过氧化产物MDA,对细胞DNA造成损伤,导致细胞凋亡。本研究证实了TCC能够对蚯蚓机体产生氧化胁迫及DNA损伤,但研究内容有限,还需更深入探究。

