转录组测序解析刺参波里氏囊腔与体腔中体腔细胞对吐脏胁迫的响应差异
史伟卜,王轶南,王浩文,任媛,王庆奎,李强*
(1.盐城工学院 海洋与生物工程学院,江苏 盐城 224051;2.天津农学院 水产学院,天津 300384;3.大连海洋大学 水产与生命学院,辽宁 大连 116023)
1 引言
刺参(Apostichopus japonicus)隶属棘皮动物门海参纲,处于从无脊椎向脊椎动物分化的独特进化阶段,也是国内外重要的海产经济物种[1]。刺参具有独特的水管系统,该系统是一个由体腔产生的充满液体的复杂管道网络,包括石管、环状水管与辐水管等构造。石管嵌在背悬肠膜内,其末端为筛板,生在体腔内,因而水管内的液体来自于体腔液。波里氏囊作为刺参水管系统的附属物悬挂于体腔中,具有调节水管系统内压力的作用,通过调节水管系统内的体腔液流进或流出管足而支配其运动[2]。此外,近年来研究还发现,刺参波里氏囊可以生成体腔细胞,是刺参的“造血组织”之一[3]。
刺参的体腔细胞大量存在于体腔内,同时还随着水管系统的延伸遍布于刺参的体壁、管足,广泛参与着机体的营养输送、代谢以及免疫等多种机能[2]。目前,刺参体腔细胞的相关研究多集中于体腔内游离的体腔细胞,对组织器官及水管系统内的体腔细胞了解较少。初步研究显示[4],刺参体腔中体腔细胞密度约为波里氏囊腔内体腔细胞密度的2 倍;波里氏囊腔内体腔细胞与体腔中体腔细胞种类相似,但亚型组成存在差异,囊腔内以带伪足的球形细胞为主,淋巴细胞次之;体腔内则以淋巴细胞为主,带伪足的球形细胞次之。波里氏囊腔内体腔细胞与体腔中体腔细胞组成上的差异,提示其可能具有特殊的功能[5]。
刺参具有吐脏与再生的特殊机制,当刺参遇到强烈的刺激或因水质过于混浊、温度变化过大等不良环境时,刺参会将消化道、呼吸树、性腺等内脏器官排出体外,当环境条件适宜时,又可再生出功能完善的内脏器官,属于一种自我保护措施[6]。目前,有关刺参吐脏后再生的研究多集中于肠道的再生过程。已有研究表明[7−8],刺参吐脏时,肠道与胃部、肛门以及肠系膜的连接部位分别出现断裂,从而使得肠道从体腔中脱离下来并经由泄殖孔排出体外。这些断裂的部位形成了新生肠道发生的原基,经过复杂的细胞增殖、转化、去分化、组织增生等过程才逐渐形成完整的消化系统。其中,刺参肠系膜以及肠道外层存在的体腔上皮细胞被认为具有干细胞的功能作用,是消化道组织再生的重要来源,刺参吐脏时,体腔中体腔液和体腔细胞会随内脏一起被排出。已有研究表明[9],刺参体腔液容积在吐脏后2 h 即可恢复至吐脏前水平,体腔细胞数量在吐脏后快速增加,吐脏后6 h 时与吐脏前已无显著差异。波里氏囊在刺参吐脏时不会和其他内脏一起排出体外,为刺参吐脏后仅存的内脏器官,我们先前研究发现,波里氏囊腔内体腔细胞数量也在刺参吐脏后6 h 快速增加(数据尚未公开),表现出积极的响应。
本文应用RNA-Seq 测序技术对刺参吐脏后6 h与吐脏前波里氏囊腔和体腔中体腔细胞进行转录组测序,分别比较波里氏囊腔和体腔中体腔细胞在吐脏胁迫下的基因表达变化,以期深入了解体腔细胞在刺参吐脏后所发挥的生物学作用,进一步阐明刺参波里氏囊腔和体腔中体腔细胞在功能方面的差异,并为解析刺参吐脏与再生这一特殊生存机制提供资料。
2 材料与方法
2.1 实验动物
本实验所用刺参购于山东省青岛市某水产养殖场,体重为(50.2±4.6)g,于盐城工学院水产动物免疫与病害实验室的塑料水槽(70 cm×50 cm×46 cm)中充气暂养,海水温度为17~19℃,盐度为30,每两天投喂和换水1 次,于18:00 进行投喂,次日早上08:00 进行换水,1 周后进行实验。
2.2 样品准备
将健康刺参随机分为对照组和吐脏组,每组设置3 个平行,每个平行组放养3 头刺参,每头刺参注射1.2 mL 0.35 mol/L 的氯化钾诱导吐脏,待吐脏后6 h 取样,对照组不做处理。使用无菌手术剪沿泄殖腔一端剪开刺参腹部,将体腔中体腔液收集至一次性无菌培养皿中,另用1 mL 无菌注射器抽取波里氏囊腔内体腔液,每3 头刺参样品混合作为1 个平行,每组3 个平行。各组分别标记如下:波里氏囊腔内体腔细胞对照组(PC0 h)、波里氏囊腔内体腔细胞吐脏组(PC6 h)、体腔中体腔细胞对照组(CC0 h)和体腔中体腔细胞吐脏组(CC6 h)。各组取2.5 mL 体腔液样品经4℃,3 000 r/min 离心10 min,弃上清,细胞沉淀立即置于液氮中速冻,放入-80℃冰箱保存备用。
2.3 RNA 提取及质量检测
按照常规的Trizol 法提取上述制备的体腔细胞样品总RNA。用1%琼脂糖凝胶电泳检测RNA 的质量,分析样品RNA 完整性及是否存在DNA 污染,利用NanoDrop 微量分光光度计检测RNA 浓度。
2.4 文库构建及上机测序
RNA-Seq 测序文库构建由北京诺禾致源科技股份有限公司提供技术服务,首先通过Oligo(dT)磁珠富集带有polyA 尾的mRNA,随后将得到的mRNA 随机打断。以片段化的mRNA 为模版,随机寡核苷酸为引物,合成cDNA 第一条链,随后用RNaseH 降解RNA 链,并在DNA polymerase I 体系下,以dNTPs 为原料合成cDNA 第二条链。纯化后的双链cDNA 经过末端修复、加A 尾并连接测序接头,用AMPure XP beads 筛选200 bp 左右的cDNA,进行PCR 扩增并再次使用AMPure XP beads 纯化PCR 产物,最终获得文库。文库构建完成后,分别使用Agilent 2100 和qRTPCR 对其进行检测和定量,检测合格后使用Illumina NovaSeq 6000 进行测序,并产生150 bp 配对末端读数。
2.5 数据质控
测序获得的原始数据中包含少量带有测序接头或测序质量较低的基因片段。为了保证数据分析的质量及可靠性,需要对原始数据进行过滤。从原始数据中去除带接头、含N(N 表示无法确定碱基信息)和低质量(Qphred≤20 的碱基数所占比例超过50%)的基因片段,从而获得过滤后数据。同时,对过滤后数据进行Q20、Q30 和GC 含量计算。后续所有分析均是基于过滤后数据进行的高质量分析。
2.6 测序数据与参考基因组比对
刺参参考基因组和基因模型注释文件从基因组网站下载(ftp://ftp.ncbi.nlm.nih.gov/genomes/all/GCA/002/754/855/GCA_002754855.1_ASM275485v1/GCA_00275 4855.1_ASM275485v1_genomic.fna.gz)。使 用HISAT2 v2.0.5 构建参考基因组的索引,并使用HISAT2 v2.0.5将配对末端过滤后数据与参照基因组比对。
2.7 差异表达基因的筛选和富集分析
使用FPKM(expected number of Fragments Per Kilobase of transcript sequence per Millions base pairs sequenced)法估算样本的基因表达水平。随后用DESeq2软件(版本1.16.1)对两组间的差异表达进行分析。利用Benjamini-Hochberg 方法调整所得p值(padj)以控制错误发现率。padj<0.05 以及|log2(Fold change)|>1作为显著差异表达的阈值。通过clusterProfiler R 软件实现差异表达基因的基因本体(Gene Ontology,GO)和KEGG 富集分析,将padj<0.05 作为显著性富集的阈值。
2.8 qRT-PCR 验证
为了验证RNA 测序结果,针对两组样品各选择5 个差异基因进行qRT-PCR 验证。其中波里氏囊腔中体腔细胞检测金属肽酶含血小板反应蛋白基元-9(A disintegrin and metalloproteinase with thrombospondin motifs 9,ADAMTS9)、基质金属蛋白酶-16(matrix metalloproteinase-16,MMP16)、维甲酸受体-β(retinoic acid receptor beta,RARB)、钠依赖性脯氨酸转运体(sodium-dependent proline transporter,SLC6A7)、磷酸丝氨酸转氨酶-1(phosphoserine aminotransferase-1,PSAT1)等基因,体腔中体腔细胞检测ADAMTS9、MMP16、RARB、SLC6A7、IgG-Fc 片段结合蛋白(IgGFc-binding protein,FCGBP)等基因。利用SYBR®Premix Ex Taq 试剂盒和实时荧光定量PCR 系统进行荧光定量PCR。验证基因的引物通过Primer Premier 5.0 设计,基因引物序列见表1。以β-actin 作为内参基因,各样品每个基因设置3 次重复,用2−△△CT法算出每个基因的相对表达量。
3 结果与分析
3.1 测序结果概述
通过Illumina 测序平台分别对吐脏前后共6 个波里氏囊腔内体腔细胞样品与6 个体腔中体腔细胞样品文库进行测序,测序原始数据已经提交至NCBI(登录号为SRP262929,SRP261739)。波里氏囊腔内体腔细胞样本获得的原始数据区间为48 395 496~58 695 018,去除低质量序列后,共获得308 646 822 个过滤后数据;体腔中体腔细胞样本获得的原始数据区间为41 285 400~60 069 216,去除低质量序列后,共获得271 994 432 个过滤后数据。两组样本与刺参参考基因组的比对率区间分别为66.06%~68.25%和61.10%~64.88%。碱基质量及组成分析显示,各样品的Q20值(%)均不小于94.87%(表2)。
3.2 差异表达分析
将过滤后数据比对到刺参的参考基因组上,PC0 h组和PC6 h 组的比较组合共获得25 049 个差异基因,其中1 254 个基因在PC0 h 组中特异表达,1 538 个基因在PC6 h 组中特异表达,两组共表达基因22 257个。CC0 h 组和CC6 h 组的比较组合共获得25 682 个差异基因,其中1 433 个基因在CC0 h 组中特异表达,2 793 个基因在CC6 h 组中特异表达,两组共表达基因21 456 个。本研究中,将|log2(Fold change)|>1 和padj<0.05 定义为显著差异基因,PC6 h 组和PC0 h 组相比,共筛选出267 个显著差异基因,其中上调基因200个,下调基因67 个。CC6 h 组和CC0 h 组相比,共筛选出922 个显著差异基因,其中上调基因803 个,下调基因119 个(图1)。
3.3 GO 富集分析
对PC6 h 组和PC0 h 组间的267 个显著差异表达基因进行GO 功能富集分析,这些差异表达基因被富集到223 个GO 亚类中,包括110 个生物过程亚类,22 个细胞组分亚类,91 个分子功能亚类,其中分子功能类别中富集最为显著。在分子功能类别中,分子功能调节、肽酶抑制活性、肽酶调节活性、酶抑制活性、酶调节活性中的差异表达基因较多。
表1 用qRT-PCR 验证所用引物序列Table 1 The sequence of primers used for qRT-PCR validation
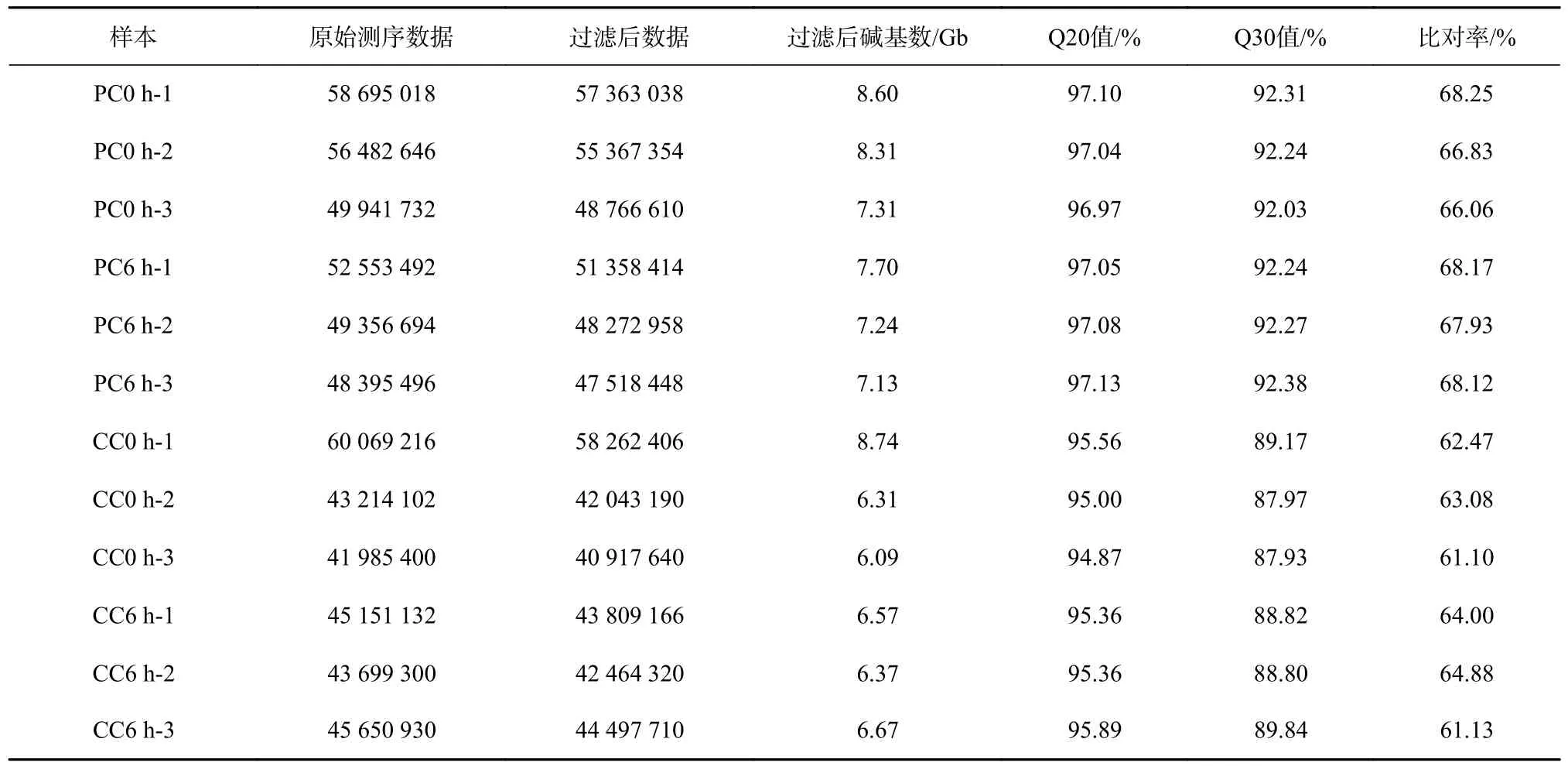
表2 12 个文库的基本信息Table 2 The basic characteristic of reads in the 12 libraries
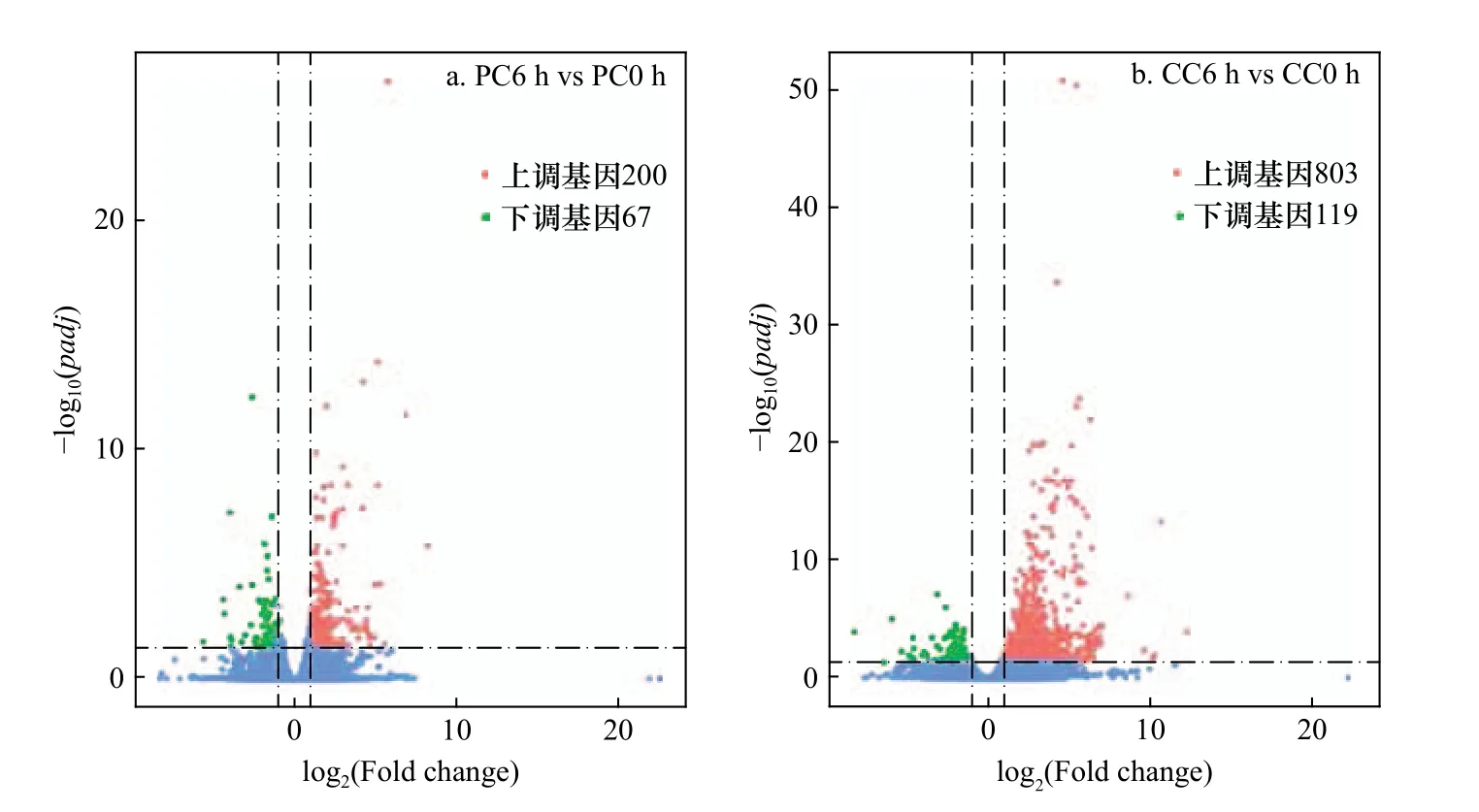
图1 PC6 h 组与PC0 h 组(a)及CC6 h 组与CC0 h 组(b)的显著差异基因分布火山图Fig.1 Volcano plot significantly differential expression genes distribution between PC6 h and PC0 h (a) and between CC6 h and CC0 h (b)
对CC6 h 组和CC0 h 组间的922 个显著差异表达基因进行GO 富集分析,这些差异表达基因被富集到385 个GO 亚类中,其中生物过程亚类202 个,细胞组分亚类27 个,分子功能亚类156 个。生物过程类别中,蛋白质水解、G 蛋白偶联受体信号通路、单一生物转运、神经递质转运、细胞黏附、生物黏附中的差异表达基因较多。细胞组分类别中,细胞外区、细胞外基质中的差异表达基因较多。分子功能类别中,分子功能调节、肽链内切酶活性、肽链内切酶抑制活性、肽链内切酶调节活性、肽酶调节活性、肽酶抑制活性、酶调节活性、酶抑制活性中的差异表达基因较多。图2 列出了生物过程、细胞组分和分子功能3 个类别中差异基因显著富集的前30 个亚类。
3.4 KEGG 富集分析
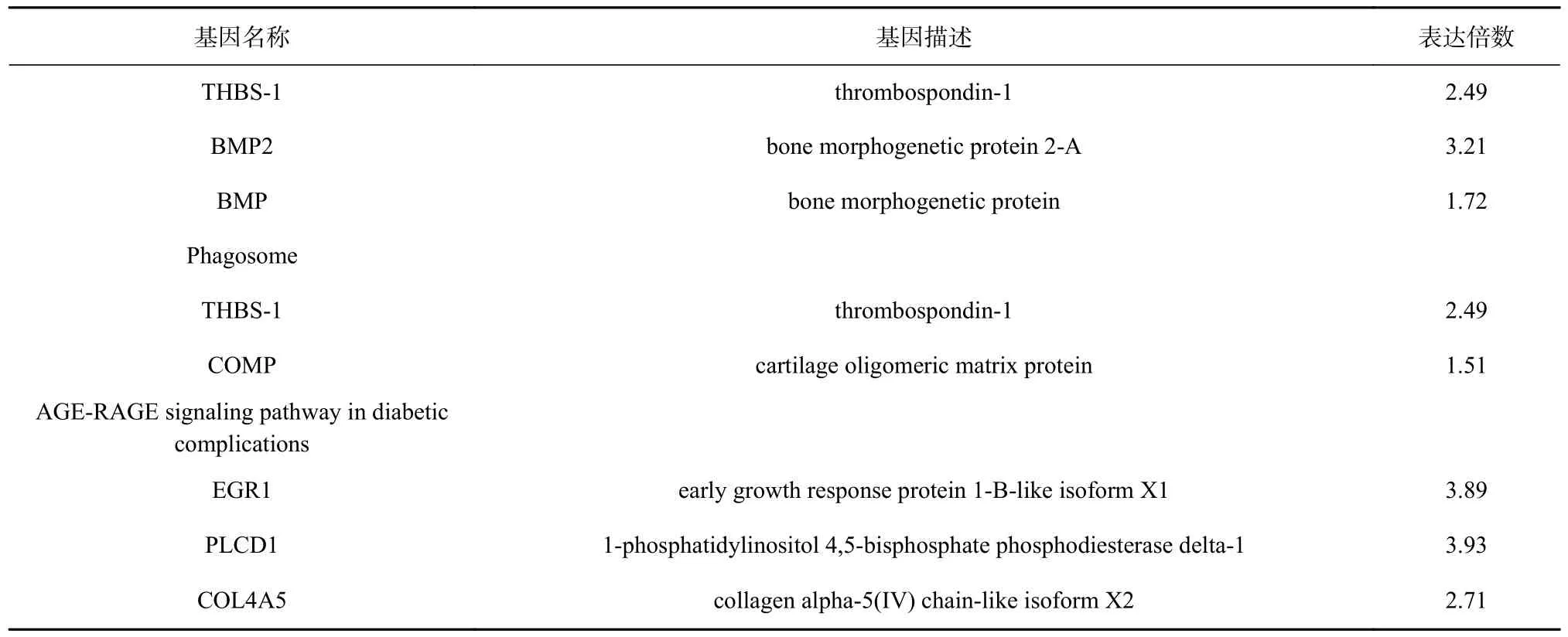
通过KEGG 富集分析结果显示,PC6 h 组和PC0 h组间显著差异基因共富集到15 条通路上,如甘氨酸、丝氨酸和苏氨酸代谢、氨基酸生物合成、FoxO 信号通路、吞噬体等,其中显著富集的通路是甘氨酸、丝氨酸和苏氨酸代谢通路(图3a);CC6 h 组和CC0 h 组间显著差异基因共富集到35 条通路上,其中显著富集的通路包括细胞外基质受体互作通路、转化生长因子-β 信号通路、FoxO 信号通路、吞噬体、AGERAGE 信号通路(图3b)。表3 列出了显著富集通路中的差异表达基因。
3.5 qRT-PCR 验证
qRT-PCR 结果显示,刺参吐脏后,波里氏囊腔中体腔细胞的ADAMTS9、MMP16、RARB、SLC6A7、PSAT1 等基因及体腔中体腔细胞的ADAMTS9、MMP16、RARB、SLC6A7、FCGBP 等基因的表达量高于对照,基因表达量的差异倍数与转录组测序结果大致相同。结果表明,qRT-PCR 结果和转录组测序结果一致,证明了RNA-Seq 结果的可靠性(图4)。
4 讨论
刺参吐脏后,体腔中体腔细胞近乎排尽,随后迅速恢复,有研究表明[9],体腔中体腔细胞数量在吐脏后6 h 时与吐脏前已无显著差异。此外,我们先前研究发现,刺参波里氏囊腔内体腔细胞数量在吐脏后也快速增加,吐脏后6 h 达到峰值,之后缓慢下降(数据尚未公开)。因此,本实验选择吐脏后6 h 对刺参波里氏囊腔和体腔中体腔细胞进行转录组测序,通过与正常刺参转录组数据进行差异分析,分别筛选波里氏囊腔和体腔中体腔细胞在吐脏胁迫下的差异表达基因,比较波里氏囊腔和体腔中体腔细胞对吐脏胁迫的响应差异,探讨体腔细胞在刺参吐脏后的生物学作用。
相对于体腔中体腔细胞在刺参吐脏前后的表达变化,波里氏囊腔中体腔细胞基因表达变化较小,共获得267 个显著差异基因。差异基因偏少的原因可能与刺参吐脏时波里氏囊及囊腔内体腔细胞不被排出体外,吐脏刺激对囊腔中体腔细胞的基因表达水平影响较小有关。然而,通过对差异基因的功能富集分析发现,囊腔内体腔细胞的差异基因所富集的功能和通路非常集中,差异基因大量富集至GO 功能注释的酶催化活性亚类。差异基因通路富集分析表明,仅有1 条代谢通路(甘氨酸、丝氨酸和苏氨酸代谢通路)被显著富集,其中PSAT1、甘氨酸-N-甲基转移酶(glycine N-methyltransferase,GNMT)、肌氨酸脱氢酶(sarcosine dehydrogenase,mitochondrial,SARDH)、甜菜碱高半胱氨酸甲基转移酶(betaine-homocysteine Smethyltransferase,BHMT)基因均显著上调表达。已有研究表明[10−11],丝氨酸和甘氨酸的代谢在细胞增殖过程中起着至关重要的作用,PSAT1 被认为是连接代谢途径(糖酵解)和氨基酸(丝氨酸)的生物合成途径中起着重要作用的转氨酶,PSAT1 已被证明在体外能够促进细胞增殖。因此,刺参波里氏囊腔内体腔细胞在吐脏胁迫下,差异基因显著富集到甘氨酸、丝氨酸和苏氨酸代谢通路,可能与波里氏囊腔内体腔细胞数量在吐脏后早期快速增加有关。
吐脏前后刺参体腔中体腔细胞共筛选出922 个显著差异基因,基因表达变化非常明显,这与刺参吐脏时几乎排尽体腔中原有体腔细胞有关。吐脏后体腔中的体腔细胞包括由造血组织新生成的细胞以及由其他组织部位(如水管系统)迁移而来的体腔细胞,这些细胞在基因表达上可能不同于原有细胞,另一方面在吐脏胁迫下,体腔细胞亦可发生相应的表达变化。总之,吐脏后体腔中体腔细胞与正常刺参体腔中体腔细胞存在极大的表达差异。在GO 富集分析生物学过程分类中,体腔中体腔细胞差异基因在细胞黏附、生物黏附等亚类富集最显著,在KEGG 通路中,显著富集到细胞外基质受体互作通路、转化生长因子-β信号通路、FoxO 等信号通路,这与波里氏囊腔内体腔细胞转录组所得结果存在很大差异。
细胞外基质是存在于所有组织和器官中的非细胞成分,它不仅为细胞成分提供了必要的物理支持,而且还与组织的形态发生、分化和内稳态有关,在创面愈合和组织重建等方面发挥着重要作用[12−13]。有研究表明[14−15],细胞外基质重建与海参吐脏后肠道再生过程中的伤口愈合和组织恢复有关,海参肠系膜的愈合和局部生长大部分是因为肠系膜边缘的组织重组,而不是来自于有丝分裂。此外,García-Arrarás 等[15]通过光镜和免疫组化研究显示,海参肠道再生过程中,肠系膜结缔组织与新生消化道的结缔组织相连处出现了正在迁移的变形细胞、血细胞、淋巴细胞和桑椹胚细胞。孙丽娜[16]研究发现,刺参新生肠壁的内部结缔组织大约有4 种类型细胞:未分化细胞、变形细胞、桑椹胚细胞、淋巴细胞,4 种细胞的数目在再生过程中都表现出先增高后降低的趋势,最终恢复到正常水平。本研究中,体腔中体腔细胞差异表达基因被显著富集到细胞外基质受体互作通路,其中软骨寡聚基质蛋白(cartilage oligomeric matrix protein,COMP)、胶原蛋白Ⅳ型α5 链(collagen alpha-5(IV) chain,COL4A5)、胶原蛋白Ⅸ型α2 链(collagen alpha-2(IX) chain,COL9A2)、血小板反应蛋白(thrombospondin-1,THBS-1)和基底膜特异性硫酸肝素蛋白多糖核心蛋白(basement membrane-specific heparan sulfate,HSPG2)等基因均显著上调。因此,我们推测刺参吐脏后再生早期,体腔中体腔细胞可能通过自身的迁移黏附和大量分泌细胞外基质,参与刺参内脏器官的再生过程。
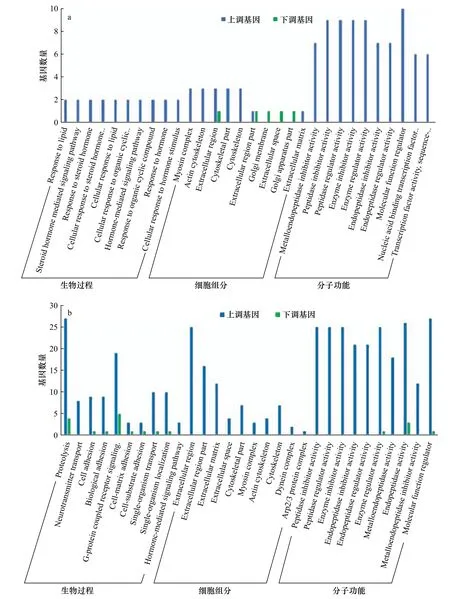
图2 GO 富集分析中显著差异基因的功能分类Fig.2 Functional categorization of significantly differential expression genes in Gene Ontology
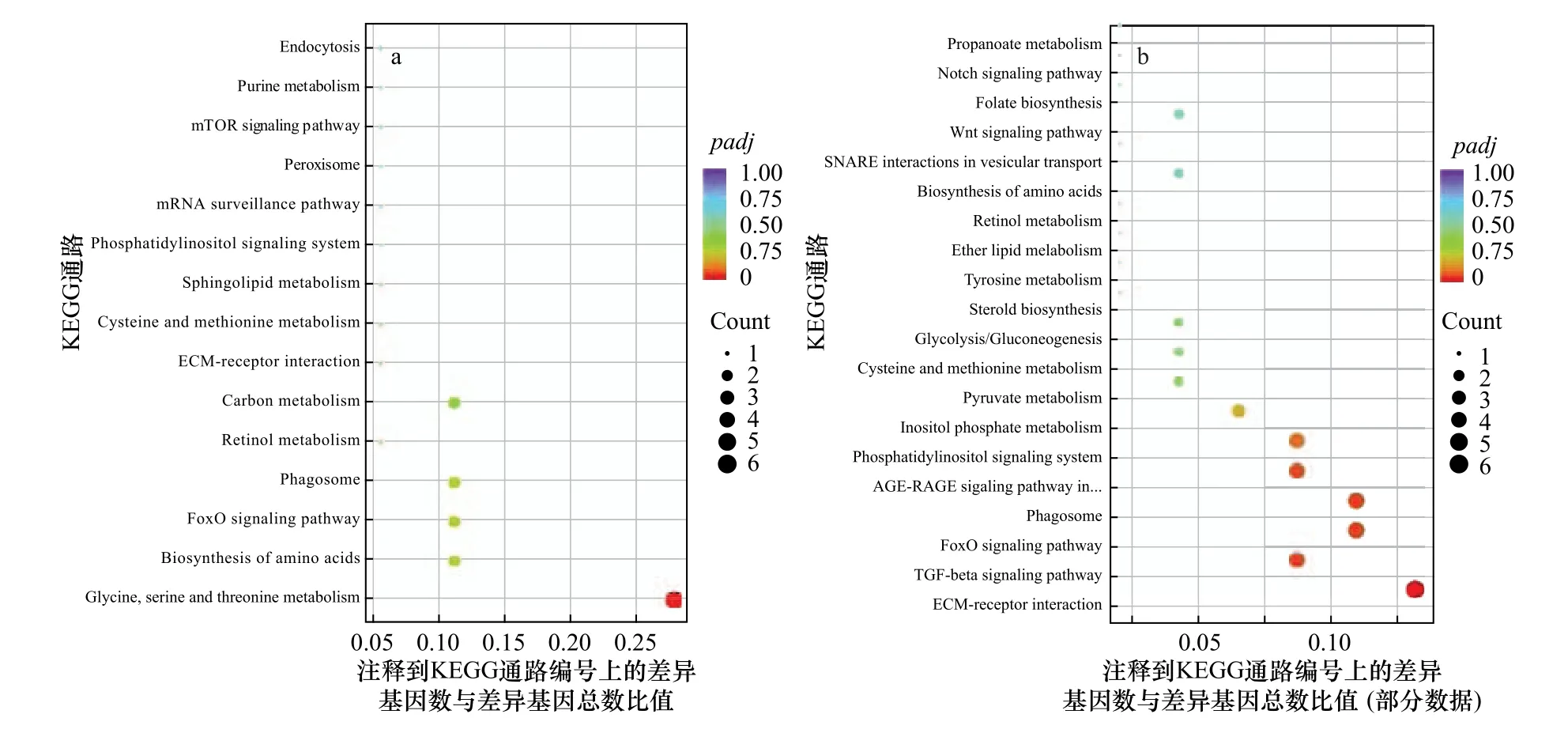
图3 显著差异基因的KEGG 通路富集分析Fig.3 KEGG pathway enrichment of significantly differential expression genes

表3 显著富集通路中的差异表达基因Table 3 The differential expression genes in significant enrichment pathways
续表3
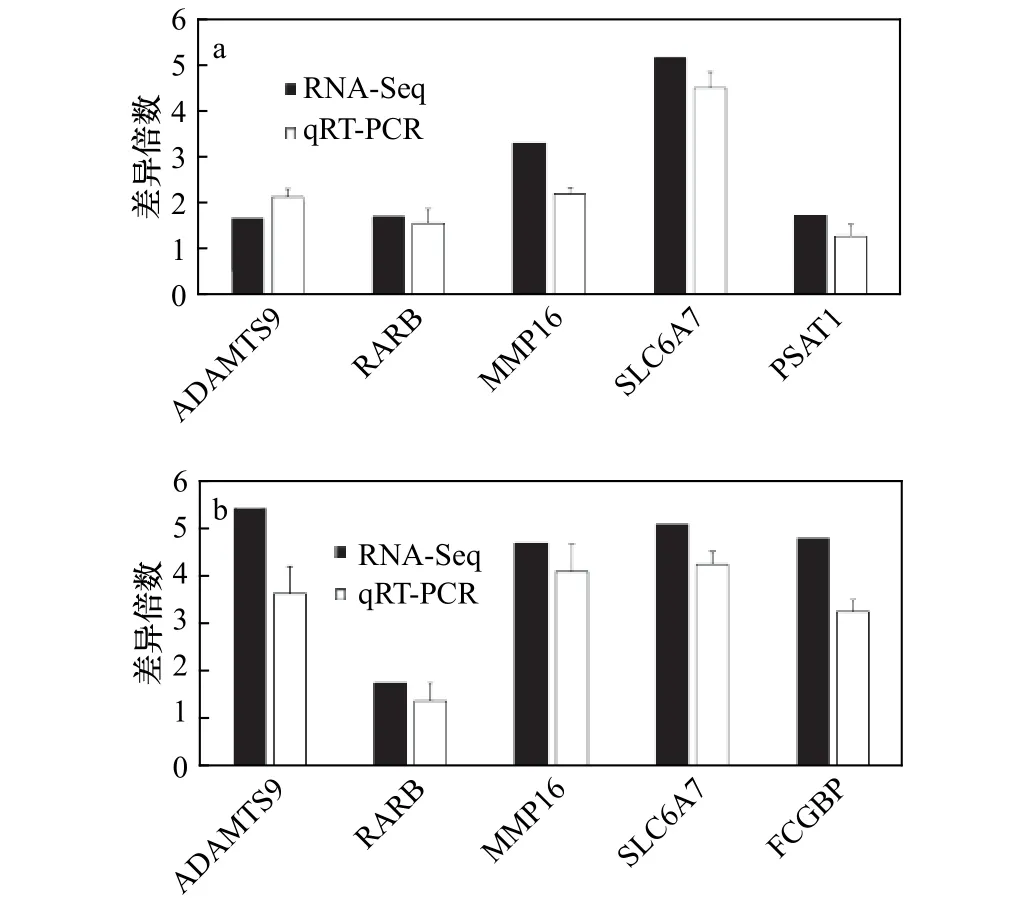
图4 qRT-PCR 验 证RNA-Seq 结果Fig.4 Verification of the RNA-Seq results using the qRT-PCR method
关于海参体腔细胞的来源,目前研究还没有确切结论,不过普遍认为是由“造血组织”产生一种类似于造血干细胞的祖原细胞,在体腔中再分化形成其他类型的体腔细胞[3,17−18]。本研究中,刺参吐脏后体腔中体腔细胞差异基因显著富集到FoxO 信号通路,细胞周期蛋白B(Cyclin B)和POLO 样蛋白激酶(polo-like kinase,Plk)基因显著下调。Cyclin B 是细胞周期前期/中期转变的重要调控因子,它通过激活cdc28 蛋白激酶和相应底物的磷酸化来促进多种生物进入有丝分裂[19−20]。Plk 是细胞分裂的重要正向调节因子,在有丝分裂、双极纺锤体形成、染色体分离和胞质分裂等过程中起关键作用[21−22]。因此,本实验中Cyclin B 和Plk基因的下调表达,提示刺参吐脏后再生早期,体腔中体腔细胞的有丝分裂活动减弱。我们先前研究发现,刺参吐脏后体腔中体腔细胞近乎排尽,而在吐脏后6 h细胞数量快速增加,与吐脏前已无显著差异。综合转录组结果分析认为,刺参吐脏后再生早期体腔中体腔细胞数量快速增加的原因,并不是由造血组织快速增殖产生,而主要是由其他组织部位(如水管系统)迁移而来。
TGF-β 信号通路可通过调节细胞的生长、增殖、分化、迁移和凋亡等过程,在组织与器官的发生和形成、机体的免疫反应等生物过程发挥重要的功能[23]。本研究中,体腔中体腔细胞差异表达基因被显著富集到TGF-β 信号通路,其中骨形成蛋白(bone morphogenetic protein,BMP)、THBS-1 等基因显著上调。已有研究证实,作为TGF-β 超家族成员,BMP 的功能不仅在骨骼,而且在胚胎早期形成以及许多器官和组织的发育和分化过程中都发挥重要作用[24]。近年来,越来越多的学者关注该基因家族与再生的关系,发现它们参与诱导动物再生,如蝾螈晶状体再生[25]、海参消化道再生[26]、大鼠的指尖再生[27]、非洲爪蟾幼体的尾部和肢体再生[28]等。本研究中,刺参吐脏后体腔中体腔细胞BMP 和THBS-1 基因上调表达,提示刺参吐脏后体腔中体腔细胞可能通过分泌释放生长因子,进而参与内脏器官的再生过程。
综上,本文分别对刺参吐脏后6 h 与吐脏前波里氏囊腔和体腔中体腔细胞进行转录组测序,比较了波里氏囊腔与体腔中体腔细胞在吐脏胁迫下的基因表达变化。研究结果表明,刺参波里氏囊腔与体腔中体腔细胞对吐脏胁迫的响应存在明显差异,这对进一步研究刺参体腔细胞的功能及揭示刺参吐脏后的再生机制提供了重要基础。

