羧基化多壁碳纳米管与镉复合干扰蚕豆幼苗生理特性的研究
刘玲,许婷婷,赵薪程,刘海燕,戴慧芳,杨俊文,汪承润,*
1. 淮南师范学院生物工程学院,淮南 232038 2. 资源与环境生物技术安徽普通高校重点实验室,淮南 232038
碳纳米管(CNTs)是一种具有特殊结构的量子材料[1],具有吸附性能好、催化能力强和热稳定性高等优良特性[2]。依据其所含石墨烯片的层数可分为单壁碳纳米管(SWCNTs)和多壁碳纳米管(MWCNTs)。相对于SWCNTs,MWCNTs易于生产且成本较低,已逐渐成为化学、食品和生物等领域中的研究重点。但由于MWCNTs表面缺少活性基团,在范德华力的作用下极易团聚或缠绕,很难在溶剂中实现均匀分散[3],限制了其功能的发挥。因此,在MWCNTs表面引入—COOH等亲水基团来提高其溶解性和分散性已经成为了CNTs走向实用化的关键[4]。在生产和使用过程中MWCNTs不可避免地会释放到环境中,改性的MWCNTs进入环境后引发的毒性效应和对人类潜在的健康风险已引起学术界的广泛关注[5-6]。目前,关于碳纳米材料的研究主要集中在动物和微生物,例如,CNTs能够造成大型蚤的死亡[7]、抑制蝌蚪的生长[8]和使小鼠出现DNA氧化损伤[9]等;同时,CNTs具有抗菌活性,能够阻碍细菌微生物膜的形成,与细菌直接接触会造成细菌的死亡[10]。对植物而言,MWCNTs不仅可以抑制植物生长、降低植物组织生物量[11-12],还能够促进种子的萌发以及植物的生长发育[13-14]。
重金属镉(Cd)是生物非必需金属元素,也是生物毒性最强的重金属元素之一[15-17],广泛存在于自然界中。由于工业冶炼及电池、含Cd涂料等的生产和使用,加之其排放到水体中难降解、易富集[18],使得Cd污染不仅影响了植物生长,而且通过食物链严重影响人类健康[19-20]。CNTs因具有巨大的比表面积和丰富的孔隙结构,使其表现出对金属离子有优异的吸附性能[21],当CNTs达到一定浓度时,会复合重金属使毒性作用增强,对植物的生理产生胁迫作用。然而,国内外有关改性MWCNTs复合重金属离子对植物生理影响的研究报道甚少[22]。因此,本研究以蚕豆幼苗为实验对象,选用Cd作为典型的重金属,研究蚕豆幼苗暴露于不同浓度的羧基化多壁碳纳米管(MWCNTs-COOH)及其复合Cd污染溶液后,其幼苗生理各项指标的变化,以期为MWCNTs-COOH的安全使用及其对环境的污染评价提供理论参考。
1 材料与方法(Materials and methods)
1.1 羧基化多壁碳纳米管表征
MWCNTs-COOH (外径8~15 nm,长度0.5~2 μm,纯度>95%)购自中科时代纳米成都有机化学有限公司。采用场发射扫描电子显微镜(GeminiSEM 300,德国ZEISS公司)表征MWCNTs-COOH表面形貌(图1)。

图1 羧基化多壁碳纳米管(MWCNTs-COOH)扫描电镜图(SEM)Fig. 1 The scanning electron microscope (SEM) image of carboxylated multi-walled carbon nanotubes (MWCNTs-COOH)
1.2 实验材料
蚕豆(ViciafabaL.)种子为淮南当地常见品种(青皮豆),购于淮南圆和种子公司。
1.3 实验设计
挑选颗粒饱满的蚕豆种子,用0.1%次氯酸钠溶液浸没10 min后在Milli-Q水中充分漂洗,室温用Milli-Q水浸泡24 h进行催芽处理,待蚕豆出芽后播种于湿润的石英砂中,筛选根尖长2 cm左右的幼苗并移入装有1/4Hoagland营养液的培养盒中,待幼苗长出第2片真叶后,接受如下处理:CK、1.5 mg·L-1MWCNTs-COOH (T1)、3.0 mg·L-1MWCNTs-COOH (T2)、6.0 mg·L-1MWCNTs-COOH (T3)、12.0 mg·L-1MWCNTs-COOH (T4)、Cd (T5)、Cd+1.5 mg·L-1MWCNTs-COOH (T6)、Cd+3.0 mg·L-1MWCNTs-COOH (T7)、Cd+6.0 mg·L-1MWCNTs-COOH (T8)、Cd+12.0 mg·L-1MWCNTs-COOH (T9),Cd为分析纯CdCl2,所有含Cd培养液中Cd含量均为10 μmol·L-1,Hoagland营养液为所有处理基本培养液,pH为6.5~6.8,每个处理重复3次(3个培养盒各培养48株幼苗),每3天更换一次处理液,用加氧泵进行连续通气。待幼苗长出第5片叶后(图2),剪取倒三叶开展实验。

图2 单一MWCNTs-COOH处理组及与Cd复合处理组的蚕豆生长状况注:CK、T1、T2、T3、T4、T5、T6、T7、T8和T9为对照组、1.5 mg·L-1 MWCNTs-COOH组、3.0 mg·L-1 MWCNTs-COOH组、6.0 mg·L-1 MWCNTs-COOH组、12.0 mg·L-1 MWCNTs-COOH组、Cd处理组、Cd+1.5 mg·L-1 MWCNTs-COOH组、Cd+3.0 mg·L-1 MWCNTs-COOH组、Cd+6.0 mg·L-1 MWCNTs-COOH组、Cd+12.0 mg·L-1 MWCNTs-COOH组,所有含Cd处理组中Cd含量均为10 μmol·L-1。Fig. 2 Growth status of Vicia faba under single MWCNTs-COOH and MWCNTs-COOH combined with Cd treatmentsNote: CK, T1, T2, T3, T4, T5, T6, T7, T8 and T9 represent control group, 1.5 mg·L-1 MWCNTs-COOH group, 3.0 mg·L-1 MWCNTs-COOH group, 6.0 mg·L-1 MWCNTs-COOH group, 12.0 mg·L-1 MWCNTs-COOH group, Cd treatment group, Cd+1.5 mg·L-1 MWCNTs-COOH group, Cd+3.0 mg·L-1 MWCNTs-COOH group, Cd+6.0 mg·L-1 MWCNTs-COOH group, Cd+12.0 mg·L-1 MWCNTs-COOH group; in all the treatment groups containing Cd, Cd content are all 10 μmol·L-1.
1.4 实验方法
1.4.1 叶绿素含量和根系活力测定
叶绿素含量的测定:参照胡秉芬等[23]的方法,准确称取0.5 g倒四叶于研钵中,加入80%丙酮25 mL进行研磨,然后将研磨好的匀浆滤入50 mL容量瓶中,用80%丙酮洗净研钵和滤纸,洗液并入容量瓶中定容至50 mL,利用分光光度计(T6新世纪,北京普析通用仪器有限责任公司)测OD649和OD665,计算叶绿素含量。
根系活力的测定:采用氯化三苯基四氮唑(TTC)还原法[24]。准确称取根系样品0.5 g于烧杯中,加入5 mL 0.4% TTC溶液和5 mL磷酸缓冲液的混合溶液,充分浸没,在37 ℃黑暗条件下处理1.5 h,加入2 mL的1 mol·L-1的硫酸终止反应;取出根并将其剪碎,加入3 mL乙酸乙酯,研磨后将红色提取液转移到容量瓶中并定容至10 mL,测OD485,计算还原量。
1.4.2 氧化损伤的测定
根和叶丙二醛(MDA)含量的测定:参照硫代巴比妥酸(TBA)显色法[26]。准确称取根、叶0.5 g,加入5 mL三氯乙酸(TCA)进行充分研磨,匀浆液以4 000 r·min-1离心10 min,吸取2mL MDA提取液,加入2 mL 6 g·L-1TBA溶液,置于沸水中煮沸15 min,迅速冷却并离心,利用分光光度计测OD532和OD450。
叶片H2O2定位:取不同处理的蚕豆叶片,放入适量二氨基联苯胺(DAB)溶液中进行暗处理6 h,期间要经常振荡,确保叶片浸在溶液中。之后光处理1 h至红棕色斑点出现为止,用蒸馏水冲洗叶片并加入适量脱色液(75%无水乙醇+5%甘油+20%水),在80 ℃水浴中进行脱色,直到脱色完全,观察并拍照[27]。
根细胞死亡检测:取不同处理的蚕豆根尖,置于0.25% (m/V)伊文思蓝溶液染色5 min[28],用蒸馏水冲洗3次后迅速放入50%的FAA固定液(38%甲醛5 mL,乙酸5 mL,70%乙醇90 mL)中,经乙醇逐级脱水,二甲苯逐级脱乙醇,石蜡逐级脱二甲苯后,进行石蜡包埋[29]。采用旋转切片机(HM 315,MICROM,德国)切片,片厚4 μm,制成临时装片,利用光学显微镜(CX23LEDRFS1C,奥林巴斯广州工业有限公司,中国)观察。
1.4.3 SOD和POD活性的测定
超氧化物歧化酶(SOD)和过氧化物酶(POD)测定分别参照氮蓝四唑光还原法和愈创木酚比色法[30-31]。
SOD活性测定:6 mL反应混合液含3.5 mL磷酸缓冲液、0.5 mL甲硫氨酸、0.5 mL氮蓝四唑、0.5 mL乙二胺四乙酸二钠(Na2EDTA)、0.4 mL蒸馏水、0.5 mL核黄素和100 μL酶液。以不照光的对照管做空白,分别测定其他各管的吸光度。
POD活性测定:以一只加入3 mL反应混合液(50 mL pH 6.0磷酸缓冲液+28 μL愈创木酚+19 μL 30%过氧化氢)、1 mL 20mmol·L-1KH2PO4的比色皿作为对照,其余比色皿中各加入3 mL反应混合液、1 mL酶液,立即开启秒表计时并在分光光度计470 nm波长下测量OD值。
1.5 数据分析
采用Excel 2016、SPSS 13.0软件进行数据统计和单因素方差分析,Duncan法进行多重比较,利用Origin 7.5软件对数据分析结果作图,利用AutoCAD 2019对受损叶片面积进行统计。
2 结果(Results)
2.1 MWCNTs-COOH复合Cd对蚕豆幼苗叶绿素含量和根系活力的影响
由图3可知,MWCNTs-COOH单一处理蚕豆幼苗,呈现出随着MWCNTs-COOH浓度的增加,叶绿素含量先升高后降低的趋势,当MWCNTs-COOH浓度为3.0 mg·L-1时,叶绿素含量达到最大值1.29 mg·g-1;而根系活力随MWCNTs-COOH浓度的增加呈下降趋势,其中,12.0 mg·L-1MWCNTs-COOH单一处理导致根系活力显著下降(P<0.05)。蚕豆幼苗在MWCNTs-COOH与10 μmol·L-1Cd共同影响下,随MWCNTs-COOH处理浓度的增加叶绿素含量呈降低趋势,但是复合处理间差异不显著(P>0.05);所有复合处理组根系活力皆低于对应的MWCNTs-COOH单一处理,与单一Cd处理相比,6.0 mg·L-1MWCNTs-COOH复合Cd处理使根系活力显著下降(P<0.05);MWCNTs-COOH复合Cd处理组的叶绿素含量整体低于MWCNTs-COOH单一处理组。

图3 单一MWCNTs-COOH处理组及与Cd复合处理组中蚕豆叶绿素含量和根系活力变化注:不同小写字母表示不同处理间差异显著(P<0.05);下同。Fig. 3 Changes of chlorophyll content and root activity of Vicia faba under single MWCNTs-COOH and MWCNTs-COOH combined with Cd treatmentsNotes: The different lowercase letters in the figure indicate significant differences among different treatments at (P<0.05) levels; the same below.
2.2 MWCNTs-COOH复合Cd对蚕豆幼苗的氧化损伤产生速率的变化

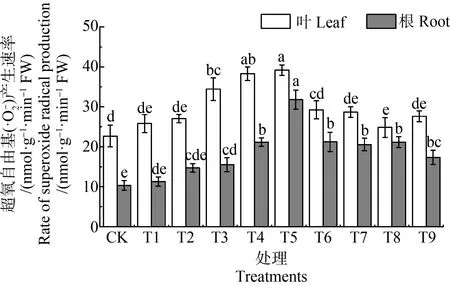
图4 蚕豆叶片和根系中超氧自由基产生速率的变化Fig. 4 Changes of superoxide radical production rates in leaves and roots of Vicia faba
2.2.2 叶片H2O2定位及根尖细胞染色
由图5和表1可知,MWCNTs-COOH单一处理诱导蚕豆幼苗叶中红褐色斑点增多,6.0 mg·L-1MWCNTs-COOH单一处理显著诱导叶片氧化损伤(P<0.05),而根尖细胞染色在MWCNTs-COOH浓度为12 mg·L-1时急剧加深;MWCNTs-COOH与10 μmol·L-1Cd共同胁迫下,叶中红褐色斑点和根尖细胞颜色变化呈现相同趋势(先浅后深);当MWCNTs-COOH浓度为12 mg·L-1时,叶中红褐色斑点最深且所占叶面积最大,达到64.2%,而根尖结构不完整,染色较浅。
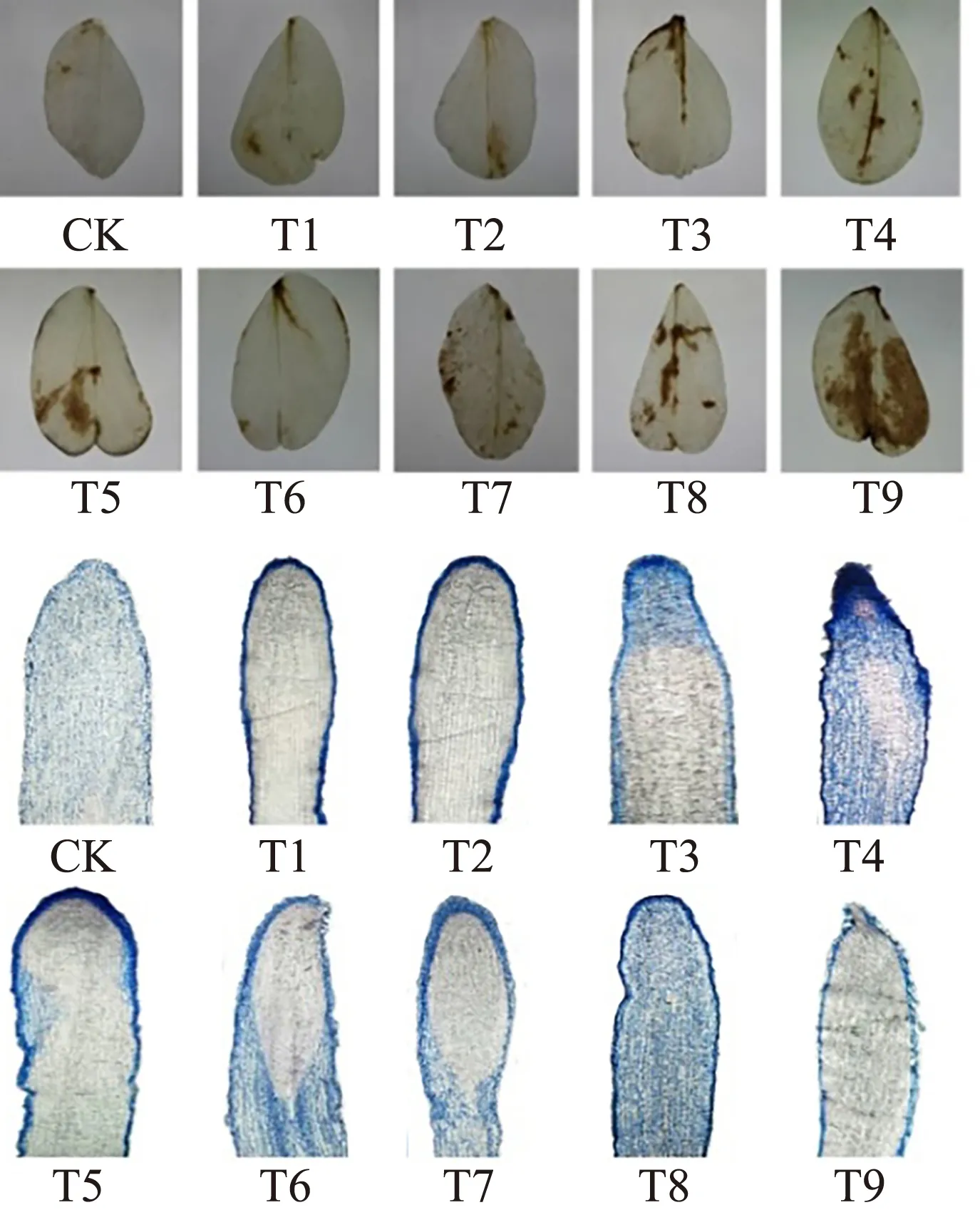
图5 蚕豆叶片过氧化氢(H2O2)定位及根尖细胞染色Fig. 5 Leaf hydrogen peroxide (H2O2) localization and root tip cell staining of Vicia faba
2.2.3 MDA含量的变化
由表2可知,MWCNTs-COOH单一处理蚕豆幼苗,根和叶MDA含量皆高于对照,但各处理组之间差异不显著(P>0.05);与10 μmol·L-1Cd复合后,3.0 mg·L-1MWCNTs-COOH诱导根和叶MDA含量下降且均低于Cd处理,6.0 mg·L-1MWCNTs-COOH复合Cd处理下,根MDA含量显著上升(P<0.05);所有复合处理组根和叶MDA含量皆高于对应的MWCNTs-COOH单一处理。

表1 蚕豆叶片氧化损伤面积Table 1 The oxidative damaged area of Vicia faba leaves

表2 蚕豆叶片和根系中丙二醛(MDA)含量变化Table 2 Changes of malondialdehyde (MDA) content in leaves and roots of Vicia faba (nmol·g-1 FW)
2.3 MWCNTs-COOH复合Cd对蚕豆幼苗2种抗氧化酶活性的影响
由图6可知,MWCNTs-COOH单一处理蚕豆幼苗后,根和叶SOD及POD活性较对照均上升,其中,6.0 mg·L-1MWCNTs-COOH诱导根和叶SOD活性显著升高(P<0.05),根SOD活性达到最大值150.21 U·mg-1,而叶SOD活性在MWCNTs-COOH浓度为12.0 mg·L-1时达到最大;当MWCNTs-COOH浓度在1.5 mg·L-1和12.0 mg·L-1时,叶和根POD活性达到最大,分别为152.78 U·mg-1和379.02 U·mg-1。不同浓度梯度的MWCNTs-COOH与10 μmol·L-1Cd复合胁迫下,叶SOD与根POD活性均呈先下降后上升趋势,各处理组叶SOD活性之间差异不显著(P>0.05),而6.0 mg·L-1MWCNTs-COOH复合Cd诱导根POD活性显著升高(P<0.05),与此同时,复合Cd处理组均使根POD活性低于Cd单一处理;SOD活性皆低于对应MWCNTs-COOH单一处理;叶SOD活性总体上比根SOD活性高,而叶POD活性则低于根的。
3 讨论(Discussion)
3.1 MWCNTs-COOH复合Cd对蚕豆幼苗叶绿素含量和根系活力的影响
叶绿素是植物吸收太阳光能进行光合作用的重要物质,其含量的高低直接影响植物光合作用的水平,而根系活力的高低直接影响着植物地上部分的生长发育[32-33]。因此,两者都是植物响应逆境胁迫的重要生理体现。杨祥宇[34]研究了黄瓜和芦苇等湿地植物叶绿素含量在纳米二氧化钛胁迫下的变化,实验结果表明,1~50 mg·L-1纳米二氧化钛能不同程度地提高叶绿素含量。Begum等[35]利用未改性MWCNTs处理水稻等幼苗,结果表明,0~200 mg·L-1MWCNTs处理下,根系活力呈上升趋势。本研究中,蚕豆幼苗在1.5~6.0 mg·L-1MWCNTs-COOH单一处理下叶绿素含量升高,但根系活力皆低于对照。与前人研究对比,蚕豆幼苗对MWCNTs-COOH的耐受范围低于纳米二氧化钛处理下的芦苇及MWCNTs处理下的水稻等植物。原因是MWCNTs-COOH是改性的纳米材料,能够穿透植物根部细胞壁,对植物的毒害大于未改性的MWCNTs[22]。此外,植物种类的不同也会使其对纳米材料的耐受浓度范围产生差异。当MWCNTs-COOH与Cd共同胁迫蚕豆幼苗时,1.5~3.0 mg·L-1MWCNTs-COOH反而促进根系活力的增加,原因是MWCNTs-COOH可有效吸附环境中的重金属离子[36],使部分Cd被附着在MWCNTs-COOH上,减弱了Cd对植物根系的损伤。
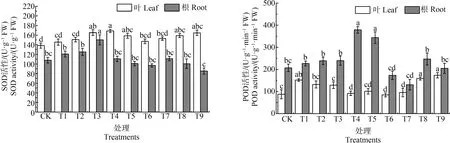
图6 蚕豆叶片和根系中超氧化物歧化酶(SOD)、过氧化物酶(POD)活性变化Fig. 6 Changes of superoxide dismutase (SOD) and peroxidase (POD) activities in leaf and root system of Vicia faba
3.2 MWCNTs-COOH复合Cd对蚕豆幼苗的氧化损伤

3.2.2 对根尖的影响
植物在受到胁迫时,根尖细胞会出现不同程度的损伤,损伤程度越大,表明其受到的胁迫越严重。伊文思蓝能够与蛋白结合形成伊文思蓝蛋白复合物,但不能透过正常细胞膜;当细胞受损后,其进入细胞并结合蛋白,使细胞染成蓝色[28]。因此,可以根据细胞染色程度来判断根尖的受损情况。在MWCNTs-COOH单一处理下,根尖细胞染色程度随MWCNTs-COOH浓度的增加而逐渐加深,尤其当浓度达到12.0 mg·L-1时,根尖细胞染色最深,受损最严重。12.0 mg·L-1MWCNTs-COOH复合Cd后,蚕豆幼苗随时间的增长出现根部腐烂现象,导致部分细胞脱落,根尖细胞染色变浅,该现象与邱清华等[43]利用白菜等十字花科植物在Pb胁迫下的实验结果相同,表明蚕豆根尖在高浓度MWCNTs-COOH与Cd共同胁迫下细胞受到严重毒害。
3.2.3 对MDA含量的影响

3.3 MWCNTs-COOH复合Cd对蚕豆幼苗SOD和POD活性的影响

本研究结果表明,低浓度MWCNTs-COOH对植物生理代谢有一定的促进作用,并能吸附一定量的Cd,减弱Cd对植物的毒害作用。高浓度MWCNTs-COOH单一与复合Cd处理会对植物产生胁迫,加重植物氧化损伤程度。因此,值得警示的是:持续向环境中释放MWCNTs-COOH,可能会引起植物毒性,加剧因复合重金属Cd而带来的生态风险。

