Ebstein畸形合并预激综合征的射频消融治疗
(陆军军医大学第一附属医院心血管内科,重庆 400038)
三尖瓣下移畸形又称为Ebstein畸形,由Ebstein于1866年首次报道,是一种罕见的先天性心脏畸形,指部分或整个有效心脏三尖瓣环向下移位,同时伴有心脏三尖瓣瓣膜装置的畸形和右心室结构的改变[1]。Ebstein畸形的发病率在先天性心脏病中不到1%[2]。由于Ebstein畸形患者解剖变异及病程差异较大,故预后也不尽相同,病情轻的患者可无症状地存活到成年,个别患者甚至到了老年也无严重症状;而病情严重的患者在婴幼儿期就症状危重,大多数患者在20岁之前病死[3]。各个年龄组患者大多数有紫绀症状,并存在三尖瓣反流、室上性心动过速、右心功能不全等症状。约10%的Ebstein畸形患者在体表心电图上有预激综合征的表现,多数位于右后、外侧游离壁或右间隔旁道,即B型预激综合征[4]。治疗Ebstein畸形的关键是恢复三尖瓣的关闭和右心室的功能,临床上常用三尖瓣成形、三尖瓣置换等手术方式,合并有预激综合征者外科手术前先行导管射频消融,或者在处理三尖瓣前先行消融[5]。本研究选择9例Ebstein畸形合并预激综合征的患者与25例心脏结构正常的预激综合征患者进行比较分析,以探讨射频消融治疗Ebstein畸形合并预激综合征的临床疗效,现报告如下。
1 资料与方法
1.1 临床资料
我院2009年1月至2019年11月共收治101例Ebstein畸形患者,选择其中9例Ebstein畸形合并预激综合征并进行射频消融治疗的患者作为Ebstein组,随机选择同期行射频消融的25例心脏结构正常的B型预激综合征患者作为对照组。Ebstein组中男7例,女2例,年龄31~57岁,平均(41±9.7)岁,心脏超声心动图证实均合并Ebstein畸形;对照组中男11例,女14例,年龄15~62岁,平均(35.8±13.1)岁。对比2组患者临床资料,除右心房和右心室大小差异有统计学意义(P<0.05),其他资料组间比较差异无统计学意义(P>0.05),具有可比性(表1)。

表1 患者临床资料比较
*:与对照组比较,P<0.05
1.2 方法
1.2.1 心内电生理检查 术前停用抗心律失常药物5个半衰期以上。在利多卡因或普鲁卡因局部麻醉下,采用Seldinger法穿刺左锁骨下静脉及股静脉成功后分别置入鞘管,经鞘管先后置入标测电极至希氏束、高位右房、右心室、冠状静脉窦,并记录腔内心电图和体表心电图, 经高位右房和右室心尖部程控刺激完成电生理检查,确定心动过速类型和消融靶点。
1.2.2 旁道标测 采用左前斜位45°或右前斜位30°投照以利于不同部位的细致标测,使三尖瓣环呈现最大展示。以消融导管及希氏束电极导管探查三尖瓣口最低点、最高点和右侧缘,构成三尖瓣环的轮廓。先依据体表心电图确定旁道大致区域,再以消融导管在三尖瓣环相应位置作精细标测[6]。在心动过速或心室起搏下以A、V波融合,A波或V波最提前的点为消融靶点。右后侧旁路者导管不易打弯,无法贴靠,此时将导管的远端部分弯曲为倒U型可增加贴靠程度,增加成功率。
1.2.3 消融 确认靶点图满意后采用温控射频能量发生器连接消融导管,于靶点处试放电消融。温度选择50~55 ℃,能量选择30~60 W,在心动过速或心室起搏下放电,首次放电10 s,有效后在原靶点连续放电60~ 120 s。观察10 min,使用异丙肾上腺素后心室预激波未恢复,心室起搏见室房分离,消融成功。若消融电极难以稳定贴靠三尖瓣环则选用Swartz鞘。
1.3 评价标准及观察指标
消融成功的标志为心室预激波消失,心室S1S1刺激见室房分离,重复术前诱发条件无房室折返性心动过速发作。对比分析2组患者的手术时间、消融时间、放电次数、放电功率及临床疗效。
1.4 统计学分析

2 结果
2.1 旁道特点及消融时电生理特征
Ebstein组9例患者中,有8例为单旁道,1例为双旁道;对照组25例患者中,有2例为双旁道,其余均为单旁道。Ebstein组手术时间、消融时间、放电次数和放电功率均大于对照组,2组比较差异有统计学意义(P<0.05),见表2。

表2 患者电生理特征比较
*:与对照组比较,P<0.05
2.2 患者消融效果比较
Ebstein组9例患者的10条旁路被成功消融,有3例患者选用Swartz鞘辅助使消融电极贴靠稳定而完成手术。对照组患者顺利完成消融手术,效果满意。
2.3 随访结果
Ebstein组患者平均随访(64.44±34.85)个月,对照组患者平均随访(53.12±13.83)个月,2组患者均无手术并发症发生,均无复发病例。
2.4 典型病例
患者,男,46岁。因阵发性心悸,胸闷19年,再发加重2个月入院。入院后心电图示B型预激综合征,心脏超声心动图示三尖瓣下移畸形。排除手术禁忌证后行心内电生理检查及射频消融术。常规消毒铺巾,局部麻醉下行右股静脉和左锁骨下静脉穿刺,成功后分别放入血管鞘,然后在X射线透视下将标测电极放至希氏束、高位右房、右心室和冠状静脉窦,冠状窦电极记录到CS9,10V波提前(图1a)。行右心房S1S1刺激诱发阵发性室上性心动过速(图1b),冠状窦电极记录到CS9,10A波提前,结合体表心电图,考虑为右侧显性房室旁道(图1c),行右心房S1S1刺激终止心动过速。然后右前斜位30°透视投照,经右股静脉鞘管放入大头导管至三尖瓣环附近标测,于游离壁7∶00处标测见V波最提前,V-A融合,行心室起搏见A波最提前,V-A融合,以此为靶电位,40 W消融10 s,体表心电图预激波消失,证明消融有效,巩固消融120 s后预激波彻底消失(图1d)。再次行心房S1S1刺激诱发阵发性室上性心动过速(图1e),图形特征与之前心动过速发作时的特征不一致。冠状窦电极记录到CS9,10A波最提前,考虑仍有另一个右侧旁道存在(图1f)。行右心房S1S1刺激终止心动过速后,心室起搏下反复于希氏束旁标测到A波提前,V-A融合,30 W消融2 s后见室房分离,巩固消融60 s。观察10 min,使用异丙肾上腺素后心室预激波未恢复,心室起搏见室房分离,消融成功。S1S2500/400 ms刺激未再诱发心动过速,结束手术。术后心电图示正常,随访47个月,心悸未再发作。
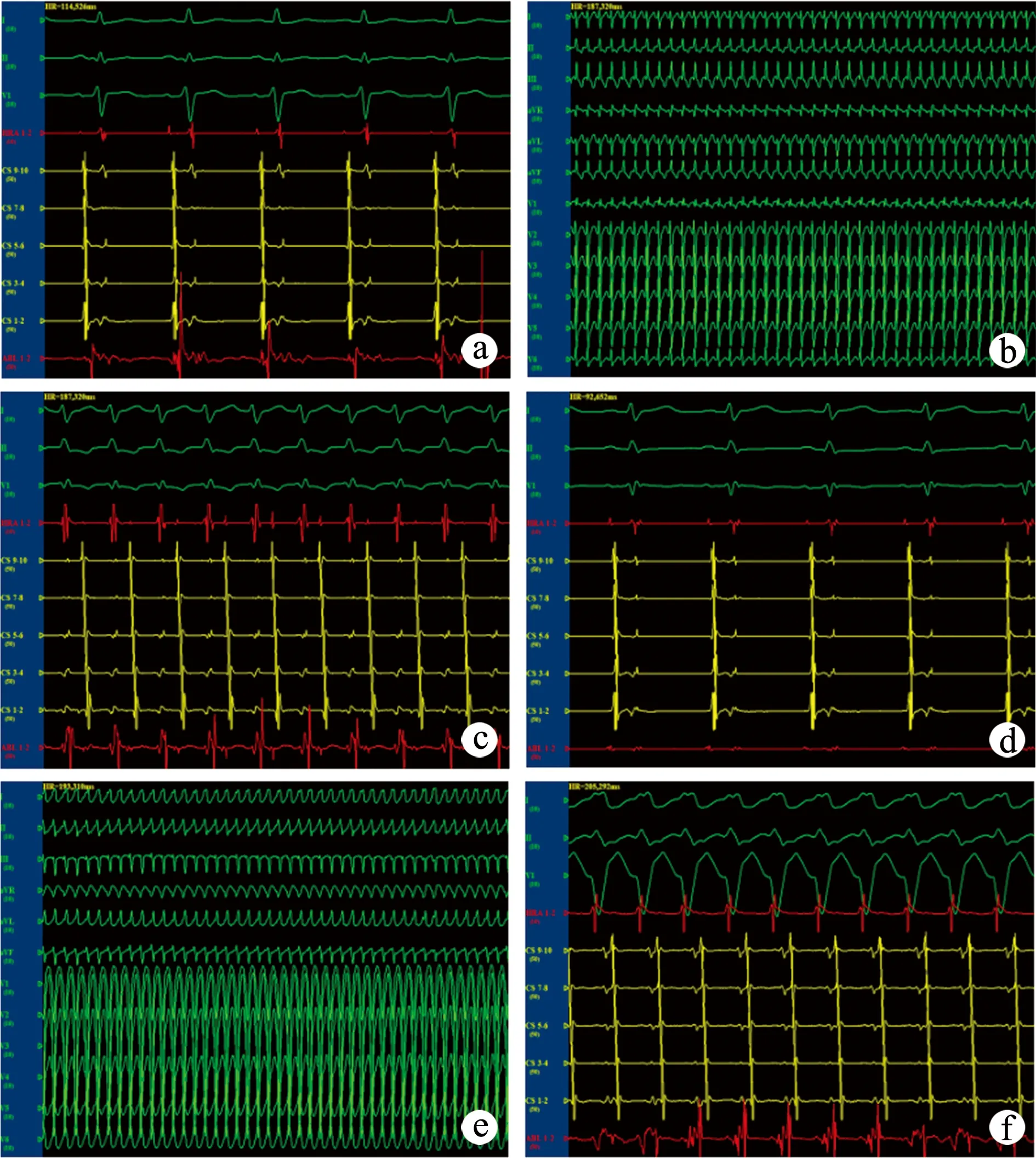
a:冠状窦电极记录到CS9,10V波提前;b:诱发阵发性室上性心动过速;c:冠状窦电极记录到CS9,10A波提前;d:预激波消失;e:再次诱发阵发性室上性心动过速;f:另一个右侧房室旁道
图1 典型病例资料
3 讨论
Ebstein畸形是一种复杂的先天性心脏病,其发病率在先天性心脏病中占比不高[7]。Ebstein畸形主要是前瓣叶的位置大多正常,而隔瓣叶和后瓣叶下移,没有附着在三尖瓣的纤维环部位而附着在近心尖的右心室壁,从而把右心室分为两个腔,即心房化的右心室和功能性的右心室[8]。Ebstein畸形根据病理解剖分型分为以下3型:轻型,心脏三尖瓣的3个瓣叶发育较好,仅有隔瓣和后瓣下移2~3 cm;中间型,心脏三尖瓣隔瓣发育不全或缺如,前瓣有部分下移,和后瓣融合成为1个大的瓣叶,隔瓣和后瓣下移的最低点可达心尖,无正常腱索与乳头肌,绝大多数有较严重的关闭不全;重型,瓣膜严重畸形,隔叶和后叶可下移到肺动脉瓣下2~3 cm处,瓣膜装置缺如或发育不全[9-10]。Ebstein畸形功能性右室缩小,右房明显扩大,导致血流动力学改变及房室交界区心电生理异常,易出现心力衰竭和各种心律失常。由于Ebstein畸形病死率高,有手术适应证的患者可行手术治疗,以恢复三尖瓣的关闭和右心室的功能。多数Ebstein畸形患者应尽量选择瓣膜成形和双心室矫治,如果患者术前心功能差,无法耐受长时间转机,可考虑简单快速、效果确切的三尖瓣置换术[11-12]。Ebstein畸形合并心律失常者可在进行外科手术之前先行导管射频消融,或在外科手术中处理三尖瓣前先行消融。
Ebstein畸形患者合并预激综合征,且多为B型预激综合征,多旁道发生率高达25%~50%[13]。 Ebstein畸形患者同时合并房颤导致血流动力学紊乱,50%的Ebstein畸形患者可记录到复杂波形的碎裂电位,在射频消融过程中无法分辨室波和房波的起始,增加了靶点识别和旁道定位的难度[14-16]。对病灶标测(靶点标测)的精准度决定了射频消融成功与否。心内电生理检查可标测心电图,对于预激综合征旁路定位有重要意义。射频消融术是通过心脏导管利用射频能源阻断预激综合征不正常的传导途径,使Ebstein畸形合并患者的心动过速得到根治。Ebstein畸形合并预激综合征患者的治疗在引进心内电生理检查和射频消融后发生了革命性的变化,患者根治率高,复发率低,而且在手术过程中痛苦小[12]。早期的患者采用右冠状动脉电极标测的方法,但是该方法存在消融时放电次数较多、能量大、时间长等不足,其原因可能为[17-18]:①Ebstein畸形患者房化的右室壁较薄,靶点图的A波大部分等于或大于V波;②心室肌房化,A、V波融合时限在120 ms以上,而且多出现多相碎裂波。Ebstein畸形患者旁路多位于右侧,以分布于右后间隔至右后侧壁为常见,其消融导管的稳定性较差,房室旁路的射频消融难度较大[19-23],其原因可能为:①Ebstein畸形患者的右心结构严重变异,因为要选择在正常三尖瓣环部位,而不是下移三尖瓣瓣叶附着的部位,故寻找射频消融靶点有难度;②大部分患者房化心室区域局部电位形态碎裂,影响消融靶点的判断;③患者右心结构扩大,电极不能固定贴靠消融靶点位置;④靶点处的心肌菲薄,为了避免损伤右冠状动脉,可能影响到消融的强度及深度。Ebstein畸形患者由于瓣膜位置发生了显著改变,增加了手术操作的难度,但射频消融治疗Ebstein畸形的手术操作与心脏结构正常的右侧房室旁路相似,成功率高。本研究中Ebstein组手术时间、消融时间、放电次数、放电功率均较对照组有所增加,但2组患者治疗效果比较差异无统计学意义,提示Ebstein畸形合并预激综合征的患者能获得与心脏结构正常的B型预激综合征患者相当的治疗效果,其原因主要为:①消融靶点均位于正常解剖三尖瓣瓣环位置;②采用心室起搏或心动过速下标测A、V波融合点作为消融靶点[24];③Ebstein畸形患者旁路位于右侧,消融导管的稳定性差,采用Swartz鞘支撑有利于导管与三尖瓣环的稳定接触;④标测顺序为导管置于瓣环房侧记录到高大房波→缓慢向室侧移动→记录A、V波处→再以此点为起始→纵向标测邻近区域[25];⑤Ebstein畸形合并房颤反复发作患者可依据体表心电图对旁道进行推测或初步定位,在房颤状态下对心室激动顺序进行标测;⑥旁道前传功能消失后证实逆传功能必须在窦性心律下进行,其他情况下不必多次电复律以求在窦性心律下标测;⑦消融时不强求小A波大V波,尽量避免在房化的右室侧放电[26];⑧放电时如有频发室性早搏则提示放电靶点位于室侧,应立即停止放电。
传统的射频消融要在X射线透视下进行电生理检查,消融成功率较低,手术时间和X射线曝露时间长,不能直观显示心脏的解剖结构,只能采集到局部的电信号,无空间分辨、记忆、定位等功能,对Ebstein畸形患者复杂的心律失常标测存在很大困难。近年来,随着三维标测系统的发展,消融治疗心律失常对X射线透视的依赖已减少,甚至达到零射线下进行消融[27]。三维标测系统构建了三维心腔结构,可对电极导管所处的空间位置及其运动轨迹进行实时监测,提供最佳心电信号,能标测低电压区、碎裂电位等,寻找到折返的环路,对标测定位、靶点消融具有重要的指导意义[4]。
随着医疗技术的发展,Ebstein畸形的治愈率会越来越高。有研究在国际上独创性地提出Ebstein畸形解剖矫治的新概念,使98%以上Ebstein畸形患者免于人工瓣膜替换,且其手术死亡率极低,患者手术后无需服用抗凝药物,这是治疗Ebstein畸形的重大进展[28]。

