子痫前期患者胎盘组织整合素β1 热休克蛋白70表达水平及临床意义
忽 平 陈丽珍
子痫前期(preeclampsia,PE)是妊娠20周后出现新发高血压、蛋白尿或其他系统损害的母体综合征,可伴或不伴胎儿生长受限、羊水过少等胎儿综合征,病因不明,是围产儿死亡的主要原因之一[1]。整合素β1(integrinβ1,ITGβ-1)是由α和β 2种亚基通过非共价键构成的跨膜受体糖蛋白,是miR-29的靶基因之一,可介导细胞侵袭、滋养层细胞血管生成,参与PE发生[2],但探究ITGB1与PE相关性的报道较少。而既往针对热休克蛋白70(heat shock protein 70,HSP70)的临床报道多见于心血管疾病[3],但有研究[4]指出,PE患者胎盘血氧缺乏,可促进多种细胞因子释放,引起蛋白质变异性损伤,激活热休克反应,此时HSP70作为分子伴侣保护蛋白多肽结构及功能。加之PE的部分诱发因素(如肥胖、血脂异常、胰岛素抵抗等)、病理特征(炎症、氧化应激、内皮细胞损伤等)与心血管疾病相似。因此,基于理论角度,HSP70可能与PE相关。基于此,本研究旨在探究PE患者胎盘组织ITGβ-1蛋白及mRNA、HSP70蛋白及mRNA的表达水平及临床意义,以期为PE的临床诊治提供参考依据。具体报道如下。
1 资料与方法
1.1 一般资料 选取2014年1月至2018年12月在南阳市中心医院接受剖宫产分娩的120例PE孕妇为研究对象。参照《妊娠期高血压疾病诊治指南(2015)》[5]分为轻度子痫前期(mild preeclampsia, mPE)孕妇组(mPE组)、重度子痫前期(severe preeclampsia, sPE)孕妇组(sPE组),每组各60例;另按1∶1∶1比例选取同期在本院分娩的正常孕妇60例设为对照组。sPE组孕周较mPE组短,收缩压、舒张压、尿蛋白水平高于mPE组(P<0.05);但3组研究对象年龄比较,差异无统计学意义(P>0.05)。见表1。本研究通过医院伦理委员会审核通过。

表1 3组研究对象一般临床资料比较
注:与对照组比较,*P<0.05;sPE组与mPE组比较,#P<0.05
1.2 纳入与排除标准 纳入标准:①mPE组和sPE组患者符合《妊娠期高血压疾病诊治指南(2015)》[5]中PE诊断要求;②均为单胎妊娠;③对照组孕妇剖宫产原因为瘢痕子宫、骨盆狭窄、臀位或社会因素;④对照组选取标准为在本院进行规范孕检且检查结果正常,并在本院分娩的孕妇;知晓研究内容并自愿签署知情同意书。排除标准:①慢性高血压;②合并糖尿病等代谢性疾病;③心、肝、肾等重要器官病变;④多胎妊娠。
1.3 方法 ①仪器与试剂:ITGβ-1及HSP70免疫组化试剂盒[ Max VisionTM(即用型快速免疫组化一步法试剂盒)]均购自上海西唐生物科技有限公司;ITGβ-1及HSP70一抗、二抗及二氨基联苯胺(diaminobenzidine,DBA)显色试剂盒购自郑州金赛尔生物科技有限公司;显微镜购自日本Olympus公司;Trizol试剂盒购自美国Invotrogen公司;ITGβ-1、HSP70引物合成均由生工生物工程(上海)股份有限公司完成。荧光定量PCR仪型号为FTC2000(Cananda公司)、试剂盒购自美国Sigma公司。②胎盘组织收集:剖宫产术中胎盘娩出5 min内,于胎盘母体面中央近脐带根部处剪取大小为2 cm×2 cm×1 cm的2块全层胎盘组织,生理盐水漂洗,无菌滤纸吸干,10%中性多聚甲醛溶液固定,室温条件下酒精梯度脱水,过夜后石蜡包埋,并制成3 μm厚蜡块备用。③ITGβ-1、HSP70蛋白表达:采用免疫组化法检测,将胎盘组织蜡块取出置于64℃烤箱过夜,然后浸泡二甲苯浸泡10%分后更换50%二甲苯浸泡5 min脱蜡,梯度酒精水化后蒸馏水冲洗;再将切片浸泡于二胺四乙酸(diamine tetraacetic acid,EDTA)抗原修复液,95~100℃加热10~20 min,而后在20~30 min内冷却至室温,除去磷酸盐缓冲液(phosphate buffered saline,PBS)并滴加50 μL 3%过氧化氢溶液室温孵育,阻断内源性过氧化物酶活性,封闭内源性抗体;滴加50 μL非免疫山羊血清,室温下孵育10 min后滴加兔克隆抗体,室温孵育60 min,加盖湿盒盖再孵育60 min,除去PBS后滴加50 μL Max VisionTM(即用型快速免疫组化一步法试剂盒)试剂,室温孵育15 min;再二氨基联苯胺(diaminobenzidine,DBA)显色,苏木精染色,ddH2O 洗涤终止染色,梯度酒精脱水,中性树胶封固。400倍光学显微镜下观察(以HSP70免疫组化分析为例)。由2位病理科医师采用双盲法阅片,每张切片随机取5个视野,光学显微镜下观察视野内细胞。染色强度分0、1、2、3分,分别对应细胞内无着染色、着色不清、呈均匀一致淡黄色与背景一致;细胞核或细胞浆内可见少量淡黄色颗粒,显色高于背景;细胞核或细胞浆内可见较多深棕色颗粒;细胞核或细胞浆内可见大量棕黄色或棕褐色颗粒。阳性细胞百分率分0、1、2、3分,分别对应无阳性细胞、阳性细胞百分率<25%、阳性细胞率为25%~50%、阳性细胞率>50%。若细胞染色强度、阳性细胞百分率两项乘积为0~3分则为阴性、4~9分为阳性。每张切片5个视野,取均值为最终得分。ITGβ-1蛋白、HSP70蛋白免疫组化步骤一致。观察并记录3组研究对象ITGβ-1蛋白、HSP70蛋白阳性表达率。④ITGβ-1 mRNA、HSP70mRNA:Trizol法提取胎盘组织总核糖核酸(ribonucleic acid,RNA),参照逆转录试剂盒说明书将RNA逆转录反应合成cDNA,再应用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)法检测ITGβ-1表达,PCR反应条件:95℃预变性1 min、95℃变性15 s、60℃退火、延伸1 min,40个循环,记录熔解曲线,扩增产物4℃保存。2-△CT方法计算ITGβ-1 mRNA表达水平。HSP70 mRNA表达检测方法参照ITGβ-1 mRNA,均严格按照试剂盒说明术操作。引物序列见表2。

表2 引物序列

2 结果
2.1 3组研究对象胎盘组织ITGβ-1的免疫组化比较 ITGβ-1蛋白定位于细胞膜及细胞质,mPE、sPE胎盘组织均可见棕黄色颗粒,且染色强度高于背景非特异性着色,对照组则不显著。见图1。
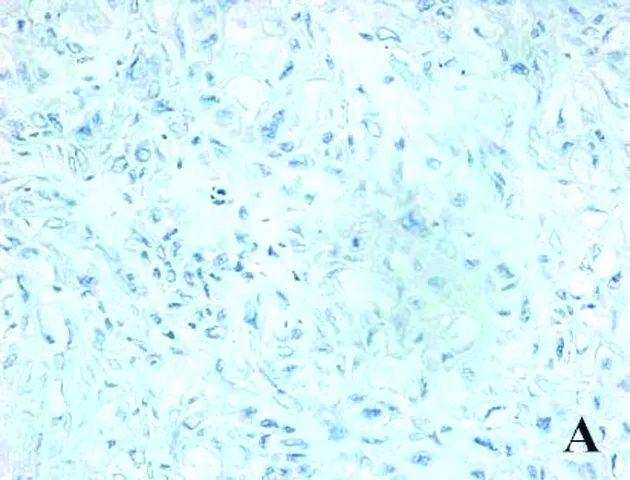
图1 3组研究对象胎盘组织ITGβ-1表达(HE染色,×400)
注:A为对照组,B为mPE组,C为sPE
2.2 3组研究对象胎盘组织中HSP70免疫组化结果比较 HSP70蛋白定位于合体滋养细胞胞浆,正胎盘组织主要表达于细胞胞浆,阳性颗粒成其浅黄色;mPE患者胎盘组织中HSP70蛋白分布与轻度相同,阳性颗粒明显增多,染色程度更深;而sPE患者的胎盘组织HSP70不仅表达于细胞胞浆,部分还覆盖于细胞核,染色程度呈深棕色。见图2。
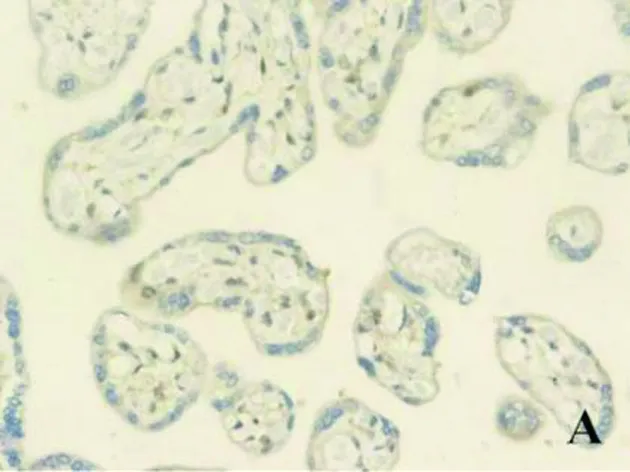
图2 3组研究对象胎盘组织中HSP70表达(HE染色,×400)
注:A为对照组,B为mPE组,C为sPE
2.3 3组研究对象胎盘组织中ITGβ-1、HSP70阳性表达率比较 3组研究对象胎盘组织中ITGβ-1、HSP70阳性表达差异有统计学意义(P<0.05),mPE组、sPE组ITGβ-1阳性、HSP70阳性表达率高于对照组,差异有统计学意义(P<0.05),但mPE、sPE组ITGβ-1、HSP70阳性表达率比较差异无统计学意义(P>0.05)。见表3。
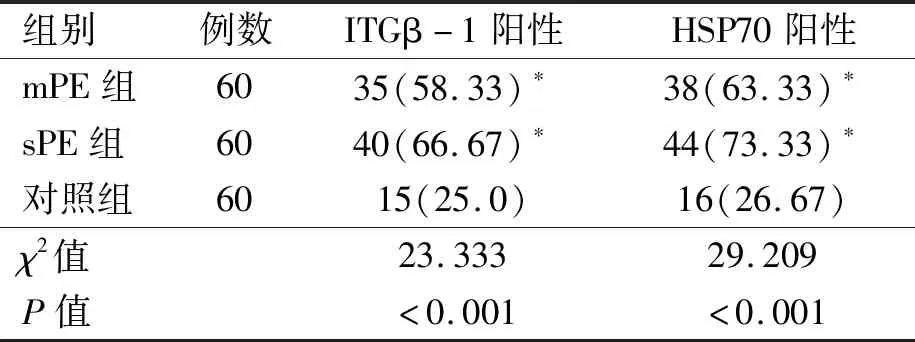
表3 3组研究对象胎盘组织中ITGβ-1、HSP70阳性表达率比较[例(%)]
注:与对照组比较,*P<0.05
2.4 3组研究对象胎盘组织中ITGβ-1 mRNA、HSP70 mRNA表达水平比较 3组研究对象胎盘组织中ITGβ-1 mRNA、HSP70 mRNA表达水平差异有统计学意义(P<0.05);mPE组、sPE组ITGβ-1 mRNA、HSP70 mRNA高于对照组,且sPE组ITGβ-1 mRNA、HSP70 mRNA高于mPE组,差异有统计学意义(P<0.05)。见表4。
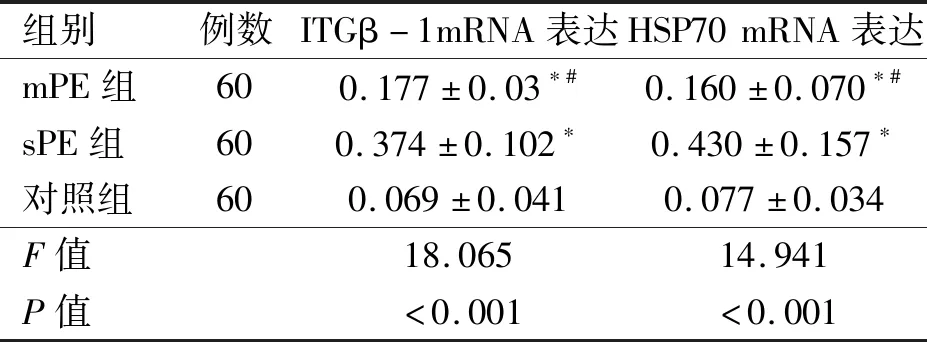
表4 3组研究对象胎盘组织中ITGβ-1 mRNA、HSP70 mRNA表达水平比较
注:与对照组比较,*P<0.05;与sPE组比较,#P<0.05
2.5 ITGβ-1 mRNA、HSP70 mRNA与临床症状的相关性分析 Pearson相关性分析显示,ITGβ-1 mRNA、HSP70 mRNA与PE患者收缩压、舒张压、尿蛋白水平均呈正相关关系(P<0.05),且ITGβ-1 mRNA与HSP70 mRNA正相关(r=0.757,P<0.05)。见表5、图3。
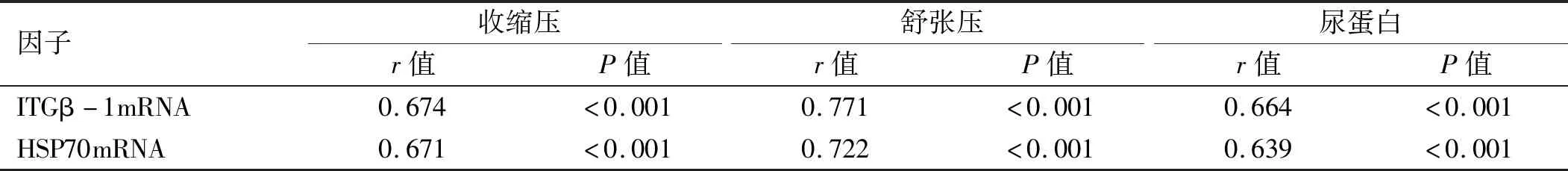
表5 ITGβ-1 mRNA、HSP70 mRNA表达与临床症状的相关性分析(n=120)

图3 ITGβ-1 mRNA、HSP70 mRNA与临床症状的相关性分析
注:A为ITGβ-1 mRNA与临床症状相关性分析散点图;B为HSP70 mRNA与临床症状相关性分析散点图;C为ITGβ-1 mRNA与HSP70 mRNA相关性分析散点图
3 讨论
PE作为妊娠期特有疾病,其病因至今尚未能明确,且亦无明确的预防措施。ITGβ-1作为异二聚体跨膜蛋白,既往研究[6]证实其生物学作用与肿瘤疾病分化、浸润、淋巴结转移密切相关,作为肿瘤疾病诊断及预后评估治疗亦取得满意进展。随着临床研究的愈渐深入,有针对PE发病机制的研究指出,miR-29b可通过对ITGβ-1的调控诱导子痫发生[7]。莫玉俏等[8]报道,miR-29可通过对TGB1表达的调控作用参与PE发生。而李小叶等[9]虽报道PE患者胎盘组织中ITGβ-1表达显著高于正常孕妇,认为ITGβ-1可介导细胞凋亡、侵袭及滋养层细胞血管生成,与PE发生、临床症状密切相关,但该研究处于初级阶段,未分析ITGβ-1在不同严重程度的PE患者胎盘组织中的表达情况。
而HSP70则是具多种功能的非特异性保护蛋白,且在进化上有高度保守性,在正常情况下呈基础表达,水平较低;而对PE患者,受在发病期间受线粒体氧化应激、硝化应激、抗氧化剂水平降低等作用影响,线粒体HSP70可呈反应性上升现象,且较HSP27、HSP60,HSP70与外界刺激变化的相关性最为显著[10]。基于当前研究PE患者胎盘组织ITGβ-1、HSP70表达水平及临床意义类报道相对鲜见,加之基因翻译表达蛋白质过程复杂,基因翻译表达蛋白质过程复杂,因此,本研究在分析PE患者ITGβ-1、HSP70蛋白表达基础上也对其mRNA进行分析。
本研究结果显示mPE组、sPE组ITGβ-1蛋白、HSP70蛋白阳性表达及ITGβ-1 mRNA、HSP70mRNA表达水平显著高于对照组,sPE组ITGβ-1 mRNA、HSP70mRNA表达显著高于mPE组,且ITGβ-1 mRNA、HSP70mRNA表达与PE患者收缩压、舒张压、尿蛋白水平均呈正相关关系。提示PE患者胎盘组织ITGβ-1蛋白、HSP70蛋白及mRNA存在高表达相关,并与临床症状密切相关。这与李小叶等、朱锦明等[11]的报道结论相似。分析PE患者胎盘组织ITGβ-1蛋白、ITGβ-1mRNA高表达的原因,笔者认为除却miR-29b可通过对ITGβ-1的调控诱导子痫发生外,既往有报道指出,miR-155也可调控PE滋养层炎症细胞IL-1β、IL-6、肿瘤坏死因子-α(TNF-α)表达,加剧PE炎症反应[12],这也意味着ITGβ-1不仅可受miR-29调控,亦受miR-155调控[13-14]。同时,朱锦明等[15]则不仅报道PE患者胎盘组织中HSP70表达水平明显升高,且在血清、脐血中呈相同趋势。究其原因,分析或因PE患者在炎症、缺氧等应激状态影响下,HSP70表达应激性上调,发挥内源性保护机制以对抗炎症反应及缺氧损伤有关,这在林培红等[16]的报道中也得到证实。同时,本研究还显示,PE患者胎盘组织HSP70 mRNA与ITGβ-1 mRNA表达同样存在显著正相关关系,分析或因HSP70 与ITGβ-1均在一定程度上受miR-29、miR-155调控有关[17-18],但其具体机制仍有待后期研究进一步明确,尤其是ITGβ-1与HSP70在PE发病过程中是否有协同作用。
综上所述,ITGβ-1、HSP70在PE患者胎盘组织中高表达,并与临床症状密切相关,值得临床重视。但本研究也存在一定局限性,除却样本量相对少外,亦存在一定混杂因素影响。ITGβ-1、HSP70与PE的相关性及其在PE发病过程中的具体机制、是否存在协同作用等仍有极大深入探究空间。

