性类固醇激素对黄颡鱼雌雄生长二态性的影响
王凌宇 齐飘飘 陈 敏 袁勇超 沈志刚 樊启学
(华中农业大学水产学院, 农业部淡水生物繁育重点实验室, 池塘健康养殖湖北省工程实验室, 武汉 430070)
黄颡鱼(Tachysurus fulvidraco)隶属于鲶形目、鲿科, 广泛分布于长江、黄河、珠江及黑龙江等水域, 是我国常见的中小型养殖经济鱼类。黄颡鱼因其肉质鲜美, 无肌间刺, 营养价值高而一直深受消费者喜爱, 黄颡鱼平均含肉率为67.53%, 蛋白含量为15.37%, 必需氨基酸与非必需氨基酸比值高于常见的经济鱼类, 必需氨基酸指数(EAAI)为74.34[1],其中黄颡鱼EAA/TAA为38%, EAA/NEAA为60%,均符合FAO/WHO优质蛋白的理想模型[2]。近年来,黄颡鱼养殖面积增长较快, 养殖产量已从2013年的5.48万吨增长至2017年的48万吨(中国渔业统计年鉴, 2018), 根据联合国粮农组织统计, 2016年黄颡鱼全世界总产值9.9亿美元, 居全世界淡水鱼产值排名第32位(FAO)。在相同养殖环境下, 雄鱼生长显著快于雌鱼。在本实验中发现, 养殖150d后, 对照组雄鱼生长比雌鱼快120%。为了提高养殖经济效益, 刘汉勤等[3]利用激素性逆转结合雌核发育技术,获得YY超雄黄颡鱼, 其后代雄鱼占比约为90%。Dan等[4]随后开发出黄颡鱼雌雄特异性分子标记,可快速鉴定黄颡鱼遗传型性别(区分XX、XY和YY), 为黄颡鱼的育种和科研提供了很好的工具。
雌雄生长二态性(Sexual Size Dimorphism,SSD)指在种群或较大群体中雌雄个体生长存在显著差异的现象[5], SSD是由自然选择与性别选择相互作用的结果[6,7], 雄性个体较大的种群中, 雄性间精子和个体间的竞争更加激烈, 大个体雄鱼能够更好地占据繁殖领地和觅食, 进而继续促进自身生长;而在雌性较大个体中, 雌性的繁殖力和繁殖成功率都与体型成正相关, 同时雄性为了提高自身存活率会减少觅食活动, 从而避免被捕食的风险[8,9]。在哺乳动物[10]和鸟类中[11]发现, 大部分雄性比雌性生长更快。在爬行动物中, 既存在雌性生长快于雄性,亦存在雄性快于雌性的现象[12]。而在鱼类中, SSD同样表现出雌性大于雄性和雄性大于雌性的现象,如: 半滑舌鳎(Cynoglossus semilaevisGünther)、牙鲆(Paralichthys olivaceus)、金钱鱼(Scatophagus argus)等均表现出雌鱼大于雄鱼现象; 尼罗罗非鱼(Oreochromis niloticus)雄鱼的生长速度比雌鱼大约快40%[13], 黄颡鱼也表现出雄性大于雌性现象[3,14]。
性类固醇激素在雌雄生长二态性上扮演着重要角色, 因为这种生长差异在动物性别分化后的性腺发育阶段开始逐渐突显。性类固醇激素主要是由性腺合成和分泌[12], 所以, 我们推测雌雄生长二态性与性腺发育相关, 而性激素主要由性腺分泌,所以雌雄生长二态性可能与性类固醇激素的差异性相关。许多研究发现, 雄激素可以通过调节GH的分泌, 改变GH诱导的IGF-1分泌水平[15], 控制下丘脑GHRH表达水平[16]等途径来调控生长。在爬行动物尤其是蜥蜴中, 性激素对雌雄生长影响的研究更加广泛。在雄性个体较大种群中, 睾酮(Testosterone, T)能够促进雄性亚罗刺蜥蜴(Sceloporus jarrovii)和褐脚蜥蜴(Anolis sagrei)的生长[12,17],而在雌性个体较大种群中, T则抑制雄性东栏蜥蜴(Scelopours undulatus)的生长。在硬骨鱼类中, 许多研究发现雄激素能够促进IGF-1的分泌, 如17α-甲基睾丸酮(17α-Methyltestosterone, MT)处理罗非鱼时发现, 血液中IGF-1升高, 但对GH无影响。在鲑科鱼类中, 雄激素T提高肝脏组织和肌肉对GH的敏感性, 从而促进IGF-1分泌量[18]。雌激素(Estrogen)是一种由内分泌系统产生的多效性类固醇激素, 与动物的生长与繁殖等生命活动密切相关。雌激素通过与特异性受体(Estrogen receptor, ER)相结合进而调节一系列基因的表达, 影响生殖系统周期变化、生殖器官的发育, 脑组织内分泌、骨骼生长[19]。雌二醇(17β-Estradiol, E2)能够促进未成熟虹鳟(Oncorhynchus mykiss) GH的分泌, 提高血液中GH浓度。E2能增加黄金鲈(Perca flavescens) GH的分泌和摄食量[20,21]。摘除卵巢后的小鼠表现出明显的摄食增加, 用E2注射治疗后摄食降低, 说明E2能够降低小鼠摄食[22], 敲除雌雄小鼠ERα受体后, 雌雄鼠摄食略微增加, 能量支出减少, 从而表现出体重的增加[23]。这些研究表明, 性类固醇激素可能通过改变雌性与雄性对能量的摄入与分配, 从而影响雌雄生长的差异性。
性类固醇激素能够影响鱼类生长, 但其中具体的机理以及对雌雄鱼影响的差异性并不清楚。为了研究性类固醇激素在雌雄生长二态性中的作用,我们分别比较了雄激素和雌激素对黄颡鱼雌雄鱼生长、摄食、性腺发育及能量分配的影响。
1 材料与方法
1.1 实验材料与实验鱼养殖
实验用黄颡鱼来自湖北省荆州市, 选取规格大体一致、无损伤、体质健壮的普通黄颡鱼, 初始体重为(5.75±0.20) g, 通过前期预实验, 该阶段雌雄生长无显著性差异(P>0.05)。实验鱼在华中农业大学水产学院养殖基地流水养殖系统中暂养一个月, 饥饿48h后进行正式实验。实验设计了17α-Methyltestosterone (MT)、17β-Estradiol (E2)、对照3个实验组, 每个实验组设计三个平行, 每个平行50尾鱼,实验缸随机分配, 实验温度为(23±2.0)℃, 溶氧为(6.0±0.5) mg/L。在实验期间, 每日定时进行表观饱食投喂, 时间为每天9:00和18:00。未吃完残饵回收, 40℃烘干后称重, 记录每个实验缸每天吃食量。投喂前后2h内, 不进行任何操作, 避免惊扰, 摄食2h后, 用虹吸法移出排泄物。实验养殖阶段持续150d, 分别在0、30d、90d、150d设置取样点, 每次取样前, 实验鱼饥饿24h后进行取样处理。
实验饲料为黄颡鱼专用浮性饲料(粗蛋白含量42%), 将性类固醇激素溶于乙醇中, 与饲料均匀混合后, 浓度为5 mg药物每千克饲料, 对照组不添加药物直接与乙醇混合, 每100 g饲料拌20—40 mL 95%乙醇。通风厨中过夜晾干, 使酒精充分挥发。储存于4℃冰箱待用。
1.2 试验样品的采集
在30d和150d两个取样时间点, 以MS-222麻醉实验鱼后, 称取每尾鱼体重,量取每尾鱼体长, 取每尾鱼背鳍鳍条一小块保存于95%乙醇中, 并解剖6尾鱼(雌雄各3尾), 取血后保存于肝素钠润洗过的离心管, 随后5000 r/min离心1min, 取上清液保存至-80℃。记录肝脏重、性腺重、肠系膜脂肪重量后, 取部分性腺组织保存于Boun’s液, 肝脏、剩余性腺组织保存至-80℃。第0和第90天两个取样时间点, 只进行体重、体长测量和鳍条的保存。
1.3 性别鉴定
采用康为世纪通用型柱式基因组试剂盒提取鳍条DNA, 采用Dan等[4,24]开发的黄颡鱼性别特异性分子标记: XY1-F 5′-GATTGTAGAAGCCAT CTCCTTAGCGTA-3′; XY1-R 5′-CATGTAGATCA CTGTACAATCCCTG-3′, 来鉴定每尾鱼的遗传型性别。PCR反应体系为20 μL: 上下游引物各0.5 μL;模板DNA 1.0 μL; 2×TaqPCR Master Mix 10 μL(康为世纪); ddH2O 8.0 μL。反应条件为: 95℃预变性3min, 95℃变性30s, 60℃退火30s, 72℃延伸30s,34个循环; 72℃下彻底延伸10min。扩增完成后, 取PCR产物3 μL, 以DL2000 Marker作为参照, 以1.5%浓度的琼脂糖凝胶电泳检测。
1.4 组织学观察
性腺组织学样品经脱水、透明、石蜡包埋后,常规切片, 厚度5—6 μm, 苏木精伊红染色(HE染色), 中性树胶封片。组织切片在光学显微镜下用成像系统进行检查和拍照(Olympus DP73, Japan)。显微镜下观察、拍照。
1.5 组织能量检测
取保存于-80℃的性腺、肝脏、躯壳组织, 放入60℃烘箱中干燥至体重恒定, 记录干重, 干重不足1.00 g的组织添加标准品至1.00 g后进行后续操作。置于研磨机(Retsch MM400)中研磨粉碎; 使用Parr6100型氧弹热量仪(Calorimeter Parr6100, Parr Instrument Company, Moline, IL, USA)测定每个组织样本的能量密度(Energy Density, ED)[25]。
1.6 数据分析
实验数据(除能量外)采用SPSS软件(Version 20.0)用单因素方差分析(One-way ANOVA)进行差异显著性检验, 方差分析前进行数据正态性和方差齐性检验, 如不符合方差分析的条件, 将数据进行对数或正弦转换。用Duncan’s多重比较来确定组间差异的显著性,P<0.05时视为显著性差异。
2 结果
2.1 性别鉴定
黄颡鱼性别特异性分子标记的应用使得我们在所有取样点都清楚每尾鱼的雌雄, 并将每尾鱼的雌雄与体重数据一一对应。雄鱼基因型为XY, 雌鱼基因型为XX, 该性染色体标记引物以黄颡鱼雄鱼基因组为模版能够扩增出两段不同大小的片段(X-片段: 955 bp, Y-片段: 826 bp), 以黄颡鱼雌鱼基因组为模版能够扩增出一段955 bp的片段。琼脂糖凝胶电泳检验结果显示扩增出955和826 bp两条带的为雄鱼, 只有一条955 bp带的为雌鱼。
最后一次取样时将所有黄颡鱼解剖获得表型性别与采用性别特异性分子标记鉴定得到的遗传型性别是100%一致的, 说明在两种激素浓度下, 从本实验规格的黄颡鱼开始养殖150d时激素处理并不会导致性逆转。
解剖性腺观察发现1、3、5、7、8、11、12、13、14、15、18、20、21、22、23、24为雌鱼,2、4、6、9、10、16、17、19为雄鱼, 与图 1所表现的基因型完全一致。同时也保证每个取样点每尾鱼性别与体重数据一一对应的准确性。
2.2 性类固醇激素对黄颡鱼摄食与生长的影响
由图 2可知, 雄激素MT能够显著促进黄颡鱼的摄食(P<0.05), 而雌激素E2对黄颡鱼摄食无显著影响(P>0.05)。性类固醇激素能够减小组内个体间的生长差异, 且雄激素组雌雄生长差异显著小于其他两组。MT显著促进黄颡鱼雌鱼的生长(P<0.05), 但抑制雄鱼的生长(P<0.05), E2显著抑制雌雄鱼生长(P<0.05)。
由图 3可知, 在实验进行30d之后, 性类固醇激素均能显著促进黄颡鱼雄鱼的肥满度(CF), 雄激素MT组雌鱼肥满度达到2.06; MT组雌鱼性腺成熟系数(GSI)达到3.92%, 高于对照组雌鱼的2.44%, 但两者间差异不显著(P>0.05), E2同样对雌雄GSI无显著影响; MT、E2组黄颡鱼肝体比均显著大于对照组,E2组肝体比同样显著大于MT组。在150d养殖阶段,MT、E2显著提高黄颡鱼雄鱼肥满度CF, 但对雄鱼的GSI无显著影响(P>0.05), 但MT组雌鱼GSI为1.51%, 显著低于其他组。MT、E2组肝体比显著高于对照组(P<0.05), 且在MT组出现最大值为3.11%。
2.3 性类固醇激素对黄颡鱼性腺发育的影响
根据杨丽冬等[26]的研究, 由图 4可知, MT组精巢发育至Ⅴ期晚期, 此时精巢的精小囊内除了处于边缘的精原细胞外, 也有次级精母细胞, 精子细胞和精子, 精子几乎充满了精小囊(图 4a、图 4b)。E2组精巢发育至Ⅳ期, 精小囊中存在大量次级精母细胞和精子细胞, 出现少量精子(图 4c、图 4d)。对照组精巢发育至Ⅴ期, 精巢内含有精原细胞、次级精母细胞、精子细胞和精子, 精子在精小囊内大量分布(图 4e、图 4f)。
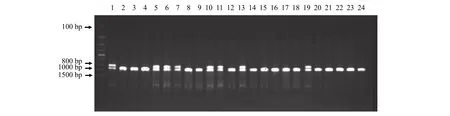
图 1 黄颡鱼雌雄基因型鉴定电泳图(X-955 bp; Y-826 bp)Fig. 1 Genotypic sex identification by using sex-linked markers in yellow catfish (X-955 bp; Y-826 bp)
由图 5可知, MT组卵巢发育至Ⅱ期, 此时卵巢中大部分卵母细胞发育至第Ⅱ时相, 由卵原细胞分化而来, 属于初级卵母细胞的小生长期, 细胞呈圆形或椭圆形, 细胞膜外包围一层滤泡细胞构成的滤泡膜。细胞核位于卵母细胞中央, 核仁分布在细胞核核膜内侧, 核仁数目较多(图 5a、图 5b)。E2组卵巢发育至V期。此时卵巢中大部分卵母细胞发育至第IV末到第V时相阶段, 此时卵母细胞处于生长成熟阶段, 细胞明显增大, 细胞质中卵黄持续积累, 最终充满整个细胞, 大部分细胞已经完成细胞核核极化过程(图 5c、图 5d)。对照组卵巢发育至V期, 大部分卵母细胞发育至第IV末到第V时相阶段, 还有部分发育不同步的Ⅱ时相卵母细胞。视野中大部分细胞完成了卵黄的积累和核极化过程(图 5e、图 5f)。三组综合比较发现, MT显著抑制了雌鱼卵巢的发育, 而雌激素E2对雌鱼性腺发育有促进作用,但这种促进作用不明显。

图 2 性类固醇激素对黄颡鱼摄食与生长的影响Fig. 2 Effects of sex steroid hormones on food intake and growth of yellow catfish
2.4 性类固醇激素对组织能量密度和总能量的影响
由图 6可知, 雄激素能够显著降低黄颡鱼雌雄鱼性腺和肝脏的能量密度, 而雌激素仅降低雄鱼性腺组织密度, 同时增加雌雄鱼肝脏组织密度。MT组雌鱼总能量为125.45 kJ, 高于对照组雌鱼的97.70 kJ,且其用于躯体的能量占93.85%, 同样高于对照组躯体能量占比89.22%; E2组雌雄鱼和MT组雄鱼体内总能量都低于对照组, 虽然在雄鱼中, 各组分配至躯体的总能量占比大体一致, 但由于总能量的差异,所以分配到躯体生长的总能量依旧有很大差异。从性腺和肝脏组织的能量分配来看, MT降低了雌鱼在卵巢中的分配, 增加了肝脏中能量分配, 而E2将更多能量分配到肝脏, 对性腺组织能量分配影响不大。
3 讨论
在鱼类中, 雌雄生长二态性表现出普遍性和多样性, 既存在雄性大于雌性, 或雌性大于雄性现象,也存在成熟前无差异, 成熟后两性差异开始展现的情况, 研究人员推测这种差异主要来自性腺发育及性别分化引起的激素水平的不同以及其引起的一系列雌雄生理上的差异。许多研究表明雄性个体较大种群中, 雄性为了生存和获得交配权, 雄性间竞争、觅食、保护繁殖地等活动更加激烈[27]; 而在雌性个体较大种群中, 雌鱼的繁殖力占主导地位,雄鱼减少觅食等活动来提高自身存活率。黄颡鱼在自然界或养殖水体中均表现出显著的性别差异,1龄时雄鱼体重超过雌本体重一倍。前期预实验发现, 黄颡鱼雌雄生长差异出现在10 g以内, 因此实验选用雌雄生长还未表现显著差异的黄颡鱼幼鱼(平均体重6.18 g), 进行了性类固醇激素MT、E2对黄颡鱼生长二态性影响的研究。研究发现, MT组黄颡鱼生长较对照组无显著影响, 相反, E2表现出对黄颡鱼生长的显著抑制作用, 进一步分析雌雄生长差异发现, MT和E2对雄鱼表现出显著抑制作用(P<0.05), MT能够显著促进雌鱼的生长(P<0.05)。这结果显然与实际水体中所表现出雄性生长显著快于雌性的现象截然相反, 马文阁[24]指出黄颡鱼两性生长异形可能是因为雌雄个体之间性激素调节的GH/IGF信号表达差异引起的。
许多研究表明, 性类固醇激素能够通过多种方式影响生物的生长。在哺乳动物和鸟类中, 普遍认为雄激素作为一种合成代谢类固醇能够促进肌肉和骨骼的生长, 有趣的是, 一些研究发现在鸟类和哺乳动物中依旧存在一些非典型的雌性较大的物种, 此时雄激素则表现出抑制生长的作用[28]。John-Alder等[29]提出“雄激素双向调节假说”, 即SSD的进化演变方向与雄激素对雄性生长的影响有关, 雄激素对雄性生长表现出双重调节, 在雄性个体较大种群中, 表现促进作用, 反之则抑制雄性生长。但随后的一些研究发现, 在雄性较大种群中, 性腺的摘除和/或雄激素替代并没有对雄性生长产生任何影响[30]。在本实验中, MT却显著抑制了黄颡鱼雄性的生长, 促进雌鱼生长, 且马文阁[24]用MT处理黄颡鱼发现, MT抑制雄鱼GH/IGF轴相关基因的表达,但促进雌鱼GH/IGF轴相关基因的表达, 这个结果可以一定程度上解释了本实验中MT对雄鱼生长的抑制以及对雌鱼生长的促进作用的原因。在雄性个体较大种群中, Riley等[31]发现E2能够降低雄性罗非鱼肝脏IGF-1 mRNA表达和血液中IGF-1浓度。雌激素还能够通过受体表达和信息传递水平来调控GH[32], 马细兰等[33]发现罗非鱼雄鱼垂体中GHmRNA和肝脏中GHRmRNA表达水平均显著高于雌鱼。在雌性个体较大的种群中, 雄激素抑制黄金鲈生长, 而雌激素促进生长, 进一步研究发现雌激素能够促进黄金鲈GH的分泌[20], 在金鱼中同样发现E2促进垂体GH激素含量, 但不会影响GHmRNA表达量[34]。这些结果表明, 雌激素或雄激素对鱼类两性生长差异的影响, 在进化方面与鱼类雄性生长快抑或是雌性生长快有直接关系, 从生理方面不仅与鱼类性别发育相关, 还涉及GH/IGF轴的相关通路。
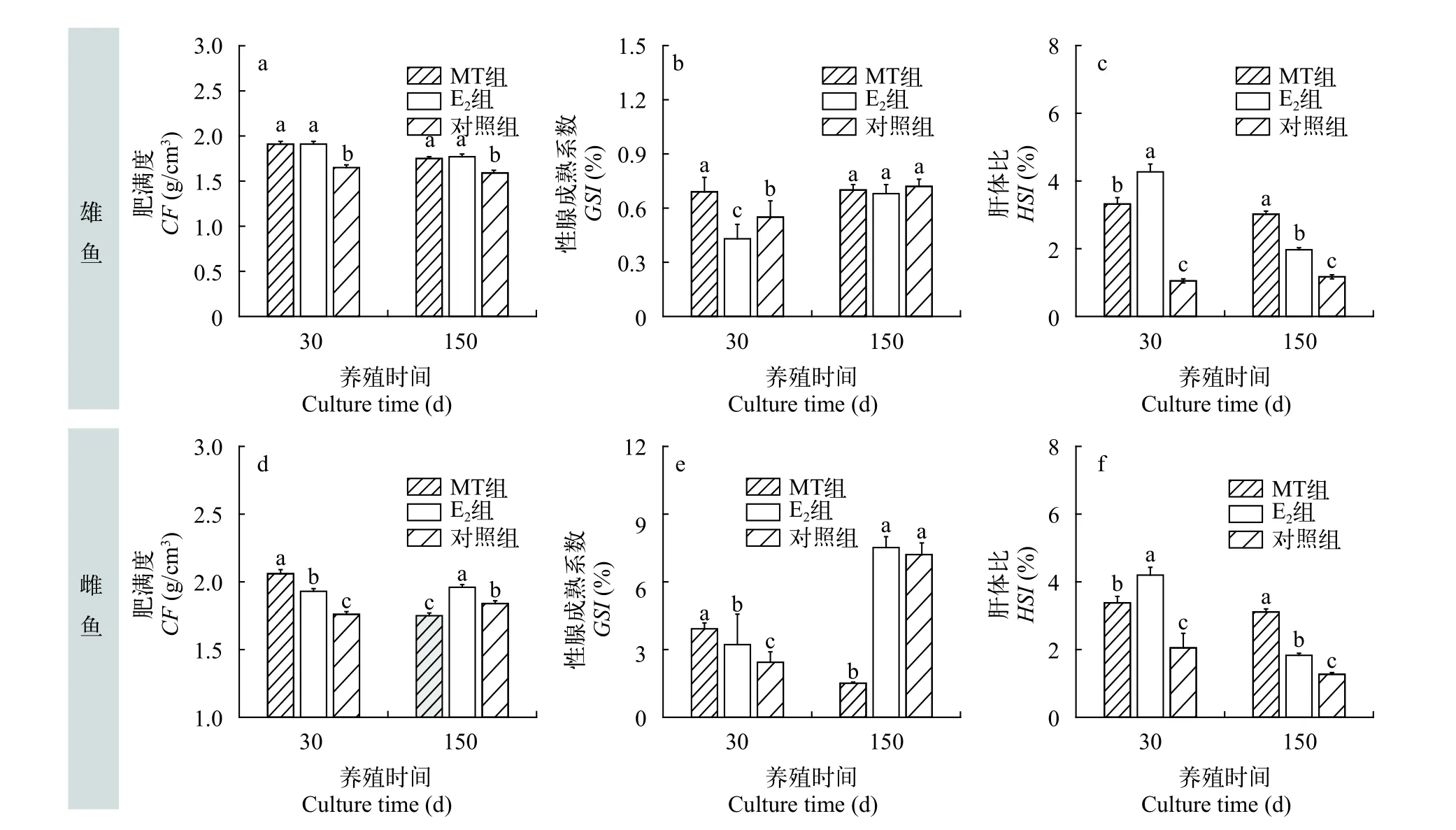
图 3 性类固醇激素对黄颡鱼肥满度、性腺成熟系数及肝体比的影响Fig. 3 Effects of sex steroid hormones on CF, GSI, HSI of yellow catfish

图 4 黄颡鱼精巢组织学结构Fig. 4 Testis histological structure of yellow catfish
生物两性间生长差异主要集中在能量的获取和分配上, 如: 鱼[35,36]、昆虫[37]。摄食是鱼类获取能量和营养的主要或唯一途径, 为个体存活、生长、发育和繁殖提供物质和能量基础。雄激素能通过影响摄食率调控生物生长。在雄性个体较大的种群中, 雌、雄激素能促进罗非鱼摄食量以及促摄食基因的表达(Ghrelin, NPY), 但对脂肪酶、蛋白酶影响不明显[19,38]。而在雌性个体较大种群中, 黄金鲈雄性为了提高自身存活率, 通过减少觅食行为降低能量的摄取[39], 雌激素能够促进雌雄鱼摄食,且这种促进作用在雌鱼更加明显[21]。雄激素通过抑制欧洲鲈摄食量和饵料效率来抑制生长。黄颡鱼为多次产卵类型的鱼类, 多次产卵策略者的生殖投入以外源性投入为主, 主要来源于饵料摄食[40]。本实验发现MT组摄食量显著高于E2组和对照组,表明MT能够显著促进黄颡鱼摄食, E2对黄颡鱼摄食无影响。从总能量获取角度观察发现, MT可能通过提高摄食量和消化率促进了雌鱼的能量获取,对雄鱼则是抑制作用。E2对雌鱼无影响, 却抑制雄鱼能量获取。

图 5 黄颡鱼卵巢组织学结构Fig. 5 Ovary histological structure of yellow catfish
在鱼类生活史中, 研究普遍认为获得的总能量主要分配到内环境稳态保持, 活动, 生长, 储存及繁殖中[41]。在早期生活史中, 鱼类的主要能量会用于体生长, 从而降低与体型大小有关的死亡率[42], 随后能量用于生长和性腺发育。为了解释雌雄生长差异的原因, 关于“生殖成本”的假说被广泛接受,该假说认为在雄性较大种群中, 雌性分配更多的能量在性腺发育和生殖中, 而在雌性较大种群中, 雄性则消耗更多的能量进行斗争、防御等活动来获得交配权。Bonnet等[43]同样认为两性间生殖投入的差异是雌雄个体差异的主要原因, 而生殖投入的差异则受到性类固醇激素的影响[17]。在雄性个体较大的种群中, Kubička等[44]发现雌性眼镜蛇投入更多的能量在生殖中, 而雄性则不需要承担太多与生殖有关的能量消耗, 而在亚罗刺蜥蜴中, T(睾酮,Testosterone)会增加雄性活动量和保护性斗争, 从而增加能量代谢支出[45,46]。在雌性个体较大的种群中, T增加雄性东方强棱蜥和山刺蜥蜴日常活动时间和活动范围, 将更多的能量分配到活动上, 进而抑制雄性生长[47]。在小型鸟类中, 静息代谢和保持体温恒定消耗的能量占日总消耗的70%, 其余30%用于正常活动。在灰蓝灯草雀中, T能够促进雄性觅食、发声等活动, 同时降低睡眠时间, 但最终不会影响日能量消耗和体重差异[48]。肝脏是鱼类重要的能量代谢器官, 是GH/IGFs相关基因表达以及卵黄蛋白原(Vitellogenin, VTG)合成的重要场所[49]。胡青[50]发现E2能够促进肝脏中VTG的合成,还可以通过抑制肝脏GH/IGFs相关通路将能量更多的分配至性腺发育。在本实验中, E2组雌鱼在30d时肝体比HSI为4.2%, 在150d时降为1.83%, 而性腺成熟系数GSI由3.22%上升到7.52%, 说明在卵巢发育前期, E2显著促进了能量在肝脏中的储存, 为后面合成VTG储备能量物质, 当卵巢发育至Ⅲ-Ⅴ期阶段, 肝脏开始大量合成VTG, 肝脏能量逐渐向卵巢转移。从能量角度分析发现, MT组雄鱼和E2组雌鱼在肝脏上分配能量显著高于对照组雄鱼,这种能量分配方式或许是MT对雄鱼和E2对雌鱼生长抑制的原因之一。

图 6 性类固醇激素对黄颡鱼能量分配的影响Fig. 6 Effects of sex steroid hormones on energy allocation in yellow catfish
综上所述, 本研究通过黄颡鱼生长指标、组织学、能量等角度, 初步阐明了雌雄激素对黄颡鱼两性生长差异的影响。研究发现, MT通过促进黄颡鱼雌鱼能量沉积, 提高GH/IGFs轴相关基因表达, 同时减少能量在性腺上的分配水平等途径显著促进雌鱼生长。MT虽然促进了黄颡鱼摄食, 但可能抑制了雄鱼对饵料的消化吸收, 或是增加雄鱼活动量,降低雄鱼体内的能量沉积, 同时抑制雄鱼GH/IGFs相关基因表达, 显著增加肝脏上的能量分配, 减少在躯体中的能力分配, 最终抑制了雄鱼的生长;E2一方面显著增加雌雄鱼在肝脏上的能量分配, 另一方面E2降低了黄颡鱼总能量获取, 同时抑制肝脏GH/IGFs轴基因表达, 最终表现出E2对雌雄生长的抑制现象。但是, 我们的研究结果并不能完全解释性类固醇激素对黄颡鱼两性生长差异性的不同影响, 所以需要进行更深入的研究, 从能量的摄入、分配及消耗三方面来研究雌雄生长的二态性。

