草鱼树突状细胞的分离鉴定及益生芽孢杆菌对其免疫功能的影响
李思思 周成翀 王 欢 许荔立 张诗雨 谢梦琪 陈孝煊 吴志新
(华中农业大学水产学院, 湖北省水生动物病害防控工程技术研究中心, 农业部淡水生物繁育重点实验室, 水产养殖国家级实验教学示范中心, 武汉 430070)
树突状细胞(Dendritic cells, DCs)是已知功能最为强大的抗原递呈细胞(Antigen-presenting cells,APCs), 也是唯一能激活初始T淋巴细胞增殖反应的细胞[1]。树突状细胞是连接固有免疫和适应性免疫的桥梁, 并在控制免疫反应的发生和免疫耐受中发挥重要的作用。树突状细胞通过模式识别受体(Pattern recognition receptors, PRRs)来区分不同的抗原物质并诱导免疫反应的类型[2]。研究表明DCs可通过上调共刺激分子CD83、CD80和促炎性因子IL-12的表达, 诱导Th1免疫细胞的产生[3]。DCs也可通过上调抗炎性因子IL-4和IL-10的表达来诱导Th2免疫细胞的分化[4]。相比于哺乳动物,对鱼类DCs的研究起步较晚。Lugo-Villarino等[5]在斑马鱼(Danio rerio)中发现了一类具有吞噬活性的树突样细胞, 并对其刺激T淋巴细胞增殖的能力进行了分析。Bassity等[6]在虹鳟头肾和脾脏中分离得到一类具有树突样形态, 高表达CD83和MHC-II、可启动混合淋巴反应(Mixed Lymphocyte Reaction,MLR)的细胞。Zoccola等[7]利用SCRIPT为标记, 研究了在尖吻鲈(Lates calcarifer)中DCs的分布并进行了生物学功能的分析鉴定。综合前人的研究, 目前对鱼类DCs的鉴定工作主要围绕形态学特征和生物学功能开展。在鱼类DCs相关研究中, 通常使用混合淋巴反应评价鱼类DCs刺激淋巴细胞增殖的能力, 将同种异体淋巴细胞与DCs共孵育, 通过检测增殖的淋巴细胞的数量反映DCs刺激淋巴细胞增殖的能力。但目前尚未有淡水温水性鱼类中DCs存在的报道。
益生菌是一类对宿主有益的活性微生物, 可定植于宿主肠道等组织中[8]。在哺乳动物中, 多项研究表明益生菌可调节树突状细胞的功能, 从而影响宿主的免疫水平[9—11]。Hart等[12]发现乳酸菌可促进树突状细胞分泌IL-10, 抑制IL-12的表达, 缓解IBD患者的炎症反应。粪球菌等可抑制CD40等细胞因子的表达, 减少成熟的树突状细胞的数量, 避免过度免疫反应的发生[13]。在水产养殖中, 益生菌已被证实可有效促进鱼体的生长, 改善肠道微环
境[14, 15]。
枯草芽孢杆菌Ch9(Bacillus subtilisCh9)是一株分离自草鱼肠道的益生菌, 在本实验室之前的研究中证实使用该菌株可有效减轻嗜水气单胞菌(Aeromonas hydrophila)引起的肠道损伤[16,17]。本研究通过鱼类细胞培养技术分离获得草鱼树突状细胞, 并比较了其与哺乳动物树突状细胞在形态和功能上的区别。这些结果有助于我们更好地理解低等脊椎动物免疫系统, 并为水产动物疫苗的研发提供基础。此外, 通过分析益生芽孢杆菌对树突状细胞免疫功能的调控, 为其在草鱼生态养殖中的应用提供重要的理论依据。
1 材料与方法
1.1 实验材料
实验用草鱼(Ctenopharyngodon idellus, 体重1000—2000 g/尾)来自湖北省武汉市江夏区渔场。实验前2周暂养于华中农业大学水产学院水产养殖教学实验中心循环水系统中。水温控制在24—28℃, 期间按体重的4%投喂商业饲料(湖北海大集团)。每日更换1/3的水并清洁残余的饲料残渣。实验前检查鱼体表无明显伤痕和病原感染症状。
1.2 实验用菌株
嗜水气单胞菌(Aeromonas hydrophila)Ah1菌株:分离自细菌性败血症银鲫肠道, 可引起草鱼、银鲫、团头鲂、鲢等鱼类细菌性败血症和肠炎。将Ah1菌株接种于LB液体培养基, 28℃振荡培养过夜后3500 r/min离心10min, 无菌PBS洗涤两次后重悬至适宜的浓度备用。
枯草芽孢杆菌(Bacillus subtilis)Ch9菌株: 分离自健康草鱼肠道。将Ch9菌株接种于LB液体培养基, 28℃振荡培养过夜后离心收集, 无菌PBS洗涤两次后重悬至适宜的浓度备用。
UV灭活的枯草芽孢杆菌: 按上述步骤获得Ch9菌液, PBS洗涤重悬后紫外照射30min。通过涂布LB平板检测照射后菌液中细菌活性。
上述菌株由华中农业大学水产学院细菌学实验室保存并提供。
1.3 主要试剂的配制
AIM液: 含有47.5 mL L-15培养基, 2.5 mL双抗,2.5 μg/mL两性霉素B和25 μg/mL庆大霉素, 置于4℃备用。
细胞原代培养基: 含有44.5 mL L-15培养基,0.5 mL双抗, 5 mL胎牛血清FBS, 2.5 μg/mL两性霉素B和25 μg/mL庆大霉素, 置于4℃备用。
L-15培养基购自Hyclone公司, 双抗、LPS、两性霉素B和庆大霉素购自Biosharp公司, 胎牛血清FBS购自ScienCell公司, Ficoll分离液购自GE Healthcare公司。
1.4 草鱼树突状细胞的分离培养
选取健康的草鱼, 使用过量MS-222浸泡麻醉致死。在无菌条件下取出脾脏。AIM液中浸泡, 用无菌注射器橡胶塞轻轻按压通过200目(70 μm)细胞筛。获得的单细胞悬液按照2∶1的体积比轻轻铺加在盛有Ficoll分离液的15 mL离心管中。800×g室温离心20min后, 吸取界面层之间的细胞, 无菌PBS洗涤两次, 加入细胞原代基培养重悬并调整密度为5×106cells/mL。转移至25 cm2细胞培养瓶中, 于28℃细胞培养箱中, 隔天吸出原培养瓶里一半的培养基, 离心收集悬浮细胞, 再加入一半新鲜培养基,培养7—10d, 收集非贴壁细胞备用。
1.5 草鱼树突状细胞的富集
使用密度为1.067和1.077 g/mL的Percoll密度分离液, 按照说明书的步骤操作富集上一步收集到的非贴壁细胞。富集后的细胞用无菌PBS洗涤两次,流式细胞仪检测其纯度。
1.6 姬姆萨染色观察
将细胞悬液滴加于玻片上均匀铺开, 自然风干后滴加1—2滴甲醛溶液固定。待自然风干后滴加姬姆萨染色工作, 染色15min, PBS轻轻冲洗, 自然晾干后封片观察。
1.7 树突状细胞生物学功能鉴定
刺激T淋巴细胞增殖能力的测定: 采用混合淋巴反应法来检测草鱼树突状细胞刺激T淋巴细胞增殖的能力。同种异体淋巴细胞的收集根据Bassity等[6]的方法进行。选取体重1000 g左右的健康草鱼, 在无菌条件下取出脾脏, 置于盛有AIM液的培养皿中浸泡1h, 期间用无菌眼科剪将组织切成1 cm3大小的小块, 轻轻按压通过200目(70 μm)的细胞筛,获得的单细胞悬液按照2∶1的体积比轻轻铺加在盛有Ficoll分离液的15 mL离心管中。800×g室温离心20min后, 吸取界面层之间的细胞, 无菌PBS洗涤两次, 加入细胞原代基培养重悬并调整密度为5×106cells/mL。转移至25 cm2细胞培养瓶中, 于28℃细胞培养箱中静置2h, 轻轻晃动培养瓶, 吸取悬浮细胞即得到淋巴细胞。使用CFSE染色液, 按照说明书进行染色。DC和淋巴细胞均调整浓度为1×106cells/mL,按照1∶1、1∶2、1∶4、1∶8的比例分别加入24孔板中。空白对照组中仅加入等量的淋巴细胞。28℃细胞培养箱中孵育3d, 流式细胞仪检测增殖情况。
迁移能力的测定: 使用Transell板测定草鱼树突状细胞的迁移能力。Transewell小室膜直径为3 μm, 小于细胞直径(>10 μm)从而降低被动迁移的影响。上室加入1×106个细胞, 下室分别加入PBS(空白对照)、LPS (5 μg/mL)、嗜水气单胞菌Ah1(MOI分别为0.1和1)、枯草芽孢杆菌Ch9 Muhiplieity of infection (MOI分别为0.1和1)。28℃细胞培养箱中孵育4h, 轻轻刮去上室的细胞, 用0.25%的胰蛋白酶消化膜上的细胞, DAPI染色后, 荧光显微镜计数。
1.8 膜表面标记分子的测定
调整细胞浓度为1×106cells/mL接种于24孔板中, 加入LPS至浓度为5 μg/mL。28℃细胞培养箱中孵育12h, 收集细胞用于检测DCs膜表面标记分子CD83、CD80/86表达情况。
1.9 益生芽孢杆菌和树突状细胞共孵育
调整细胞浓度为1×106cells/mL接种于24孔板中, 按照MOI=100加入UV灭活的枯草芽孢杆菌,28℃细胞培养箱中孵育。分别于0、2h、4h、8h、12h和24h收集细胞, 检测抗炎性因子IL-4、IL-10的表达。
1.10 RNA的提取和cDNA的合成
使用Trizol法提取收集到的细胞样本的总RNA,并用1%琼脂糖凝胶电泳和NanoDrop 2000分光光度计检测其浓度和质量, -80℃冰箱保存备用。cDNA的合成使用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒, 按照说明书的步骤进行反转录获得。
1.11 RT-PCR分析
利用实时荧光定量方法(RT-PCR)检测相关基因的表达情况, 以β-actin基因作为内参基因, 引物序列见表 1。使用LightCycler 480 II荧光定量PCR仪上进行qPCR反应。反应体系为: Master Mix 10 μL, ddH2O 7 μL, 上游引物1 μL, 下游引物1 μL,cDNA 1 μL; 每个样品3个重复。用2-ΔΔCt法计算相对表达量, 结果以平均值±标准差(Mean±SEM)表示。
1.12 数据处理
使用SPSS 18软件进行数据分析处理, 不同处理组之间的比较使用独立样本t检验(Independent samples,t-test), 多组数据间的比较使用Ducan法进行分析,P<0.05表示具有显著性差异。
2 结果
2.1 草鱼树突状细胞分离培养和观察
从草鱼脾脏初始分离的细胞种类比较复杂, 由单核细胞、巨噬细胞、嗜酸性粒细胞、淋巴细胞等组成(图 1A)。在培养过夜后, 部分细胞转为半贴壁状态。在培养的第3天, 可见大的、非黏附的圆形细胞聚集形成集落(图 1B)。在培养7d后, 小而圆的、非黏附细胞基本消失; 体积较大的、非黏附细胞比例上升, 呈现出类似于哺乳动物树突状细胞的分枝状形态(图 1C)。
收集这类非贴壁细胞并使用密度分离法纯化后, 流式细胞分析的结果显示细胞纯度有较大提升,通常可达80%以上。吉姆萨染色结果显示(图 2), 这类细胞具有典型的树突样形态, 不规则的分叶的细胞核, 与哺乳动物树突状细胞的吉姆萨染色结果相比具有高度相似性[18,19]。
2.2 草鱼树突状细胞生物学功能分析
图 3A显示了孵育3d后流式细胞仪检测混合淋巴反应中T细胞增殖的情况。当DC∶淋巴细胞比例为1∶1时, 增殖细胞占比为30.76%; 比例为1∶2时, 增殖细胞占比为20.53%; 比例为1∶4时, 增殖细胞占比为16.28%; 比例为1∶8时, 增殖细胞占比为7.42%。结果表明草鱼树突状细胞可有效启动混合淋巴反应, 刺激T淋巴细胞增殖且具有剂量依赖性。
Transwell实验结果表明(图 3B), 与对照组相比, 树突状细胞在LPS和嗜水气单胞菌的刺激下迁移细胞数量具有显著性差异(P<0.05)。但在枯草芽孢杆菌刺激下的迁移细胞数量差异不显著。这表明草鱼树突状细胞可以有效地向抗原物质迁移, 以便下一步的捕获过程的进行。
2.3 草鱼树突状细胞膜表面标记分子表达的研究
在LPS刺激12h后, 草鱼DCs膜表面标记分子CD83、CD80/86表达显著提升(图 4), 与对照组相比差异显著(P<0.05)。
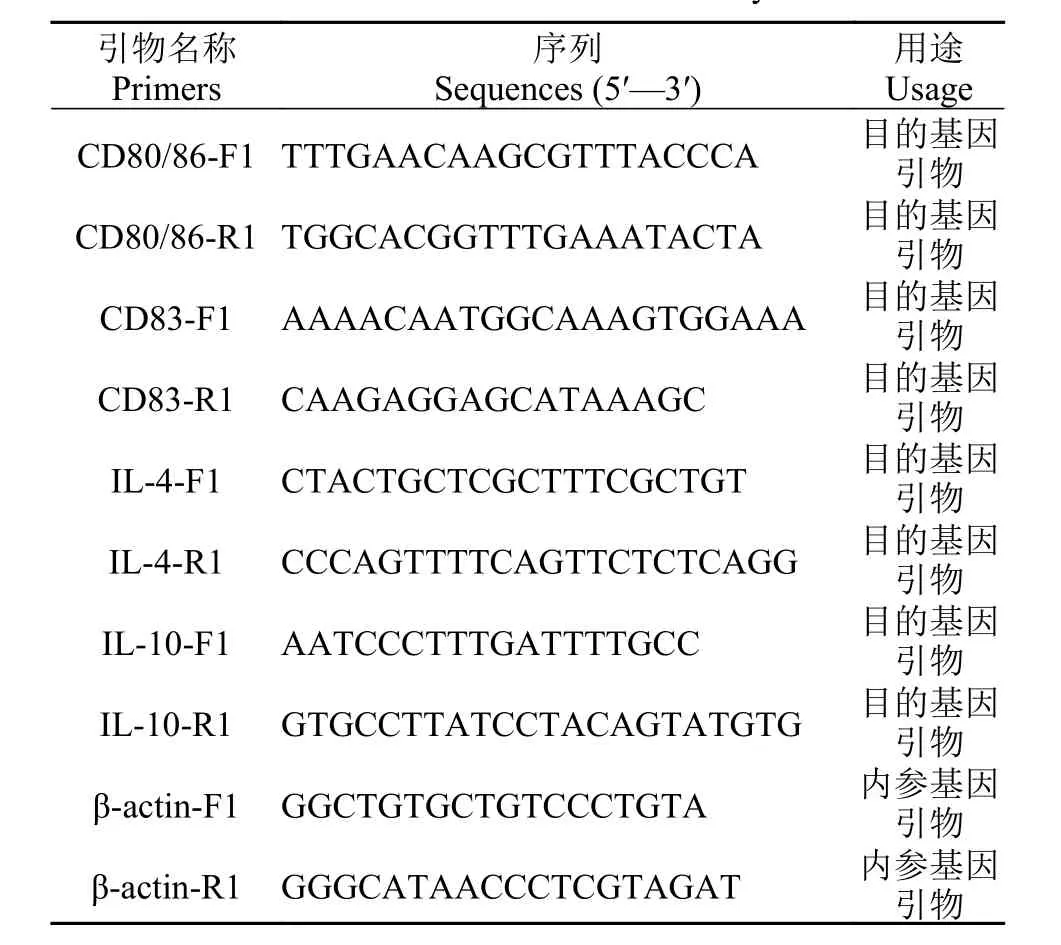
表 1 实验所用引物序列Tab. 1 Primers used in this study
2.4 益生枯草芽孢杆菌对草鱼树突状细胞免疫功能的调控
RT-PCR的结果表明, 益生枯草芽孢杆菌刺激可以有效促进草鱼树突状细胞中抗炎性因子IL-4和IL-10的表达(图 5)。在2—12h期间, 与对照组相比均显著性提升。在24h时IL-4的表达差异不显著,IL-10的表达仍显著性提升。

图 1 不同培养时期草鱼树突状细胞形态观察Fig. 1 Morphological observation of dendritic cells of grass carp at different time points
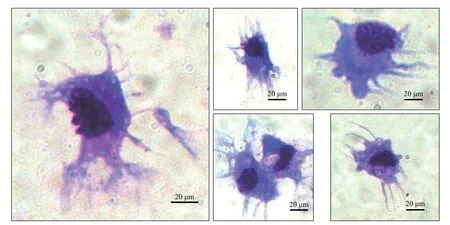
图 2 草鱼树突状细胞的姬姆萨染色图片Fig. 2 Giemsa staining of dendritic cells of grass carp (Bar=20 μm)
3 讨论
在哺乳动物中, 常常从骨髓中获得培养DCs所需的前体细胞[19]。由于鱼类缺乏这类组织, 因此我们对哺乳动物DCs的培养方法进行了修改。建立了从鱼体内重要的免疫器官——脾脏中分离培养DCs的方法。与哺乳动物DCs相比, 培养7d后收集得到的树突状细胞, 在形态、生物学功能和膜表面分子标记的表达上具有高度的相似性。此外, 与虹鳟[6]和斑马鱼[5]DCs相比, 草鱼DCs在应对LPS等抗原刺激时, 与成熟过程相关的膜表面分子CD83、CD80/86的表达更加快速而强烈。这可能是不同物种间的差异所导致。这一结果也为比较不同环境下相近物种免疫功能的差别提供了有益的依据。
在哺乳动物DCs培养中, 常常需要添加细胞生长因子如GM-CSF来促进前体细胞向DCs的分化。在我们前期的实验中, 向培养的DCs前体细胞中加入了重组人GM-CSF, 但与对照组相比, 在DCs产生的数量上并没有显著差异。这一结果与小鼠脾脏中分离细胞并在不添加生长因子情况下获得未成熟DCs的结果相似[20]。对此我们推测草鱼DCs是通过细胞自身分泌的生长因子来诱导分化成熟。
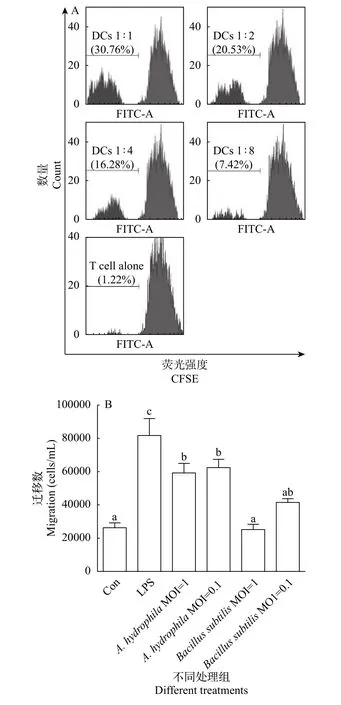
图 3 草鱼树突状细胞功能分析结果Fig. 3 Function analysis of dendritic cells of grass carp

图 4 草鱼树突状细胞膜表面分子表达情况Fig. 4 Relative expression of surface molecular markers on grass carp dendritic cell

图 5 益生枯草芽孢杆菌刺激后草鱼树突状细胞抗炎性因子表达的变化Fig. 5 Expression of anti-inflammatory cytokines in gDCs stimulated by B. subtilis
CD83和CD80/86是哺乳动物成熟DCs的特异性膜表面分子标记物。在哺乳动物中CD80和CD86是两种不同的分子标记物, 但在鱼类中, 普遍认为CD80/86基因与哺乳动物中CD80和CD86基因具有高度的功能保守。在鱼类相关研究中, 有报道称虹鳟的CD83表达与MHC-II的表达也具有相关性[21], 说明鱼类中CD83的表达可能也存在和哺乳动物类似的调节机制。目前多种鱼类中均发现CD83基因的存在, 在巨噬细胞、淋巴细胞中均检测到其表达[22—24]。在哺乳动物中, CD83在mRNA水平的表达不仅仅存在于DCs, 在T细胞、B细胞、单核细胞和巨噬细胞中均有检测到[25—27], 但蛋白表达仅存在于DCs中[28,29]。值得注意的是, mRNA水平的表达并不一定反映产生的蛋白量, 鱼类也可能与哺乳动物一样, 对转录后的翻译过程进行调控, 因此尽管在非DCs的细胞中也检测到CD83的表达, 但CD83依然可以在蛋白水平上作为鱼类DCs的特异性标记物。下一步的研究可以通过草鱼CD83单克隆抗体进行DCs的检测, 对鱼类DCs的生物学特征进行更深入的分析。
细胞因子是免疫系统的组成部分, 在免疫功能的调节中发挥着重要的作用[30,31]。IL-4、IL-10是IL家族的重要成员, 被认为是一类免疫抑制细胞因子, 在炎症反应的调节中发挥着重要的作用[32]。IL-4具有诱导T细胞增殖的能力, 可促进Th2细胞的分化抑制Th1细胞的生成, 发挥抗炎作用[33]。研究表明IL-10可有效抑制Th1细胞的分化以及IL-1、TNF-α等促炎性细胞因子的释放, 促进B、T细胞的增殖, 增强机体体液免疫的水平, 此外还可抑制氧自由基(ROS)的产生, 避免过度免疫反应对机体造成损伤[33—35]。在本研究中, 益生枯草芽孢杆菌可有效促进草鱼树突状细胞IL-4、IL-10的表达, 证实其可通过抑制炎症反应的发生发挥免疫调节作用。
综上所述, 本研究首次从草鱼体内分离培养了一类具有典型树突状形态的细胞, 通过形态学比较、生物学功能分析和膜表面标记分子表达的研究, 证实这类细胞和哺乳动物树突状细胞具有高度同源性。这一结果有助于丰富低等脊椎动物免疫系统组成的研究。此外, 通过检测和益生枯草芽孢杆菌共孵育后DCs的抗炎性因子IL-4、IL-10的mRNA表达情况, 揭示了益生枯草芽孢杆菌对草鱼树突状细胞免疫功能调控的机制, 为其在水产养殖中的应用奠定了理论基础。

