无机三价砷对黄花水龙无菌苗生理生化特性的影响
吕金平 张诗雯 李 涛 赵进东
(1. 中国科学院水生生物研究所, 武汉 430072; 2. 中国科学院大学, 北京 100049)
砷(As)是一种剧毒类金属, 对生物体具有致癌、致突变的效应, 已被世界卫生组织确定为高毒致癌物质。由于其与重金属具有相似的毒性和污染性, 常被列为重金属来研究。我国是世界上砷污染较为严重的国家之一[1], 污染源主要来自于矿石[2]、冶金业废水及含砷化学品等。长期以来, 由于我国工农业的迅猛发展, 含砷矿物及其化合物频繁开采、利用, 导致其以不同形式排放到环境中,并不断积蓄流转, 污染大气、土壤、地下水及河流[3]。砷对植物的毒性效应与砷的价态密切相关,水体中的砷主要以无机砷酸盐和亚砷酸盐形式存在, 对水生植物的毒性较大[4], 其中As (Ⅴ) 通过取代磷酸盐, 主要干扰植物的磷代谢反应, 而As (Ⅲ)的毒性是As (Ⅴ) 的25—60倍[5], 易与蛋白质上的巯基 结合, 影响细胞内相关蛋白质的结构、功能, 进而影响葡萄糖的吸收、糖异生作用以及乙酰辅酶A和谷胱甘肽的生成[6]。黄花水龙(Jussiaea stipu-laceaOhwi)属于柳叶菜科丁香蓼属, 多年生草本植物, 生命力极强, 可较好的吸收富营养水体中氮、磷[7], 且能显著降低水体pH至中性水平, 对维持水生态系统稳定提供保障。目前关于砷对植物污染的研究多涉及农业作物[8—11], 而对于水生植物影响的研究还较缺乏, 本研究选取黄花水龙无菌苗为实验材料, 通过不同浓度As3+处理, 从光合系统、渗透压调节系统、抗氧化系统等方面研究黄花水龙无菌苗对无机三价砷污染的响应, 并进一步探讨砷毒害黄花水龙的机制, 为环境检测中评价黄花水龙受污染程度和进一步研究黄花水龙用于砷污染水体修复的可能性提供理论依据。
1 材料与方法
1.1 材料的预处理
黄花水龙无菌苗培养方法:本实验材料采自广东饶平水库, 选取生长健壮的黄花水龙, 以黄花水龙带腋芽茎段为外植体, 剪取长3.0—5.0 cm的带腋芽茎段, 自来水冲洗1h, 取带侧芽的茎置于经紫外灭菌处理的超净工作台中, 先用75%酒精表面消毒处理10s, 无菌水冲洗5次, 再用0.1%氯化汞消毒5min, 无菌水冲洗3次, 将消毒处理后的黄花水龙茎剪成1.0—1.5 cm长, 辨认形态学上端后, 置于MS培养基(含6-BA 0.05 mg /L, NAA 0.05 mg /L)诱导芽分化, 15d左右茎间侧芽约3 cm长, 转入MS继代培养基(含6-BA 0.25 mg /L, NAA 1.5 mg /L) 继代培养1个月后, 将长势基本一致的黄花水龙无菌苗剪取约5 cm左右长度的茎置于1/10的无菌Hoagland营养液中, 用0.1 mol/L NaOH和0.1 mol/L HCl调节营养液pH至5.5左右, 每3天更换一次培养液, 待其长势良好以备随后实验。整个组培过程在全封闭培养箱进行,培养温度为25℃, 每天光照12h, 光照强度为40 μE/(m2·s)。
1.2 实验设计
依据预试验结果, 待黄花水龙无菌苗长至7—10 cm 时, 选取长势基本一致的植株作为供试植株,置于含0 (对照)、2.5、10、50、250和500 μmol/L NaAsO2(以纯As3+计) 的1/10 Hoagland无菌营养液中, 整个毒害实验都在全封闭培养箱中完成, 条件同培养黄花水龙无菌苗时一致, 胁迫24h, 在相同的时间段内取出黄花水龙无菌苗, 去离子水洗净、揩干, 进行各项生理生化指标测定, 每组设置3个重复。
1.3 实验方法
叶绿素含量的测定参照张宪政[12]的丙酮乙醇浸提法。全程在暗光条件下操作, 紫外-可见分光光度计测量663 和645 nm波长下比色, 并按Amon法计算求得叶绿素a、叶绿素b、叶绿素总含量。
相关生理指标的测定丙二醛(MDA)含量的测定采用硫代巴比妥酸法测定[13]。可溶性蛋白(SP)含量的测定采用考马氏亮蓝G-250法[14], 以牛血清蛋白为标准蛋白, 测定595 nm下的吸光度。可溶性糖(SS)含量的测定采用蒽酮比色法[14]。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性的测定如下: 取材置于预冷研钵中, 加入0.1 mol/L的磷酸缓冲液(pH 7.4), 冰浴研磨, 3500 r/min, 离心10min, 取上清液进行测定。SOD、CAT活性采用一般分光光度法, POD活性采用愈创木酚法。
1.4 统计分析
使用Microsoft Excel和SPSS 23.0进行数据统计和单因素方差分析, 采用Tukey法进行多重比较, 以P<0.05为差异显著,P<0.01为差异极显著相关, 结果以“均值±标准差”表示, 本文图表中的不同小写字母表示数值之间差异显著(P<0.05), 相同字母表示差异不显著(P>0.05)。

图 1 不同As (Ⅲ)浓度黄花水龙无菌苗叶绿素的含量Fig. 1 Chlorophyll contents of Jussiaea stipulacea Ohwi under different concentrations of As (Ⅲ)
2 结果
2.1 As (Ⅲ)对黄花水龙叶绿素含量的影响
叶绿素作为植物光合作用的物质基础, 常作为抗性指标用于评价污染物对植物生长的影响, 揭示叶片光合作用能力和衰老程度[15]。由图 1可知, 在亚砷酸钠胁迫下, 黄花水龙叶绿素a、叶绿素b和叶绿素总量均随砷处理浓度的升高呈先升后降的趋势, 其中黄花水龙叶绿素a含量在处理浓度为2.5 μmol/L时含量较对照组有所升高, 但未达到显著水平, 随后含量逐渐降低, 并在处理浓度为500 μmol/L时含量降至0.691 mg/g, 显著低于对照组。而叶绿素b和叶绿素总量分别在0.64—0.689 mg/g和1.331—1.487 mg/g, 均在低浓度砷(2.5 μmol/L)处理条件下含量显著升高, 分别升高到0.797和1.487 mg/g, 较对照组分别升高11%和7%, 与对照组呈显著差异。而后随着As3+浓度升高, 较对照组含量逐渐降低, 但未达到显著差异水平。
2.2 As (Ⅲ)对黄花水龙丙二醛含量的影响
在植物处于逆境、胁迫、衰老情况下, 其细胞内固有的自由基代谢平衡遭到破坏, 导致细胞质膜中的不饱和脂肪酸过氧化作用加剧, 生成膜脂过氧化产物, 影响植物的光合、呼吸及其他代谢过程。丙二醛(MDA)作为脂质氧化终产物, 具有细胞毒性,能加剧膜损伤, 干扰细胞正常生命活动, 影响植物生长发育, 其含量变化可反映膜系统受损程度以及植物受逆境伤害的程度[16]。如图 2可知, 黄花水龙无菌苗MDA含量范围在2.36—9.83 nmol/g, 且处理组MDA含量均高于对照组, 对照组MDA含量最低, 为2.36 nmol/g, 当As (Ⅲ) 处理组浓度达到500 μmol/L时, MDA含量最高, 为9.83 nmol/g, 显著高于对照组, 在处理浓度低于500 μmol/L时, 各处理组和对照组差异不显著。

图 2 不同As (Ⅲ)浓度黄花水龙无菌苗丙二醛的含量Fig. 2 MDA contents of Jussiaea stipulacea Ohwi under different concentrations of As (Ⅲ)
2.3 As (Ⅲ)对黄花水龙渗透调节物质的影响
可溶性糖植物体内的可溶性糖作为植物细胞渗透压的重要调节物质,其含量可以反映碳水化合物的运转情况和逆境胁迫条件下水生植物生理生态变异情况[17]。图 3结果表明: 随着As (Ⅲ)浓度的升高, 可溶性糖含量呈先降后升的趋势, 具体表现为: 可溶性糖含量在1.17—2.627 mg/g波动, 在As (Ⅲ)浓度为0—50 μmol/L时, 可溶性糖含量均较对照组显著降低, 并在As (Ⅲ)浓度为10 μmol/L时达到最小值, 为1.17 mg/g, 相比于对照组降低52.5%,而后随着As (Ⅲ)浓度升高, 可溶性糖含量升高, 且在浓度为250 μmol/L时含量达到最大值, 为2.627 mg/g。

图 3 不同As (Ⅲ)浓度黄花水龙无菌苗可溶性糖的含量Fig. 3 Soluble sugar contents of Jussiaea stipulacea Ohwi under different concentrations of As (Ⅲ)
可溶性蛋白可溶性蛋白同样作为植物体内重要的渗透性物质, 可以提高植物生理保水能力。研究其含量变化是了解植物生理生化变化的重要途径[18], 由图 4可知, 随着As (Ⅲ)处理浓度的增大, 黄花水龙无菌苗可溶性蛋白质含量范围在4.25—11.09 mg/g, 呈先增后减趋势, 当As (Ⅲ)处理浓度在0—250 μmol/L时, 可溶性蛋白含量逐渐增加, 并在250 μmol/L时达到最大值, 显著高于对照组(P<0.05), 当处理浓度继续增大到500 μmol/L, 可溶性蛋白质含量有所降低。实验结果表明低浓度砷胁迫对黄花水龙可溶性蛋白含量有显著激活功能,从而提高细胞渗透浓度和功能蛋白含量, 维持正常细胞代谢水平。当砷胁迫浓度达到较高水平则对蛋白质有一定破坏作用, 可能是由于高浓度砷进一步造成可溶性蛋白质合成与分解相关酶活性受到影响及机体组织和器官不可逆的损害, 导致植物体内可溶性蛋白和蛋白质的分解运输受到阻碍。
2.4 As (Ⅲ)对黄花水龙抗氧化酶活性的影响
抗氧化酶系统是植物的主要防御酶系统, 可避免或减轻活性氧对植物造成的损害, 超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)是植物细胞膜保护系统组成酶, 被认为是清除活性氧过程中最主要的抗氧化酶, 在因活性氧引发抗氧化胁迫时, 能在生理水平起到防御保护作用并维持氧化代谢平衡[19,20]。
SOD活性SOD活性大小可以直接反应机体清除自由基的能力, 与逆境生长下的植物密切相关。如图 5所示, 黄花水龙无菌苗的SOD活性单位在623.777—747.327 U/g FW, 对照组SOD活性最低,为623.777 U/g FW, 随着As (Ⅲ)处理浓度升高,SOD活性呈先升高后下降的趋势, 且As 10 >As 50 >As 250 >As 2.5 >As 500, 当As (Ⅲ)浓度处于2.5—50 μmol/L, SOD活性显著升高, 体内抗氧化防御系统被激活, 以维持氧化还原平衡,且当处理浓度为10 μmol/L时, SOD活性达到最大值, 为747.327 U/g FW, 是对照组的120%, 显著高于对照组, 而当As(Ⅲ)浓度大于10 μmol/L时, SOD活性持续降低。在高浓度砷条件下黄花水龙无菌苗SOD活性的下降表明, 此时高浓度砷胁迫可能已超出SOD系统发挥正常功能所能承受的浓度上限, 使得SOD防御系统遭到破坏, 活性氧清除能力降低, 导致了黄花水龙无菌苗的毒性效应。
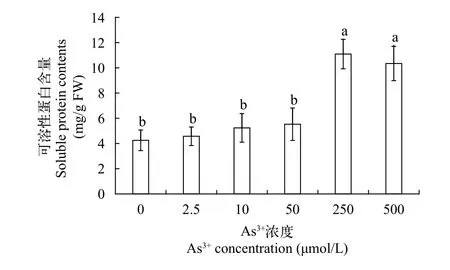
图 4 不同As (Ⅲ)浓度黄花水龙无菌苗可溶性蛋白的含量Fig. 4 Soluble protein contents of Jussiaea stipulacea Ohwi under different concentrations of As (Ⅲ)

图 5 不同As (Ⅲ)浓度黄花水龙无菌苗SOD的活性Fig. 5 SOD activity of Jussiaea stipulacea Ohwi under different concentrations of As (Ⅲ)
POD活性POD是植物抗氧化系统的重要组成部分, 广泛存在于植物、动物和微生物体内,和CAT都可以催化SOD等产生的H2O2与其他底物反应, 将其转化为H2O, 使自由基维持在正常的动态水平, 保护细胞免受有毒过氧化物的损害, 维护细胞膜的正常代谢功能, 提高植株的抗逆性[18]。其活性值在一定程度上反应植物对逆境的耐受能力。根据图 6结果所示: 黄华水龙无菌苗POD活性为51.79—117.53 U/mg prot, 在As (Ⅲ)浓度为0—50 μmol/L时, POD活性在低浓度下不断被激活, 其中当As (Ⅲ)浓度为2.5 μmol/L时, POD活性最高, 达113.06 U/mg prot, 是对照组的119%, 在As (Ⅲ)浓度为250—500 μmol/L时, POD活性呈显著下降趋势,较于对照组, 分别降低了41%和45%, 说明低浓度砷胁迫激发了黄花水龙体内防御机制, 增加了黄花水龙无菌苗的POD活性, 从而较好的应对砷胁迫带来的伤害。而高浓度砷胁迫降低了POD活性。可见,POD对清除活性氧产生, 降低砷胁迫对黄花水龙幼苗的氧化损伤方面发挥着作用。
CAT活性过氧化氢酶是一种含Fe的血红蛋白酶类, 主要存在于细胞的过氧化体中, 也是抗氧化酶系统的重要组成部分, 可以使细胞内过氧化氢维持在正常水平, 从而保护细胞膜结构。结果如图 7所示: 在砷胁迫处理后, 黄花水龙无菌苗CAT活性均高于对照组且呈现先上升后下降的趋势, 在砷浓度为50 μmol/L时活性最高, 与对照相比增加了185%, 显著高于对照组。低浓度的砷对CAT活性有激活效应, 但随着浓度不断升高[As (Ⅲ)≥250 μmol/L时]CAT活性受到抑制, 这表明低浓度砷胁迫下黄花水龙体内产生了过多的过氧化氢, 作为一种防御系统, 通过提高CAT活性以清除过氧化氢,但当浓度超过极限, 过多的过氧化氢会对植物细胞造成损伤, CAT防御系统遭到破坏。
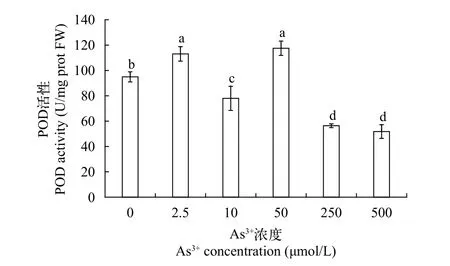
图 6 不同As (Ⅲ)浓度黄花水龙无菌苗POD的活性Fig. 6 POD activity of Jussiaea stipulacea Ohwi under different concentrations of As (Ⅲ)

图 7 不同As (Ⅲ)浓度黄花水龙无菌苗的CAT活性Fig. 7 CAT activity of Jussiaea stipulacea Ohwi under different concentrations of As (Ⅲ)
3 讨论
已有报道砷胁迫对水生植物影响的研究[21,22],多采用野外采集植物作为实验对象, 未进行无菌处理, 实验结果易受干扰因素影响, 本实验采用黄花水龙无菌苗进行砷胁迫下研究, 尽可能排除如微生物、共生植物[23]、植株个体差异及人为作用等外界干扰因素, 确保实验结果较为准确可控。
3.1 对叶绿素含量的影响
类重金属胁迫作为一种逆境, 往往表现出对植物生长“低促高抑”现象。光合作用是植物重要的基础生理活动, 叶绿素是最主要的光合色素, 具有捕获光能, 驱动电子转移到反应中心的功能[24], 叶绿素含量的变化能较好反映植物生长状况及光合作用能力水平, 杨文婕等[25]、赖长鸿等[26]研究均表明: 低浓度砷处理对植物叶绿素含量有促进作用,而过量的砷毒害则导致植物叶绿素含量降低, 薛艳等[17]研究镉和铅对黄花水龙叶绿素含量影响, 结果显示当镉和铅浓度为1 μmol/L时, 叶绿素含量均较对照组显著升高, 随着处理浓度的升高至5 μmol/L以上, 叶绿素含量逐渐降低。本实验结果显示, 低浓度砷处理(2.5 μmol/L)促进了黄花水龙无菌苗的叶绿素b和叶绿素总量的增加, 且显著高于对照组,而叶绿素a含量变化不显著, 随着砷处理浓度不断升高直至500 μmol/L时, 叶绿素b和叶绿素总量有下降的趋势, 但未达到显著差异水平, 而叶绿素a含量下降至显著水平。由于叶绿素的生物合成需要经过一系列的酶促反应, 造成这种现象的原因可能是在低浓度砷胁迫条件下可促进植物对Fe、Mg等元素的吸收, 促进植物合成较多的叶绿素, 而在高浓度处理下, 砷作为类重金属进入植物体内, 与叶绿体中蛋白质上的巯基结合或取代其中的 Fe2+、Zn2+、Mg2+等, 干扰矿质离子的吸收转运[8], 致使叶绿体蛋白中心离子组成发生变化而失去活性, 与此同时破坏、抑制叶绿素合成酶如原叶绿素酸脂还原酶的活性[27], 阻碍叶绿素的合成, 增强叶绿素分解酶的活性, 致使叶绿素分解加快, 加之郝玉波等[8]研究发现在砷胁迫下, 玉米叶绿体双层膜部分遭到损坏甚至消失、多数基粒片层断裂等现象表明砷胁迫引发叶绿体超微结构损伤。从而影响植物光合作用,造成植物叶片发黄, 生长迟缓。
3.2 对膜脂过氧化程度的影响
已有研究表明砷能引发植物的氧化胁迫, 打破细胞内固有自由基代谢平衡, 导致细胞膜脂质过氧化程度加重, 质膜结构遭到破坏, 失去原有选择性,并进一步影响植物的光合、呼吸等生理功能, 最终影响蛋白质、核酸、脂质等生物大分子的代谢过程[28]。廖宝凉等[29]研究亚砷酸钠对水稻幼苗生长的影响, 结果表明当培养液中砷(NaAsO2)的浓度约大于0.1×10-6时, MDA含量明显升高。樊香绒等[22]研究中国莲幼苗抗氧化系统对砷胁迫的响应结果显示: 当As(Ⅲ)处理浓度达到10 μmol/L时, 幼苗组织内的MDA含量显著高于对照组。在本实验中,处理组MDA含量均高于对照组, 但当As (Ⅲ)处理浓度低于500 μmol/L时, MDA含量较对照组差异不显著, 当处理浓度升高至500 μmol/L时, MDA含量显著高于对照组, 表明随着砷处理浓度的不断升高,黄花水龙无菌苗叶片细胞受到As(Ⅲ)胁迫引起的氧化压力加剧, 细胞膜脂过氧化程度随砷浓度增加而加重, 细胞膜系统受到破坏。
3.3 对渗透调节物质的影响
可溶性蛋白、可溶性糖都是植物细胞渗透压的重要调节物质, 可维持植物细胞和内环境的稳定。当植物渗透势较低时, 可通过提高可溶性蛋白质含量用以调节细胞渗透压使之维持正常水平[11]。可溶性糖不仅是高等植物光合作用主要产物, 也是衡量碳运输转化代谢过程的重要生理指标, 逆境条件下参与渗透调节, 与植物的抗性有密切关系。曾小飚等[30]研究砷胁迫对麻风树幼苗显示低浓度砷处理可溶性蛋白含量升高, 当处理浓度升至60 mg/L,可溶性蛋白含量逐渐下降, 樊香绒等[22]研究砷胁迫对中国莲幼苗抗氧化系统的影响也显示As (Ⅲ)在低浓度时能够显著增加可溶性蛋白质的含量, 而在浓度达到10 μmol/L 时可溶性蛋白质的含量有所降低。本实验结果显示, 黄花水龙无菌苗可溶性蛋白含量随砷作用浓度升高呈先升后降趋势, 说明低浓度的砷对可溶性蛋白质具有激活功能, 以适应环境中砷的胁迫; 随着砷浓度的逐渐增大, 则转为一定的抑制作用, 对机体造成损害, 影响其生长发育。
郝玉波等[8]的研究结果显示在低浓度砷处理下, 玉米可溶性蛋白含量较对照组有所降低, 而后随着处理浓度升高(高于2 mg/L)而显著升高。在本实验结果中可溶性糖随砷处理浓度升高也呈先降后升趋势, 原因可能是由于黄花水龙在砷逆境中需要一定适应时间, 也可能是低浓度砷激活植物某些生理活动, 使得黄花水龙无菌苗生理代谢旺盛, 需要更多光合产物满足生长需求。而随着砷作用浓度升高, 导致植物体内高分子碳水化合物如淀粉等的合成受到抑制, 并促进了其分解, 从而促进合成更多的可溶性糖, 维持体内渗透压平衡, 抵御砷作用逆境下的毒害作用, 提高植株抗逆性。常思敏等[9]研究砷对烤烟碳代谢影响的结果表明砷处理抑制了烤烟碳的同化和蔗糖的合成, 促进了蔗糖的分解,不利于碳向积累方向转化, 可溶性糖含量不断升高。薛艳等[17]研究镉和铅胁迫下黄花水龙可溶性糖含量呈逐渐降低趋势, 表明同一植物面对不同重金属胁迫反应机制有所不同。
3.4 对抗氧化酶活性的影响
在砷胁迫逆境下, 导致植物体内活性氧代谢平衡遭到破坏, 从而引发黄花水龙无菌苗产生氧化应激, 通过提高机体内抗氧化酶SOD、POD和 CAT活性, 维持细胞内活性氧自由基正常水平。其中超氧化物歧化酶(SOD)作为防御活性氧的第一道防线,是生物体内最重要的清除活性氧自由基的酶类, 其以氧自由基为底物, 通过催化超氧阴离子(O2·-)降解为双氧水(H2O2)及氧气(O2), 从而终止由超氧负离子造成的一系列生物毒损伤, 保护生物膜。在本实验中, SOD活性随砷浓度的增加呈先升后降的趋势,表明低浓度砷胁迫激活植物抗氧化系统, 增强自由基清除能力,从而减轻氧化损伤, 但同时SOD活性升高导致H2O2含量增加, 引发POD和CAT活性增强,用于清除多余的H2O2。而在高浓度砷胁迫下,逆境造成的伤害超出黄花水龙无菌苗的承受能力,抗氧化酶活性均有所降低, 朱云集等[10]、袁敏等[31]也有相似的结果。
综上, 本实验对在无机三价砷胁迫下黄花水龙无菌苗的叶绿素、丙二醛、可溶性蛋白、可溶性糖、抗氧化酶SOD、POD和CAT含量进行测定, 结果表明黄花水龙无菌苗在砷胁迫环境中生长, 其主要生理指标中叶绿素、可溶性蛋白含量以及抗氧化酶SOD、POD和CAT活性随砷浓度增加均表现出“低浓度促进高浓度抑制”趋势, 丙二醛含量持续升高, 可溶性糖含量先降后升, 说明低浓度的砷对黄花水龙产生毒害作用较小, 随着处理浓度升高,砷引发氧化胁迫对黄花水龙造成不可逆的损伤, 膜脂过氧化程度加剧, 细胞生长和光合作用都受到抑制。以上研究结果显示黄花水龙对于砷污染水体修复具备一定的应用潜力, 由于黄花水龙对水体中的N、P也有较好的去除效果, 因而可将黄花水龙作为砷污染下富营养化水体净化的修复植物。

