一株红假单胞菌的分离及生理特性研究
田莹莹 吴幸强 姬燕培 冯秀芳 肖邦定
(1. 中国科学院水生生物研究所 中国科学院藻类生物学重点实验室, 武汉 430072;2. 河南工学院材料科学与工程学院, 新乡 453003)
不产氧光合细菌(Anoxygenic Phototrophic Bacteria, AnPB)分布广泛[1,2], 在碳、氮、磷等元素的地球生物化学循环过程中扮演着重要的角色[3,4]。在水生态系统中, 不产氧的紫色非硫光合细菌(Purple Nonsulfur Bacteria, PNSB)可见于蓝藻形成的微生物垫及沉积物表层[5]。因其灵活多样的代谢模式, PNSB常被应用于有机废水处理和水体净化过程[6—8]。此外, PNSB, 尤其是红假单胞菌属(Rhodopseudonassp.)光合细菌, 在生物制氢及土壤生态修复等过程均可起到显著作用[9,10]。开展特定生境中光合细菌的分离鉴定及生理特性研究工作,对提高光合细菌污染净化能力认识, 挖掘光合细菌潜在应用价值具有重要的意义。
不产氧光合细菌都使用某种形式的细菌叶绿素(Bacteriochloroghyll, Bchl)作为其主要的光合色素, 且只有唯一的细菌叶绿素-蛋白质反应中心(RC-1或RC-2)[11,12]。与高等植物有两个独立的光反应系统(Photosynthetic system, PS)不同的是,PNSB光反应中心只有一个(RC-2), 结构类似于高等植物光合系统Ⅱ(PS Ⅱ)[13]。调制叶绿素荧光(Pulse-Amplitude-Modulation, PAM)具有测量快速、简单、可靠的特点, 且测量过程对样品生长基本无影响, 是研究光合作用的强大工具[14,15], 对实现光合细菌生理指标的快速监测具有重要意义。目前已有学者利用调制叶绿素荧光研究RC-2型不产氧光合细菌光合反应器中能量和电子传递过程[16—18]。
本研究从武汉东湖沉积物中分离得到1株紫色非硫光合细菌, 对其细菌形态、特征吸收光谱、系统发育信息、蛋白质含量、ATP酶(ATPase)活性、光合作用及适宜生长条件等生理特性进行了研究,旨在提高人们对光合细菌的认识, 并为调制叶绿素荧光技术用于光合细菌生理特性表征提供重要的参考依据。
1 材料与方法
1.1 菌种来源
采集东湖表层沉积物样品。移取适量静置沉淀后的上清液至250 mL碘量瓶, 加入ATYP光合细菌富集培养基进行富集。ATYP富集培养基购于山东拓普生物工程有限公司。富集过程中瓶口用水密封。于光照强度1000 lx, 28℃恒温培养。待培养物呈现明显的红色, 进行后续分离纯化。
1.2 分离纯化
采用双层平板法分离光合细菌, 所用分离培养基为含1.5%琼脂的上述富集培养基。将富集培养后的菌悬液梯度稀释后均匀涂布于固体培养基表面。待涂布液被吸收后在其上倾倒一层同体积的固体琼脂培养基。将制好的平板置于透光度较好的抽真空的干燥器中培养1—2周(1000 lx, 28℃)。用牙签挑取两层琼脂间红色菌落, 反复涂布、划线、分离, 至镜检无杂菌且整个培养基表面为单一形态菌落, 得到供试菌株, 命名为PUF1。
1.3 光合细菌种子液的制备
用灭菌的牙签挑取平板上的单菌落, 转入装有2 mL ATYP液体培养基的血清瓶中预培养, 后逐级放大培养至100 mL。于28℃、光照强度1000 lx下培养。
1.4 菌株鉴定
细菌分子鉴定所获得的纯菌株的分子鉴定通过扩增紫色非硫光合细菌光反应中心蛋白M亚基编码的puf M基因进行, 所用特异性引物对为puf M 557F/750R[19]。取2 mL纯培养菌悬液, 离心收集菌体沉淀, 用细菌DNA提取试剂盒(OMEGA Bio-Tek)提取细菌总DNA, 提取步骤按说明书进行。PCR反应体系(20 μL): 2×TaqMasterMix(CWBIO)10 μL, 无菌水8.5 μL, 引物各0.5 μL(10 pmol), DNA模板 0.5 μL。扩增条件: 94℃ 3min, 94℃ 30s; 59℃30s; 72℃ 1min; 39个循环; 72℃ 7min。将纯化后PCR产物连接至pMD-18T载体, 进一步转化大肠杆菌DH5α感受态细胞。随机选取正确插入片段的阳性重组克隆, 送测序公司测序。所得基因序列采用BioEdit软件进行组装, 去除载体序列, 同时上传序列至GenBank数据库, 获得登录号(KU886140)。将测序得到的序列在National Center for Biotechnology Information(NCBI)网站上进行BLAST比对, 下载与其相似序列, 应用BioEdit中的ClustalW Multiple aligment程序进行多序列联配, 用MEGA 5.1构建系统发育树。
吸收光谱的测定取适量体积的对数生长期菌悬液两份, 离心去除培养液, 一份用60%蔗糖溶液重悬后进行活细胞吸收光谱全波长扫描, 另一份用100%甲醇提取菌体色素, 取离心上清液进行色素吸收光谱全波长扫描(Cary WinUV, 安捷伦, 美国)。波长为200—1000 nm, 扫描速度为600 nm/min。
扫描电镜观察预先在光合细菌培养装置中放入0.5 cm×0.5 cm玻璃片, 待细菌生长至稳定期取出。用0.1 mol/L pH 7.0磷酸缓冲液清洗玻片两次, 后用2.5%戊二醛固定液固定2h。在固定液清洗后, 进行脱水, 脱水梯度为50%乙醇10min, 70%乙醇15min, 80%乙醇15min, 90%乙醇15min, 无水乙醇15min(两次), 2:1乙醇-叔丁醇15min, 1:1乙醇-叔丁醇15min, 叔丁醇15min(两次)。真空冷冻干燥后,取出玻片, 黏附于导电胶上, 上机(S-4800, Hitachi,日本)观察。
透射电镜观察透射电镜(HT-7700, Hitachi,日本)用于观察PUF1超微结构。样品前处理过程包括包埋块的制备、包埋块的修整及超薄切片制备,由中国科学院水生生物研究所分析测试中心负责完成。
1.5 细菌生物量测定
将新接种的细菌培养体系暗适应2h后, 于连续光照(1000 lx)、室温(28±1)℃培养。定期取样, 于波长650 nm测定培养液吸光度(A650)。细菌生长曲线用Logistic模型拟合:

式中a值为Amax,xc为到达生长曲线拐点处(即1/2a值)的时间,k为特定生长速率(/h)。
1.6 溶解氧、pH、光照强度的测定
培养液中溶解氧(DO)用微电极测定(Unisense,丹麦)。使用前用75%酒精冲洗溶解氧玻璃电极两次。步距为0.5 mm, 测定体系中DO的垂直变化情况。
用1 mol/L HCl或NaOH调节pH至6.00、6.64、7.30和8.00, 观察PUF1在不同pH条件下生长状态。pH的测定用pH计(YSI pH 100A, 美国)。
光照强度梯度设置为: 100(室内自然光)、500、1000和3000 lx。光照强度用照度计测定(ZDS-10F-2D, 上海市嘉定学联仪表厂, 中国)
1.7 元素组成分析
取冷冻干燥的生长稳定期细菌菌粉用于元素组成分析。细菌碳(C)、氮(N)含量的测定用元素分析仪完成(Vario EL cube, Elementar, 德国)。菌体含磷(P)量采用过硫酸钾消解, 钼蓝比色法。细菌粗灰分(Ash)的测定采用灼烧法。
1.8 蛋白质含量及ATP酶活性测定
取适量体积光合细菌菌悬液, 高速离心(10000×g, 10min), 尽弃上清液, 用0.85%生理盐水反复洗涤菌体沉淀多次。半微量凯氏定氮法测定蛋白质含量。
制备适宜浓度的细胞悬液(107/mL), 用超声粉碎器破碎(冰浴), 摇匀后用于ATP酶(ATPase)活性的测定。ATPase活性的测定采用南京建成细胞微量ATP酶试剂盒进行。
测定细菌蛋白质、ATPase活性的同时, 取样测定650 nm处培养液吸光度A650。
1.9 光合作用测定
用水样调制叶绿素荧光仪(Water-PAM, WALZ,德国)测定纯培养条件下PUF1光合作用。调节增益(Gain)使瞬时稳态荧光(Ft)在200至600之间变化, 测定PS II最大光量子产量(Fv/Fm)。测定快速光曲线时, 预先暗适应15min。光强度梯度为221、327、499、746、1058、1469、2410和3516 μmol photons/(m2·s), 两步间隔15s, 光饱和脉冲在3000 μmol photons/(m2·s), 得到最大光利用系数(alpha)及最大电子传递速率(ETRm)。
1.10 数据分析
用Excel整理数据, 采用Origin 8.0作图。用SPSS 19.0软件进行统计分析。显著性水平为P<0.05。
2 结果
2.1 光合细菌鉴定
菌落的形态特征平板计数PUF1时发现,生长于培养基表面的菌落周围呈乳白色, 且菌落个体较大, 而位于两层固体琼脂之间菌落相对较小,通体呈紫红色(图 1)。
图 2为光合细菌扫描电镜图, 可以看出光合细菌呈直的或稍弯曲的杆状, 或成簇或零散分布于玻璃载体表面。生长稳定期PUF1大小为长3.05—10.06 μm,直径0.32—0.68 μm。
图 3为透射电镜下光合细菌细胞超微结构图,表明光合细菌具有明显的片层膜结构。序列比对结果显示PUF1与R.palustris的相似性最高, 推测所分离PUF1为红假单胞菌属的沼泽红假单胞菌, 下载与其相似序列, 构建系统发育进化树(图 4)。
光合细菌扫描光谱细菌悬液扫描谱图结果显示, PUF1在波长377、460、490、592、807、865和980 nm处有较明显吸收峰(图 5A), 其中377、807和865 nm是细菌叶绿素a(Bchla)特征吸收峰,592和980 nm是细菌叶绿素b(Bchlb)的特征吸峰。PUF1菌体甲醇提取物呈青色, 波长460至540 nm处三个连续吸收峰是由类胡萝卜素引起的, 波长771 nm处特征吸收峰由Bchla引起(图 5B)。
在PUF1培养过程中血清瓶上部为少量无菌空气, 依靠微生物自身生命活动消耗溶液中的氧(DO)。实验过程中测定了不同培养时间(3d、4d和7d)体系中DO的垂直变化情况。结果显示, 培养过程中有氧层厚度在0.5 cm; 液面下0.5至1 cm为缺氧-厌氧过渡阶段, DO小于0.5 mg/L; 液面以下1 cm,培养体系完全厌氧(图 6)。
2.2 元素组成
稳定期PUF1菌体C、N、P元素含量如表 1所示。除去灰分部分, PUF1菌体C、N相对含量分别为53.75%和10.35%, C/N摩尔比为6.06。

图 1 平板计数PUF1Fig. 1 Colony enumeration of PUF1

图 2 PUF1扫描电镜图Fig. 2 The scanning electron microscopic image of PUF1

图 3 PUF1透射电镜图Fig. 3 The transmission electron microscopic image of PUF1
2.3 培养条件对光合细菌生长和光合作用的影响
pH对光合细菌生长和光合作用的影响微生物活动是由一系列酶促反应参与完成的, 维持pH在适宜范围对细菌生长有重要意义。如图 7所示, PUF1生长延迟期为12h, 5—6d达生长稳定期。PUF1生长曲线适用Logistic模型(R2≥0.97)。初始pH 6.00—8.00, 稳定期细菌生物量无显著差异。初始pH 6.64, PUF1生长速率最快(k, 0.064/h), 生长周期最短(xc, 49.59h)。pH偏酸(pH 6.00)或偏碱(pH 8.00), PUF1生长速率较慢(k, 0.051/hvs. 0.041/h)。pH 8.0时PUF1生物量较高(A650, 1.38), 这可能与PUF1初始接种浓度稍高有关。
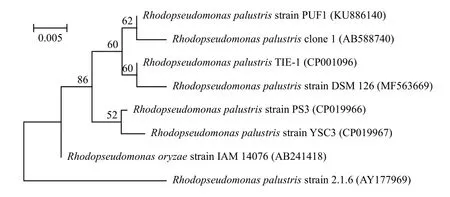
图 4 菌株PUF1与相关菌株的系统进化树Fig. 4 Phylogenetic tree of Strain PUF1 and related strains

图 5 PUF1细菌悬液及甲醇提取物吸收光谱图(A. 细菌悬液; B.甲醇提取物)Fig. 5 Absorption spectra of the intact cell suspension (A) and methanol extract (B) of strain PUF1
此外, 实验考察了不同初始pH培养条件下PUF1光合作用参数的变化(图 8)。实验6d, 各处理组Fv/Fm与pH分别为: 初始pH 6.00,Fv/Fm0.10(pH 7.72±0.33), 初始pH 6.64,Fv/Fm0.12(pH 7.95±0.28),初始pH 7.30,Fv/Fm0.08(pH 8.39±0.21)。由图 8D可知, 初始pH 8.00, 实验2d,Fv/Fm为0(pH 8.4), 光合活性下降显著。由图 8B和图 8C也可看出, 实验3d初始pH 6.64升高至8.03, 初始pH 7.30升高至8.32,此条件下Fv/Fm、α显著降低。以上结果表明, 培养体系pH高于8.00或对PUF1光合作用有显著抑制。
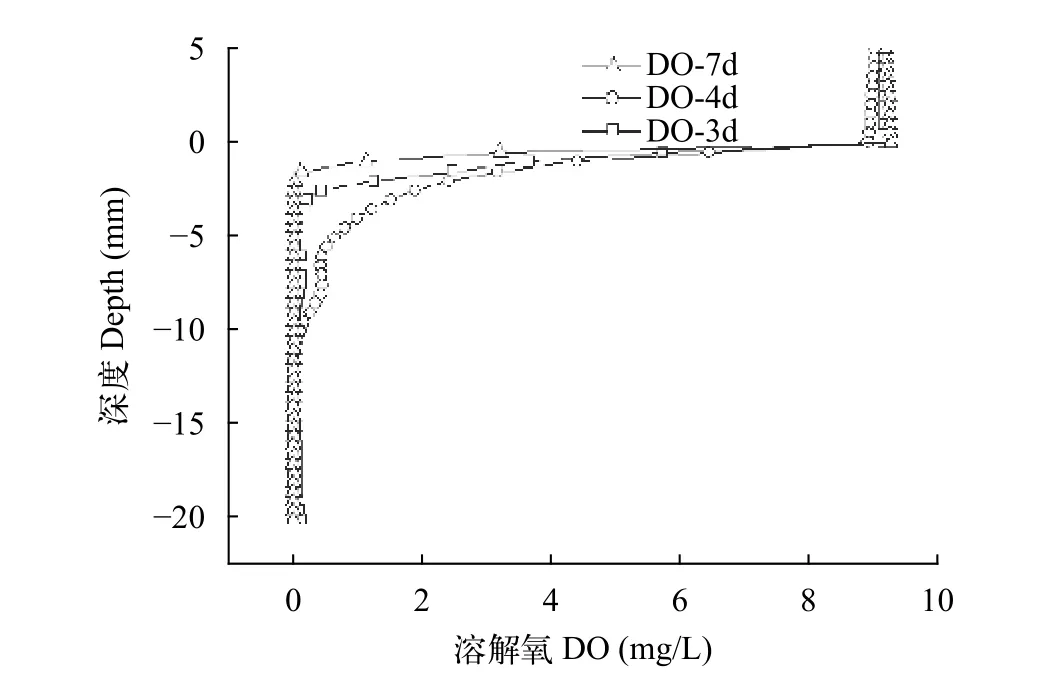
图 6 不同培养时间溶解氧的垂直变化Fig. 6 The vertical profile of dissolved oxygen at different culture times

表 1 菌株PUF1主要元素含量Tab. 1 Proportion of major elements of strain PUF1

图 7 不同初始pH条件下PUF1生长曲线Fig. 7 The growth curve of PUF1 from different initial pH
光照强度对光合细菌生长和光合作用的影响如图 9所示, 光照强度500—3000 lx(初始pH 6.8), 稳定期细菌生物量无显著差异, 其中光照强度3000 lx, 细菌生长速率最快(k, 0.059/h), 生长周期最短(xc, 59.30h)。当光照强度为100 lx时, 细菌增长缓慢。
实验结束, 在四组光照强度下, 培养体系pH均小于8.0。光照强度500—3000 lx,Fv/Fm变化规律为迟滞期较低, 对数期较高, 稳定期降低; 光照强度100 lx,Fv/Fm在培养初期(0—60h)稍有下降, 后呈直线上升趋势, 实验结束时Fv/Fm较高(0.17±0.02, 图 10),这可能与体系内较少的细菌生物量和充足的剩余营养物有关。
2.4 光合细菌生长周期内蛋白质、ATP酶及光合活性的变化
光合细菌蛋白含量与ATP酶活性如图 11所示, PUF1菌体蛋白含量在细菌生长不同阶段有所差异, 表现为适应期含量低, 对数至稳定期含量较稳定且显著高于适应期蛋白含量(P<0.05)。稳定期PUF1蛋白质含量为(634.09±4.3) mg/g, 超过菌体干重的60%, 可作为优质的单细胞蛋白来源。ATPase存在于组织细胞及细胞器的膜上, 是生物膜上的一种蛋白酶, 参与物质运输、能量转换以及信息传递等, 机体在胁迫状态下, 此酶活力发生一系列改变。ATPase活性随培养时间的延长而下降, 推断培养后期可能由于碳源、维生素等营养物质缺乏和细胞老化导致细胞ATPase活性下降显著。
PUF1光合活性通过对Fv/Fm的监测可在一定程度上反映PUF1的生长状态, 为光合细菌的规模化培养提供可行性指导。如图 12所示, 在PUF1生长周期内Fv/Fm的变化规律符合单峰高斯模型(Gauss model), 拐点处A值为0.65(即1/2Amax), 表明对数期Fv/Fm最高, 而迟滞期与稳定期Fv/Fm均相对较低。造成以上结果的原因, 主要可以归纳为以下两部分。首先, 与培养体系中物质的转化与利用有关, 主要为初期细菌需要适应新的培养条件, 而稳定期细菌生物可利用营养物质(如碳源)短缺使得PUF1光合作用受影响。此外, 光能利用率的降低也是不可忽略的因素, 一方面, PUF1贴壁生长, 影响反应器透光性, 另一方面, 稳定期PUF1生物量高,细菌相互遮挡, 都会影响光能的可利用性。应用调制叶绿素荧光技术对RC-2型光合细菌资源开发及其快速监测具有重要意义, 值得深入研究。

图 8 光合作用参数与pH关系Fig. 8 Relationship of pH and photosynthesis parameters
3 讨论
3.1 光合细菌的分离及特性
本研究利用双层平板法, 从武汉东湖分离筛选出一株不产氧光合细菌, 所分离光合细菌与Ramana等[20]对红假单胞菌属光合细菌形态的观察结果基本一致, 且具有明显的片层膜结构, 与沼泽红假单胞菌(Rhodopseudomonas palustris,R. palustris)WKUKDNS3细胞超微结构[21]高度相似。基于PUF1光反应中心puf M功能基因片段测序结果, 发现该菌株与沼泽红假单胞菌亲缘关系最近, 初步确定为红假单胞菌属紫色非硫光合细菌, 命名为Rhodopseudo-monas palustrisstrain PUF1。菌株PUF1特征吸收谱图扫描结果与Okubo等[22]对猪场废水沟渠光合细菌微生物垫的研究结果一致。菌株PUF1不同生长阶段其蛋白含量有所差异, 以稳定期为最高, 可达细胞干重的60%, 是优质的单细胞蛋白。Carlozzi等[23]对R. palustris元素组成进行了分析, 得出R. palustris元素组成为CH1.92N0.17O0.41(不考虑灰分部分)。在本研究中菌株PUF1 C、N元素含量与Carlozzi等[23]研究结果大体相当。PUF1具有代谢蓝藻生物质的潜力, 以野外蓝藻为培养基质, 干藻粉浓度1.67 g/L可显著促进PUF1增殖, 并可实现对体系内氮、磷营养物质的再利用[24]。PUF1与其同源菌株R.palustrisTIE-1相似性为99%, 其中TIE-1具有从富含铁、硫及其他矿物质的沉积物中获得电子的特性, 因而可将TIE-1用于电池生产过程[25], 而PUF1是否也同样具备发电能力需进一步研究。

图 9 不同光照强度下PUF1生长曲线Fig. 9 The growth curve of PUF1 from different light intensity

图 10 光合作用参数与光照强度Fig. 10 Relationship of light intensity and photosynthesis parameters
紫色非硫光合细菌(PNSB), 尤其是红假单胞菌属(Rhodopseudomonassp.)光合细菌分布广泛, 代谢模式灵活, 对多种有机物降解作用显著[7,10,22], 是生物制氢、黑臭水及水体富营养化治理等领域中重要的候选微生物[8,9,24]。Okubo等[22]利用固体平板涂布和厌氧产气袋结合的方法对猪场废水沟渠中的PNSB进行了分离, 发现红细菌属和红假单胞菌属占优势。Sharma等[21]利用同种分离方法, 从夏季设施猪场泻湖样品中分离得到一株沼泽红假单胞菌Rhodopseudomonas palustrisWKU-KDNS3, 好氧条件下能降解污水塘中广泛存在的3-甲基吲哚恶臭物质。尹乐斌等[26]利用双层平板法从农药厂污水处理池分离得到一株高效降解氯氰菊酯农药的沼泽红假单胞菌PSB07-13, 培养6d, 对50 mg/L氯氰菊酯的降解率可达80%。以上研究结果表明R.palustris在生态系统中可发挥广泛的作用, 提高了人们对PNSB代谢多样性的认识。因此, 针对特定污染水域光合细菌的分离对后期水治理工作可发挥重要的适用性和实用性价值, 需深入研究。
3.2 环境因素对光合细菌的影响
静水水体中低浓度的溶氧和简单有机质的存在是导致PNSB骤增的重要因子[22]。对DO监测结果表明, 采用ATYP培养基可为PUF1生长营造良好溶氧环境。有研究指出在振荡培养条件下, PNSB色素合成能力丧失或降低, 培养物呈灰白色或微粉红色[27], 细胞无增殖[28]或虽能生长, 但生长量明显低于静止、微氧条件下的生长量[27,29]。但DO对色素合成的胁迫作用是可逆的, 氧胁迫作用去除, 光合细菌又可恢复合成色素的能力。

图 11 PUF1蛋白质含量与ATPase活性的动态变化Fig. 11 The dynamics of protein contents and ATPase activities of strain PUF1
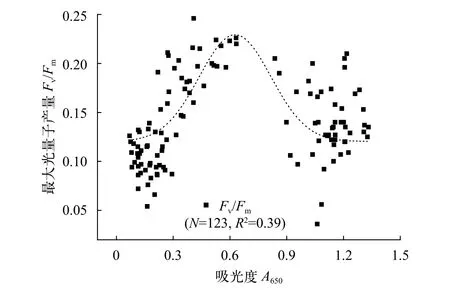
图 12 PUF1培养周期内Fv/Fm变化Fig. 12 The variations of Fv/Fm in the whole culture period of PUF1
Choorit等[29]研究了Rhodopseudomonas palustrisKG31在乙酸、丙酸、丁酸及混合碳源培养条件下生长情况, 结果显示, 在光照、微需氧条件下KG31生长迟滞期为7.29—12.49h, 最大生长速率为0.038—0.094/h。培养基pH低于5或等于10光合细菌均难以生长, 且在不同培养基中其最适pH范围有所不同[27]。
已有研究表明, pH对光合作用有显著影响。锥状斯氏藻和塔玛亚历山大藻对pH的变化及其敏感,适宜pH为7.0—9.0, pH高于9.5时, 不能进行有效的光合作用[30]。随着pH的升高, 金鱼藻Fv/Fm与ETR相应上升, pH高于10或低于7则均下降[31]。张虎等[32]研究了pH对小球藻光合作用、生长和产油的影响, 发现pH为7.0—9.0, 光合放氧、生长速率、生物质产率、总酯含量和产率均保持在较高水平,而pH低于7.0或高于9.0, 上述指标都显著降低。Adessi等[16]研究了室外培养条件下R.palustris产氢与Fv/Fm关系, 结果显示产氢阶段Fv/Fm变化不显著,在培养初期Fv/Fm维持在较低水平, 推测因需适应室外高光条件导致。本研究利用Water-PAM测定了培养周期内PUF1光合作用变化规律, 发现Fv/Fm在细菌生长对数期较高, 而延迟期较低, 与上述研究结果一致。在室外培养条件下, 光照充足,Fv/Fm较高(0.55—0.65)[16], 而室内培养光照较弱(100—3000 lx), 可能是导致Fv/Fm较低(小于等于0.3)的主要原因。pH在较小的范围内变化(pH 6.00—8.00)对细菌光合作用影响不明显, 而当培养体系pH高于8.00,Fv/Fm降低显著, 因此PUF1规模化培养过程中应加强对pH的动态监测。此外, 室外高光条件下,R.palustris培养过程中Fv/Fm较高, 为0.55—0.65, 这可能与充足的光补偿有关。
光合细菌应用前景广阔, 快速监测技术的开发在其规模化培养过程中意义重大。目前, 有关pH对光合细菌光合作用的影响机制尚不清楚, 深入研究Fv/Fm、ATPase、蛋白质等细菌生理生化指标与培养体系中营养物质利用的关系, 对全面和快速评估细菌生长具有重要意义。

