鳗鲡肾脏细胞系的建立及其对鳗鲡疱疹病毒的敏感性
李苗苗 吴 斌 林 楠 王晓伟 江小斌 林国清 樊海平
(1. 福建省水产技术推广总站, 福州 350002; 2. 福建海洋职业技术学校, 福州 350012; 3. 福州市海洋与渔业技术中心, 福州350026; 4. 福建省淡水水产研究所, 福州 350002)
鱼类细胞系作为重要的实验材料, 具有成本低廉、实验可重复性和可控性强、取样及观测简便、利于进行大量样本分析等显著优点, 被广泛用于水生生物病毒学、发育生物学、遗传学、免疫学、毒理学和药理学等研究领域[1]。鱼类细胞培养最主要应用于病毒的分离、纯化和鉴定[2]。1962年Wolf和Quimby[3]利用细胞培养技术分离培养了传染性胰脏坏死病毒(第一个鱼类病毒)。根据Lai等[4]研究报道, 同一种鱼不同组织的细胞系对同一种病毒的敏感性不同。而同一个细胞系, 对不同的病毒敏感性也不同。所以不同鱼类细胞系的建立对病毒的研究十分必要[2]。
鳗鲡(Anguilla anguilla)是我国重要的经济鱼类之一, 具有较高的营养价值[5,6], 但随着鳗鲡养殖业的发展, 鳗鲡养殖过程中病害的发生也逐渐增多,给养殖户带来极大的经济损失, 制约了鳗鲡养殖业的健康发展[7—9]。鳗鲡病害病原有细菌、病毒、寄生虫等, 其中对鳗鲡危害最大的疾病是病毒性疾病, 其诊断和防治难度均高于其他病原引起的疾病。病毒只能在天然宿主或适合的细胞内增殖[10],因此, 建立鳗鲡细胞系是对鳗鲡病毒分离和培养,开展鳗鲡病毒性疾病流行病学调查和病原生物学研究非常重要。目前, 国内外已经开展了鳗鲡组织细胞系建立工作, 并开展了体外培养条件优化相关研究。Chen和Kou[11]以日本鳗鲡为实验材料建立了鳗鲡卵巢细胞系, 庄道华等[12,13]以欧洲鳗鲡为实验材料建立了鳗鲡尾鳍细胞系, 毛凝等[2,10]开展了欧洲鳗鲡胸鳍细胞培养条件优化等方面的研究工作。
本研究以欧洲鳗鲡肾脏组织为材料, 建立了鳗鲡肾脏细胞系EEK, 并开展了EEK培养条件的优化以及其对鳗鲡疱疹病毒敏感性的实验, 探讨EEK体外培养的最适条件, 为鳗鲡病毒性病原的分离鉴定和性质分析提供研究基础。
1 材料与方法
1.1 实验材料
实验鱼健康欧洲鳗鲡取自福建省建瓯市融泉水产养殖有限公司, 规格为0.5 kg, 活力良好。
主要试剂培养液L15(Hyclone)、MEM(Hyclone)、胎牛血清(Fetal Bovine Serum, Hyclone)、胰蛋白酶(TRYPSIN 0.25% EDTA)、Phosphate Buffered Saline(PBS)购自厦门泰京生物科技有限公司。培养液DMEM/F12 1限公司。培养液DMEM/F12 1∶1(3 g/L HEPES; 2 mmol/L L-丙氨酰-谷氨酰胺), 重组鼠碱性成纤维生长因子(FGF-basic, Murine), N-乙酰葡萄糖胺(N-AG), 羧甲基纤维素钠(CMC), β-巯基乙醇(2-ME), 100×双抗(青霉素和链霉素), 二甲基亚砜(DMSO)购自生工生物工程(上海)股份有限公司。完全培养液: DMEM/F12+20%FBS+50 μg/mL N-AG+50 μg/mL CMC+0.1 mol/L 2-ME+10 μg/L FGF-basic+100 IU/mL 青霉素+100 μg/mL 链霉素; 细胞冻存液: 90% FBS+10% DMSO。
1.2 原代培养
将健康欧洲鳗鲡洗净用适量丁香酚进行麻醉后移入细胞操作间, 在无菌条件下解剖鱼体, 取出约0.5 cm3肾脏组织, 用手术刀片将组织块切碎至约1 mm3。在室温条件下, 1500×g离心2min, 弃上清。加入3 mL 0.25%胰蛋白酶室温消化10min, 1500×g离心2min, 弃上清, 加入适量细胞完全培养液终止胰蛋白酶的消化作用, 将组织块移入25 cm2细胞培养瓶中, 均匀铺开于瓶底, 吸取多余的培养液, 于27℃倒置培养。24h后缓慢加入5 mL完全培养液,启动原代培养, 每周更换一次培养液。
1.3 传代培养
逐日观察原代培养情况, 当观察到有大量肾脏细胞从组织块迁出并在组织块周围形成环形生长晕时, 移除旧培养液, 用5 mL PBS清洗1—2次, 加入1 mL 0.25%胰蛋白酶消化约2min后加入含血清的完全培养液, 以适当比例接种至新的培养瓶中, 补齐每瓶培养液至5 mL后置于27℃培养。
1.4 细胞冻存与复苏
选取处于生长对数期的鳗鲡肾脏细胞, 经胰蛋白酶消化, 1500×g室温离心2min后收集细胞沉淀,加入细胞冻存液, 轻轻混匀后转移至冻存管, 置于程序降温盒于-80℃放置1d后转移至液氮罐中长期保存。
取冻存3个月的细胞系进行复苏检测: 从液氮中取出冻存的鳗鲡肾脏细胞冻存管, 快速放置于水浴锅(27℃)中, 使其解冻。完全融化的细胞悬液经1500×g室温离心2min后弃上清, 加入培养液, 转移至培养瓶, 置于27℃培养。
1.5 细胞培养条件优化
最佳培养液选取生长良好的鳗鲡肾脏细胞, 经胰酶消化后分别用DMEM/F12、L15、MEM完全培养液(均含10% FBS)进行培养, 并分别用相应培养液调节细胞浓度为5×104个/mL, 置于27℃培养, 每天计数一次, 连续计数7d。每组设置3个重复,取3次计数的平均值作为试验数据。
最适血清浓度选取生长良好的鳗鲡肾脏细胞, 经胰酶消化后分别用含5%FBS、10% FBS、15% FBS和20% FBS的DMEM/F12完全培养液进行培养, 并分别用相应培养液调节细胞浓度为5×104个/mL, 置于27℃培养, 每天计数一次, 连续计数7d。每组设置3个重复, 取3次计数的平均值作为试验数据。
最适培养温度选取生长良好的鳗鲡肾脏细胞, 经胰酶消化后用DMEM/F12完全培养液(含10% FBS)进行培养, 并调节细胞浓度为5×104个/mL, 分别置于17℃、22℃、27℃、32℃进行培养,每天计数一次, 连续计数7d。每组设置3个重复, 取3次计数的平均值作为试验数据。
1.6 细胞染色体观察和分子鉴定
将传代至35代的鳗鲡肾脏细胞接种至培养瓶中培养48h, 加入终浓度为10 μg/mL的秋水仙碱, 继续培养12h后收集细胞, 经固定、染色、干燥、封片后观察。
选取生长良好的鳗鲡肾脏细胞, 消化后收集细胞沉淀, 提取细胞总DNA, 以细胞DNA为模板, 采用Jochen Trautner[14]建立的方法进行PCR鉴定, 引物序列见表 1。在PCR扩增结束后, 1%琼脂糖凝胶电泳观察扩增结果, 并将PCR产物送生物公司进行测序。
1.7 鳗鲡疱疹病毒敏感性实验
鳗鲡病料收集从福建省某鳗鲡养殖厂, 取出现“脱黏败血病”典型症状的疑似为鳗鲡疱疹病毒(AnHV)阳性病料, 分离鳃、肝、肾、脾组织, 匀浆后分为2份: 1份用于鳗鲡疱疹病毒PCR检测用,另1份用于接种鳗鲡肾脏细胞。

表 1 鳗鲡肾脏细胞PCR鉴定引物序列Tab. 1 PCR primers for EEK cells detection
病毒感染细胞将上述1份组织匀浆液经0.22 μm微孔过滤除菌后, 接种至长满的鳗鲡肾脏细胞单层中, 于27℃吸附1—2h; 补足细胞培养液,于27℃培养箱中培养, 7d内逐日观察细胞病变(CPE)情况并记录; 若7d内未出现CPE, 则将细胞培养物冻融一次, 收集上清液继续接种新的鳗鲡肾脏细胞。同时设正常鳗鲡肾脏细胞作为对照。
病毒的PCR鉴定分别提取病料组织DNA和感染鳗鲡肾脏细胞的病毒悬液DNA, 用特异性扩增鳗鲡疱疹病毒DNA聚合酶基因的引物进行PCR扩增, 引物序列见表 1。在PCR扩增结束后, 1%琼脂糖凝胶电泳观察扩增结果, 并将PCR产物送生物公司进行测序。
2 结果
2.1 原代培养和传代培养
鳗鲡肾脏组织启动原代培养后4d左右, 从组织块周围有少量细胞迁移出来, 至第14天左右围绕组织块逐渐有大量细胞迁出(图 1A和图 1B)。这时,可经胰蛋白酶消化、传代, 开始鳗鲡肾脏细胞传代培养。鳗鲡肾脏细胞生长稳定后形态为较长的类纤维状(图 1C和图 1D), 并在不同代数细胞之间保持稳定。
2.2 细胞冻存与复苏
将冻存3个月的鳗鲡肾脏细胞系从液氮中取出进行复苏, 培养2d后在显微镜下进行观察, EEK细胞存活率为80%以上, 细胞形态与冻存前无明显差别(图 2), 继续培养2—3d, EEK细胞可长满瓶底, 并且可以进行传代培养。
2.3 细胞培养条件优化
最佳培养液 鳗鲡肾脏细胞系在三种不同的培养液(DMEM/F12、L15、MEM)中进行培养,结果显示, DMEM/F12和L15培养液均可支持EEK的正常生长和增殖(图 3A和图 3B), 在第2至第5天, 增殖迅速, 细胞数目明显增加(图 4), 而在MEM培养液中, EEK无法正常增殖, 细胞形态发生变化, 逐渐收缩、脱壁, 细胞逐渐死亡、数目不断减少(图 3C和图 4)。
最适血清浓度如图 5所示, 在5%—15%FBS浓度条件下, 随着FBS浓度的增加, EEK增殖速率和细胞数目呈逐渐增大的趋势, 在10%和15%FBS浓度条件下, EEK生长曲线大致吻合, 而FBS浓度继续增加至20%时, 细胞增殖速率和细胞数目又呈现下降的趋势。
最适培养温度如图 6所示, 在17℃培养温度下, EEK细胞生长缓慢, 22—32℃内均可正常生长和增殖, 27℃培养温度下增殖最快, 当温度增高至32℃时, EEK细胞生长速率大幅下降且细胞数目不断减少。
2.4 细胞染色体观察和分子鉴定
随机选取不同视野下的EEK中期分裂相细胞进行染色体观察和数目统计分析, 发现50%以上的细胞具有38条染色体(图 7和图 8)。
以EEK细胞DNA为模板, 采用Jochen Trautner建立的方法进行PCR鉴定, 1%琼脂糖凝胶电泳结果如图 9所示, 在约790 bp处有单一条带。将PCR扩增产物测序结果(图 10)在NCBI网站进行Blast分析, 结果显示该序列与欧洲鳗鲡Mitochondrialcytochromeb基因序列同源性为99%, 表明该细胞确为欧洲鳗鲡组织细胞。
2.5 鳗鲡疱疹病毒敏感性实验
病毒感染细胞将鳗鲡疱疹病毒阳性病料组织上清液接种EEK细胞, 在27℃培养条件下, 第3天, EEK细胞出现明显病变, 表现为细胞逐渐收缩、变圆、脱壁悬浮, 逐渐裂解死亡, 而对照组细胞正常生长(图 11)。
病毒的PCR鉴定用特异性扩增鳗鲡疱疹病毒DNA聚合酶基因的引物对鳗鲡疱疹病毒阳性病料组织DNA和感染鳗鲡肾脏细胞的病毒悬液DNA进行PCR扩增, 扩增出与预期大小一致的单一条带(图 12)。将PCR扩增产物送生物公司测序后进行序列比对分析, 结果显示所得序列与AnHV DNA聚合酶基因序列完全一致(图 13), 表明本实验鳗鲡疱疹病毒成功感染到EEK细胞。
3 讨论
鱼类组织在体外培养时的环境与体内有很大差异, 但是能适应这种差异的细胞可以逐渐从体外培养的组织块迁移出来, 进行增殖并逐渐形成稳定的形态[15—18]。本研究在庄道华等[12,13,18]的研究基础上成功建立了鳗鲡肾脏组织细胞系EEK, 目前EEK已传至38代, 细胞增殖形态良好, 呈典型的类纤维状。

图 3 EEK细胞在不同培养液中的生长情况(bar=200 μm)Fig. 3 Morphology of EEK cells in different culture media (bar=200 μm)A. DMEM/F12 (4th day); B. L15 (4th day); C. MEM (4th day)

图 4 EEK细胞在不同培养液中的生长曲线Fig. 4 The growth curves of EEK cells in different culture media

图 5 EEK细胞在含不同浓度FBS的培养液中的生长曲线Fig. 5 The growth curves of EEK cells in DMEM/F12 with different FBS concentrations
鱼类细胞培养常用的培养基有L15、RPMI-1640、M199、DMEM/F12、MEM等, 本研究选取L15、DMEM/F12、MEM三种培养基进行EEK的优化实验。结果表明, 细胞在L15和DMEM/F12培养基中生长较好, 细胞呈类纤维状, 可正常增殖和传代, 而在MEM培养基中无法正常生长, 细胞由类纤维状逐渐收缩变圆, 细胞浓度逐渐低于接种前,并逐渐有大量死亡细胞悬浮在培养基中。
目前, 大多数细胞在体外培养时都需要在培养液中添加血清。但是, 细胞的生长情况并非与血清浓度成正相关。一般情况下, 体外细胞培养常用的血清浓度为10%—20%。本研究中发现, EEK细胞在FBS浓度为10%和15%的培养基中, 生长情况较好, 而在FBS浓度为20% 的培养基中, 细胞增殖速率和密度均低于前者, 说明血清并非浓度越高越有助于EEK细胞的生长, 而EEK细胞在FBS浓度为5%的培养基增殖最慢, 细胞密度最低。

图 6 EEK细胞在不同培养温度下的生长曲线Fig. 6 The growth curves of EEK cells under different temperatures

图 7 第35代鳗鲡肾脏细胞系染色体Fig. 7 Chromosome of EEK cells of the 35th generation
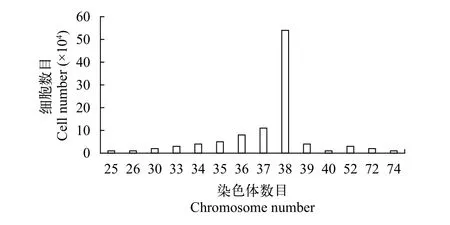
图 8 第35代鳗鲡肾脏细胞系染色体数目的分布Fig. 8 Number frequency of chromosomes of EEK of the 35th generation

图 9 鳗鲡肾脏细胞系PCR鉴定结果Fig. 9 EEK cell line PCR identification results 1. DNA Marker; 2. EEK DNA; 3. Blank control

图 10 鳗鲡肾脏细胞系PCR扩增产物测序结果Fig. 10 The sequence of PCR product of EEK cell line
Wolf等[18]认为, 鱼类细胞系在进行体外培养时, 培养温度与鱼种本身的最适温度相关。EEK细胞的生长速度在17—27℃内, 随着温度的升高而增加, 27℃时细胞的生长速度最快为其最适生长温度,这与鳗鲡本身适宜的生长温度有关。17℃时细胞生长速度较慢, 32℃培养温度下, 仅有少量细胞存活, 且细胞几乎无法增殖。温度过高导致细胞内与增殖相关酶的活性有所降低, 从而使细胞的增殖速率变慢[19]。因此, 进行细胞原代培养时, 最好选择适宜鱼生长的温度。
体外细胞培养时常发生染色体组的非整倍化现象, 其发生机制尚未阐明, 目前认为, 可能是因为染色体在细胞分裂过程中发生分离异常导致[20]。在本研究中, 虽然部分细胞出现了非整倍化现象,但50%以上观测到的分裂相细胞具有38条染色体,这与前人对鳗鲡细胞系的研究相一致[10]。研究表明, 在体外传续多代的情况下, 非异倍体鱼类体细胞系的染色体数符合众数特征的比例多在50%—70%[21—25], EEK细胞的染色体组型也符合上述特征,表明该细胞系仍属于二倍体细胞系。

图 11 EEK细胞疱疹病毒敏感性实验(bar=200 μm)Fig. 11 The sensitivity test of EEK cells infected with AnHV(bar=200 μm)
鱼类细胞系是鱼类病毒分离、培养和鉴定的重要载体, 不同细胞系对不同鱼类病毒的易感性有所不同。本研究中, 对EEK细胞系进行了鳗鲡疱疹病毒敏感性实验。结果表明, EEK细胞系可在An-HV感染后3d出现明显的细胞病变, 病毒感染细胞上清液的AnHV分子鉴定结果为阳性, 进一步证实了EEK对AnHV的敏感性。EEK的建立为鳗鲡病毒性疾病的诊断以及病原生物学研究提供了重要的工具。

图 12 AnHV病毒的PCR鉴定结果Fig. 12 The PCR identification results of AnHV

图 13 病毒PCR鉴定扩增产物序列Fig. 13 The sequence of PCR product of AnHV
综上所述, 本研究成功建立了鳗鲡肾脏组织细胞系EEK, 细胞形态为类纤维状, 在体外连续传代近40次仍保持旺盛的细胞增殖能力。该细胞系的建立对于鳗鲡病毒性疾病的诊断、病原生物学研究、病毒性病原的分离鉴定和性质分析、致病机理研究以及疫苗研制等具有重要意义。
致谢:
本研究中EEK细胞染色体观察及分子鉴定由福建师范大学黄镇博士协助完成, 在此表示感谢。

