不同饲料原料对黄颡鱼表观消化率及消化酶活性的影响
费树站 刘昊昆 韩 冬 金俊琰 杨云霞 朱晓鸣 解绶启
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
饲料原料的营养价值由多方面因素决定, 包括原料的营养成分, 动物对原料中各营养成分的消化、吸收及利用率[1]。表观消化率测定是评价饲料原料营养价值的重要内容, 也是配制营养平衡饲料的前提[2]。植物蛋白中含有多种抗营养因子, 如豆粕中含有胰蛋白酶抑制因子、抗原蛋白、寡糖等[3],菜粕中含有硫苷、单宁、唑烷硫酮、异硫氰酸酯、植酸等[4], 在一定程度上影响了饲料的适口性和安全性。研究发现通过生物发酵可明显降低豆粕中胰蛋白酶抑制因子、植酸、大豆凝集素、寡糖、抗原蛋白、脲酶的含量, 发酵还可以提高粗蛋白质、氨基酸、多种活性物质的含量, 同时产生特殊气味, 提高动物适口性[5,6]; 在菜粕经发酵后, 硫苷、唑烷硫酮、异硫氰酸酯、单宁、植酸等抗营养因子含量都有所降低, 粗蛋白和酸溶蛋白含量都有所提升[7]。
黄颡鱼(Pelteobagrus fulvidraco)具有产量大、生长快、耐低温低氧、含肉率高和肉质细嫩等优点, 是我国重要的淡水养殖经济鱼类。本实验通过投喂黄颡鱼豆粕与发酵豆粕、菜粕与发酵菜粕饲料, 比较黄颡鱼摄食不同饲料原料时的蛋白质、能量消化率、氨基酸利用率及消化酶活性和血液指标, 以评定这几种原料对黄颡鱼的营养价值, 为开发优质环保的黄颡鱼配合饲料提供科学依据。
1 材料与方法
1.1 实验鱼
黄颡鱼购买于武汉市江夏区邓家洲国营黄颡鱼原种场, 选用同批幼鱼, 暂养于室内循环水养殖系统中, 期间以商品饲料每天两次表观饱食投喂,使幼鱼适应养殖环境。驯化1个月后挑选体格健硕、规格均匀者随机分组开始正式实验, 初始平均体重为12.88 g。实验采用室内流水养殖系统, 共设置12个缸, 每缸40尾, 每种饲料3个平行, 溶氧6.0 mg/L以上, pH 6.8—7.2, 水温22—28℃, 滴加硫代硫酸钠溶液除去余氯。
1.2 实验饲料的设计与配制
4种原料为豆粕和发酵豆粕(武汉邦之德牧业科技有限公司)、菜粕和发酵菜粕(中国农业科学院油料作物研究所)。4种原料的营养成分见表 1。
实验共制作了5种饲料, 分别是基础饲料和4种实验饲料, 基础饲料以鱼粉、豆粕、菜粕为主要蛋白源, 添加0.5%的Cr2O3作为外源指示剂, 基础饲料配方和营养成分见表 2, 4种实验饲料由70%的基础饲料和30%的待测原料(豆粕、发酵豆粕、菜粕和发酵菜粕)组成, 将各成分粉碎过60目筛网, 混合,制成粒径为4 mm的颗粒。以上各颗粒饲料70℃烘干后于-20℃冰柜中保存备用。
1.3 饲养管理及粪便收集
正式实验前各缸用基础饲料驯养实验鱼1周,待其适应养殖环境后每天定时收集粪便, 待基础饲料粪便收集足够后再分别投喂4种不同原料饲料,1周后分别收集粪便。实验期间日投喂体重的3%—4%, 每天投喂3次, 在每天8:00、14:00和19:00各投一次, 1h后清除残饵, 3—4h后用虹吸法收集粪便,挑选包膜完整的粪便, -20℃保存, 实验共进行33d,粪便用冷冻干燥机冻干, -20℃保存待测。
1.4 样品分析及计算
测定的生化成分包括原料和饲料的粗蛋白、能量、灰分、水分及氨基酸含量, 粪便的粗蛋白、能量及氨基酸含量, 以上参数参照AOAC的方法测定[8]。采用105℃干燥恒重法测定样品水分含量; 粗蛋白含量采用凯氏定氮仪(2300 Kjeltec Analyzer Unit, FOSS TECATOR, Sweden)测定; 灰分采用马福炉550℃灼烧测定; 样品中外源性标记物Cr2O3的测定采用酸消化、比色法测定[9], 能值采用Phillipson微量能量计(Phillipson microbomb calorimeter,Gentry Instrument Inc., Aiken, USA)测定, 氨基酸含量采用高效液相色谱仪(LC-20AT, 津岛)由中国广州分析测试中心测定。
各表观消化率的计算参考李英等[10]。

表 1 原料的化学组成Tab. 1 Chemical composition of six feed ingredients (%)
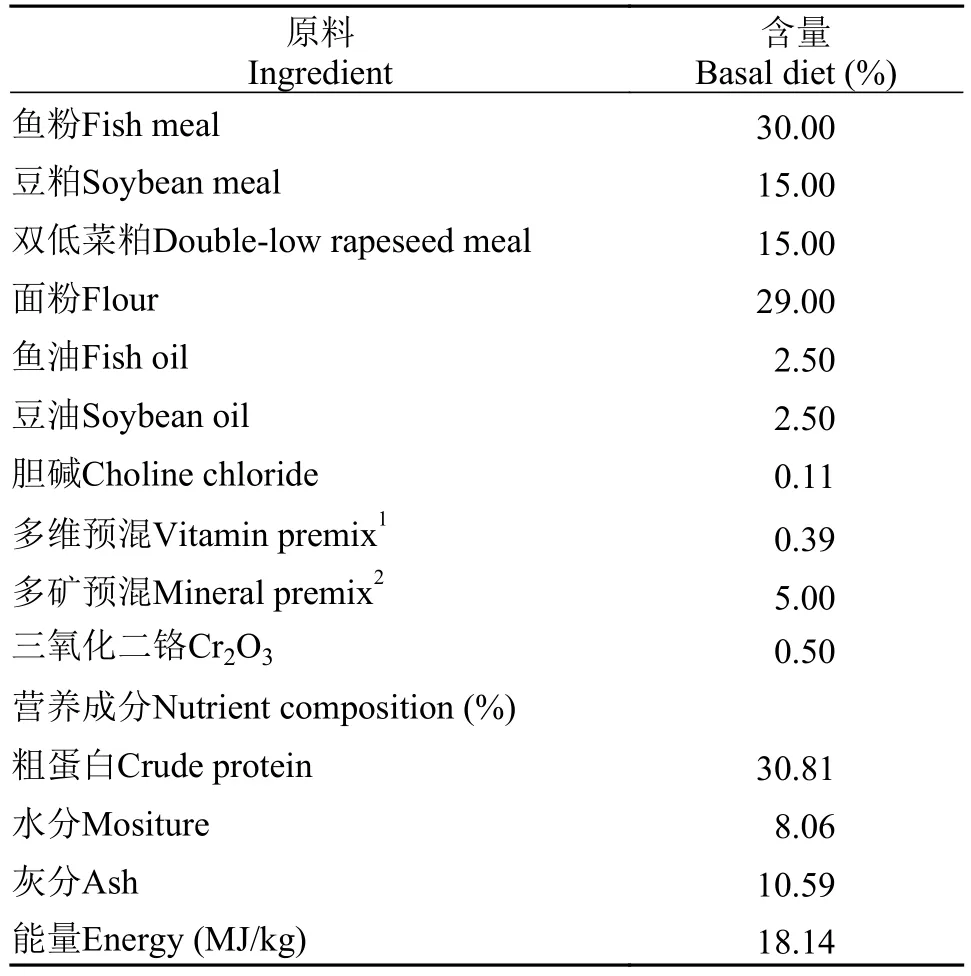
表 2 基础饲料配方及化学组成 (干物质, %)Tab. 2 Formulation and chemical composition of the basal diet(dry matter, %)
1.5 样品处理
养殖实验结束后所有缸实验鱼饥饿24h, 每缸随机取2尾鱼, 每个处理6尾, MS-222(80 mg/L)麻醉,肝素钠抗凝剂润洗无菌注射器, 尾部静脉采血,3000 r/min离心10min, 分离血浆保存于-80℃冰箱,血液指标采用全自动生化分析仪(迈瑞Mindray,BS-460)测定; 每缸再随机抽取鱼3尾, 每个处理9尾,冰盘取肝脏、胃、前肠和中后肠, 液氮速冻, 分装保存于-80℃超低温冰箱待测消化酶活力。样品分析前于4℃冰箱内解冻, 在冰盘剪碎并迅速准确称取一定量组织, 根据不同酶活测定要求加入一定体积的匀浆介质, 在冰水浴条件下机械匀浆, 4℃下2500 r/min离心10min, 取上清液测定消化酶活力。
1.6 消化酶活力的测定
消化道胰蛋白酶、糜蛋白酶和淀粉酶活性均是购买南京建成生物工程研究所的试剂盒根据其说明书进行测定。
胰蛋白酶活力单位定义: 在pH 8.0时, 37℃条件下, 每毫克组织蛋白中含有的胰蛋白酶每分钟使其吸光度变化0.003即为一个酶活力单位。
糜蛋白酶活力单位定义: 在37℃条件下, 每毫克组织蛋白每分钟分解蛋白生成1微克氨基酸相当于1个酶活力单位。
淀粉酶活力单位定义: 在37℃条件下, 每毫克组织蛋白与底物反应30min, 水解10 mg淀粉即为1个淀粉酶活力单位。
1.7 数据统计分析
实验数据用 SPSS 分析软件进行单因素方差分析(ANOVA),并用Duncan氏进行多重比较, 显著性水平为P<0.05, 数据以平均数±标准误差(Means±error)表示。
2 结果
2.1 饲料及原料的表观消化率
表 3和表 4结果显示, 黄颡鱼对4种饲料及原料的干物质、蛋白质和能量的表观消化率结果相似,发酵菜粕饲料及原料的表观消化率最低, 干物质和蛋白质表观消化率最低, 且与其他饲料及原料差异显著(P<0.05), 能量表观消化率均没有显著性差异(P>0.05)。比较发酵与非发酵原料显示, 黄颡鱼对豆粕与发酵豆粕之间各表观消化率没有显著性差异(P>0.05), 对发酵菜粕的蛋白质表观消化率显著低于菜粕(P<0.05), 干物质及能量表观消化率没有显著性差异(P>0.05)。

表 3 黄颡鱼对4种饲料干物质、蛋白质和能量的表观消化率Tab. 3 The apparent digestibility coefficients (ADCS) of dry matter,protein and energy in four diets for Pelteobagrus fulvidraco (%)
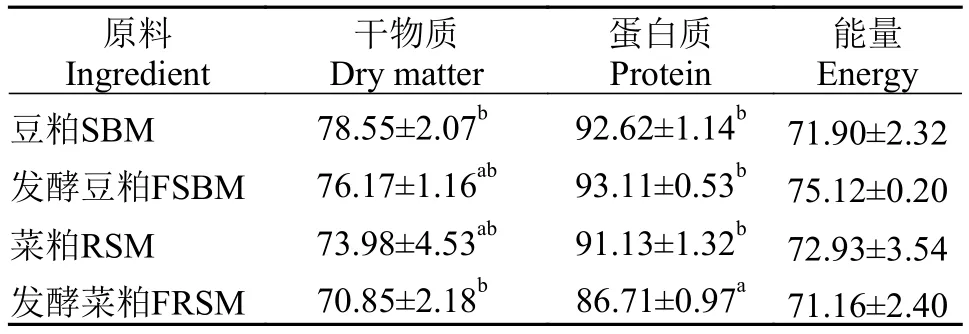
表 4 黄颡鱼对4种原料的干物质、蛋白质和能量的表观消化率Tab. 4 The apparent digestibility coefficients (ADCS) of dry matter, protein and energy in four ingredients for Pelteobagrus fulvidraco (%)
表 5显示, 黄颡鱼对不同原料的16种氨基酸的表观消化率有较大的差异, 氨基酸表观消化率的变化规律与蛋白质表观消化率的变化基本一致, 发酵菜粕中氨基酸的利用率均显著低于其他饲料组(P<0.05), 其他氨基酸的利用率均在85%—98%。蛋氨酸和组氨酸消化率最低, 均低于83%, 各组没有显著性差异(P>0.05), 精氨酸和谷氨酸的消化率较高, 都在93%以上; 豆粕和发酵豆粕中的天冬氨酸、丝氨酸、亮氨酸和异亮氨酸的利用率显著高于菜粕和发酵菜粕组, 菜粕中脯氨酸的利用率要显著高于其他组(P<0.05)。
2.2 消化酶活性
表 6显示, 胰蛋白酶活力在胃里有显著性差异,其中菜粕组显著高于发酵豆粕组, 其他组织没有显著性差异。各组织胰蛋白酶活力呈现出前肠>中后肠>胃的趋势。
糜蛋白酶活力仅在中后肠组织表现出显著性差异, 发酵豆粕组最低, 豆粕组最高, 发酵菜粕次之,各组织糜蛋白酶活力呈现胃>前肠>中后肠的趋势。
淀粉酶活力在各组织没有显著性差异, 但摄食发酵菜粕淀粉酶活力要高于摄食其他原料, 各组织间淀粉酶活性呈现出前肠>胃>中后肠的规律。黄颡鱼属于有胃鱼类, 因此淀粉酶活力相对较高, 但对饵料的消化吸收主要是在前肠, 因此前肠淀粉酶活力要高于其他组织。
2.3 血液生化指标
表 7显示, 豆粕饲料组血液的谷草转氨酶(AST)显著高于其他组, 摄食菜粕与发酵菜粕没有显著性差异, 相对于豆粕和发酵豆粕低。
3 讨论
3.1 黄颡鱼对饲料原料干物质, 蛋白质和能量的表观消化率
干物质消化率的高低是衡量饲料原料总体消化水平的重要指标, 其与饲料中纤维素、灰分的含量及营养物质被吸收的程度有关[2]。在本实验条件下, 黄颡鱼对饲料原料干物质的表观消化率是随着原料灰分的含量增加而显著降低的, 这与Reigh 等[11]的研究结果一致。黄颡鱼对饲料原料干物质和能量的表观消化率总体偏低, 这可能是因为黄颡鱼是偏肉食性动物的原因, 其次可能是鱼类缺乏消化纤维素的酶系统, 植物性原料中含有一些鱼类难以消化的碳水化合物, 如纤维素、半纤维素、木质素等,因此可能会对鱼类能量的消化产生负面影响[12,13]。此外, 这些物质的还可能降低鱼体对其他营养物质的利用[12,13]。

表 5 黄颡鱼对4种原料氨基酸的表观消化率Tab. 5 The apparent digestibility coefficients (ADCS) of amino acids in four ingredients for Pelteobagrus fulvidraco (%)

表 6 摄食4种原料对黄颡鱼活力的影响Tab. 6 Effects of four ingredients on digestive enzyme activity of Pelteobagrus fulvidraco
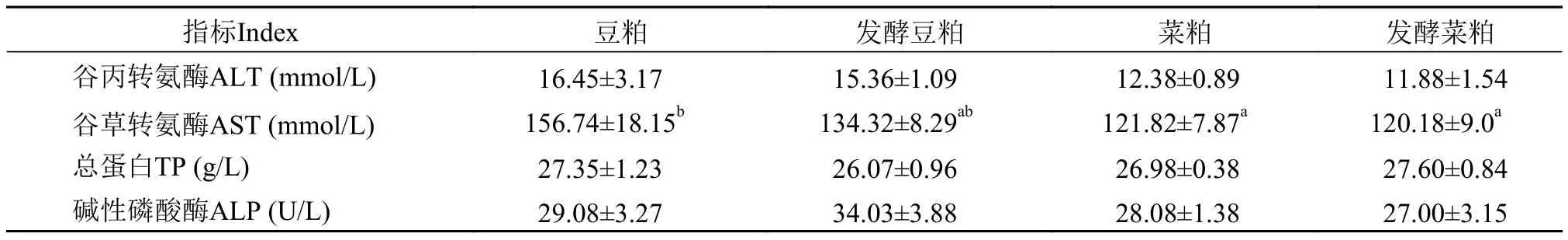
表 7 四种饲料原料对黄颡鱼血液生化指标的影响Tab. 7 Effects of four ingredients on blood biochemical parameters of Pelteobagrus fulvidraco
本研究表明黄颡鱼对豆粕、发酵豆粕和菜粕的蛋白质的表观消化率均在90%以上, 其中发酵豆粕的蛋白和能量的利用率最高, 说明黄颡鱼能够较好的利用这些植物蛋白, 其中发酵后的豆粕更能有效利用, 这可能是发酵降低豆粕中胰蛋白酶抑制因子、植酸、大豆凝集素、寡糖、抗原蛋白等的含量, 提高粗蛋白质、氨基酸、多种活性物质的含量[5,6]。比较其他研究[12,14,15], 鳙对豆粕和菜粕的蛋白质表观消化率分别是84.7%和83.7%, 吉富罗非鱼对豆粕和菜粕的利用是91.2%和85.7%, 均略低于黄颡鱼对豆粕和菜粕的利用。发酵菜粕的蛋白质和能量表观消化率则显著低于菜粕, 这可能与原料的发酵工艺有关, 不同的发酵工艺对植物蛋白原料的发酵效果不同, 如在菌株的选择差异上、菌株的组合差异及发酵时的环境因子等都能导致发酵效果的不同, 因此造成发酵后营养价值存在差异[16,17]。目前对发酵菜粕在水产动物表观消化率的研究还未见报道, 还无法与其他鱼类做出对比, 因此有待进一步研究。
3.2 黄颡鱼对饲料原料氨基酸的表观消化率
从生理方面来讲, 鱼类对蛋白质的需求实质上是对组成蛋白质的氨基酸的需求。然而由于鱼体不能合成必需氨基酸(EAA)或合成的量不足维持生理需求, 因此需从食物中获取某些必需氨基酸, 故了解饲料原料中EAA的消化率, 对饲料配方的设计及原料的选择显得尤为重要[12]。在本实验中, 黄颡鱼对各原料蛋白质的表观消化率与氨基酸的表观消化率变化基本一致。水解氨基酸总的表观消化率差异与饲料原料蛋白质的表观消化率差异相似,均表现为发酵菜粕组消化率显著低于其他组。本实验中黄颡鱼对各饲料原料的蛋氨酸、组氨酸有较低的表观消化率, 可能是因为植物蛋白氨基酸不平衡导致该氨基酸消化率较低; 其他氨基酸表观消化率均在85%—98%, 且均表现为发酵菜粕显著低于其他三种原料, 其中精氨酸和谷氨酸的消化率较高, 都在93%以上; 此外, 豆粕与发酵豆粕的天冬氨酸、丝氨酸、异亮氨酸和亮氨酸的表观消化率显著大于菜粕和发酵菜粕。在本实验中, 发酵菜粕大部分氨基酸的表观消化率均显著低于其他原料, 这可能是发酵菜粕不能被消化利用, 发酵菜粕中的氨基酸未被吸收, 其次氨基酸含量不平衡导致较低的消化率水平。总览氨基酸消化率, 不同原料中相同氨基酸及相同原料不同氨基酸的消化率均存在较大差异, 这与叶元土等研究结论相同[18]。Terrazasfierro等[19]指出在饲料加工过程中, 过高的温度会破坏部分氨基酸的分子结构使得在粪便中不能检测到, 从而导致消化率偏高。在鱼体中不同部位消化道的消化酶性质不同, 肠中提取的蛋白酶为碱性蛋白酶,在碱性条件下酶活性较高, 胃中蛋白酶为一种酸性蛋白酶, 在酸性条件下酶活性较高[20]。研究表明, 不同消化道部位的营养消化不同, 其酶活性也不同, 无论是有胃鱼还是无胃鱼以及鱼类的食性如何, 其前肠是消化蛋白质的主要场所[19], 本实验结果与该观点相一致。而后肠活性最差, 这可能与养分浓度和被消化程度有关, 也可能是饲料中抗营养物质在后肠造成明显病理变化的原因[21]。
3.3 四种原料对黄颡鱼各组织中消化酶活性的影响
糜蛋白酶是胰腺分泌的内切酶, 可专一性水解由芳香族氨基酸或带有较大非极性侧链的氨基酸羧基形成的肽键[22]。糜蛋白酶活性在本实验条件下在胃组织里活性最高, 前肠的糜蛋白酶活性要高于中后肠, 该结果跟其他研究者的观点相似, 认为大多数鱼类肠黏膜层分泌蛋白酶的能力由前向后逐渐减弱[23]。
淀粉酶主要是肝胰脏分泌, 有些鱼类的肠道也是分泌淀粉酶的重要器官, 鱼类对食物中淀粉的消化能力与淀粉酶分泌机能的强弱直接相关[21—24]。本实验结果表明前肠淀粉酶活性高于胃组织淀粉酶活性, 中后肠淀粉酶活性最低, 该结论与王宏田等[25]和余德光等[26]对牙鲆消化道淀粉酶的研究结果相似。谷草转氨酶(AST)和谷丙转氨酶(ALT)是细胞线粒体中重要的氨基转移酶, 主要参与氨基酸代谢, 广泛存在于肝脏中。当组织受损时, 细胞膜渗透增大, 细胞内的转氨酶大量释放进入血液中,使得血清中转氨酶的活性升高[27]。因此, 血清中AST和ALT的活性可作为鱼类评价肝脏损伤程度以及确定一些营养素需求量的重要指标。本实验豆粕饲料组谷草转氨酶显著高于其他组, 这可能是大豆中的抗营养因子影响了机体对蛋白质的代谢。孙玲[28]研究表明, 豆粕中含有大豆抗原, 而大豆抗原能引起血浆转氨酶活性的升高, 同时还会影响组织消化酶活性, 抑制蛋白酶的分泌。
本实验研究表明, 黄颡鱼对4种饲料营养物质的表观消化率均较高, 饲料原料干物质的表观消化率在70.85%—78.55%, 其利用率依次为豆粕、发酵豆粕、菜粕及发酵菜粕, 蛋白质的表观消化率较高,均在90%以上, 能量的表观消化率在81.75%—86.15%,说明这些饲料原料均可作为黄颡鱼饲料中的蛋白来源。

