养殖施氏鲟的性腺转录组特征分析
李 营 阮 瑞 艾 成 岳华梅 叶 欢 杜 浩 李创举
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 中国水产科学研究院长江水产研究所, 农业农村部淡水生物多样性保护重点实验室, 武汉 430223; 3. 中国农业科学院深圳农业基因组研究所, 深圳 518120)
鲟属于硬骨鱼纲(Osteicthyes)、辐鳍亚纲(Actinopterygii)、软骨硬鳞总目(Chondrostei)、鲟形目(Acipenseriformes), 包括匙吻鲟科(Polyodontidae)和鲟科(Acipenseridae)。鲟卵做成的鱼子酱富含人体必需氨基酸、多种不饱和脂肪酸、维生素等物质,营养价值极高, 享有“黑色黄金”的美誉。随着过度捕捞和栖息地破坏等, 鲟野生资源量快速下降, 而国际上对鲟鱼子酱的需求逐年增加[1]。因此, 鲟人工养殖业越来越重要, 并已成为鲟鱼子酱等消费品的主要来源。
鲟雌雄个体之间没有明显的第二性征, 无法从形态上辨别雌雄。目前, 其性别鉴定方法主要有超声波技术探测法[2,3]、内窥镜观察法[2,4]、外科手术性腺检查法[5]和血液激素水平测量法[6]。但是, 一般在鲟3—5龄时通过腹腔外科手术等方法鉴定时具有较高的准确性[5]。此外, 通过ISSR(Inter Simple Sequence Repeat)、AFLP(Amplified Fragment Length Polymorphisms)和RAPD(Random Amplification of Polymorphic DNA)等不同分子标记技术来检测了西伯利亚鲟(Acipenser baeriiBrandt)、俄罗斯鲟(Acipenser gueldenstaedtiiBrandt & Ratzeburg)、小体鲟(Acipenser ruthenusLinnaeus)、意大利鲟(Acipenser naccariiBonaparte)、湖鲟(Acipenser fulvescensRafinesque)、波斯鲟(Acipenser percicusBorodin)、欧洲鳇(Huso husoLinnaeus)、施氏鲟(Acipenser schrenckiiBrandt)和中华鲟(Acipenser sinensisGray)等物种的雌雄个体基因组差异, 都未获得鲟性别特异性DNA分子标记[7—12]。由于不能及早鉴定鲟性别, 导致人工养殖过多雄性个体而造成资源浪费, 增加养殖成本。
研究发现Dmrt1、Sox9、Foxl2等性别分化相关基因在鲟雌雄个体或不同发育阶段性腺组织上呈现性别二态性表达[13—18]。目前, 已初步对施氏鲟[19]、中华鲟[20]、意大利鲟[21]和俄罗斯鲟[22,23]等性腺进行转录组测序分析, 以及Zhang等[24]对施氏鲟性腺中miRNAs进行分析发现精巢和卵巢分别存在71和46个偏好表达的miRNAs, 以上研究为鲟性腺发育提供了大量的遗传信息。而鲟性成熟时间长、雌雄性腺发育不同步, 其性腺发育相关分子基础研究仍相对薄弱。
施氏鲟隶属于鲟科、鲟属(Acipenser), 主要分布于黑龙江水系, 其染色体数量为(238±8)条[25]。本研究拟通过高通量测序分析人工养殖2龄施氏鲟个体精巢和卵巢的转录组表达特征, 筛选与性别决定和分化相关差异表达基因, 揭示参与鲟雌雄个体性腺发育的主要代谢通路表达模式, 为今后鲟性别分子标记开发和性腺发育等研究提供分子基础数据。
1 材料与方法
1.1 样本采集
采集人工养殖2龄施氏鲟雌雄各5尾, 取其性腺组织分别保存于液氮和Bouin’s固定液, 分别用于性腺组织转录组测序和性腺组织石蜡切片。10尾样本平均全长为(82.6±3.2) cm, 平均体重为(1.89±0.43) kg。通过肉眼可以分辨其性腺组织和脂肪,雌性性腺呈浅红色且表面有褶皱, 雄性性腺呈白色且表面光滑。
以上实验鱼采样过程遵照实验动物福利及使用制度, 并获得中国水产科学研究院长江水产研究所实验动物福利伦理委员会批准。
1.2 性腺组织石蜡切片
将性腺组织保存于Bouin’s溶液置4℃固定24h,并转移至70%乙醇长期保存备用。固定后的样品经70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%乙醇Ⅰ、100%乙醇Ⅱ梯度脱水, 二甲苯透化,浸蜡, 包埋, 连续切片, 切片厚度为4 μm。将切片进行二甲苯脱蜡, 乙醇浓度由高到低水分浸透, 苏木精-伊红染色, 乙醇梯度脱水, 中性树胶封片, 于DM5000B正置荧光显微镜(Leica, 德国)下观察拍照。
1.3 转录组测序与分析
利用RNeasy Plus Mini Kit试剂盒(QIAGEN, 德国)提取性腺组织总RNA, 并经过1.5%琼脂糖凝胶电泳初步分析RNA降解程度以及是否有污染, Nano-Drop Lite超微量核酸检测仪(Thermo Scientific, 美国)检测其浓度和纯度。将样品送往北京诺禾致源科技股份有限公司进一步进行样品质检、测序文库构建和Illumina HiSeq4000平台进行双向150 bp测序。
对高通量测序的原始序列进行低质量序列过滤得到高质量有效序列。由于施氏鲟无参考基因组数据, 本研究通过Trinity软件[26]对有效序列进行组装得到施氏鲟转录本, 并取每个基因中最长的转录本作为Unigene。结合pfam和uniprot数据库, 利用Trinity软件自带的transdecoder模块对Unigenes进行开放阅读框(Open Reading Frame, ORF)预测并翻译成蛋白序列, 将能够预测ORF的Unigenes集合作为后续分析的基因转录本。将得到的蛋白序列与Swissport、KEGG、Interproscan、GO数据库进行比对与功能注释。基因表达水平通过RSEM软件[27]以上述的基因转录本作为参考序列进行分析。采用DESeq软件[28]进行基因表达差异分析, 筛选标准为P<0.001和|log2(fold-change)|≥1。使用Kobas软件[29]进行差异表达基因KEGG富集分析, 显著性通过Benjamini & Hochberg方法校正。

表 1 实时定量PCR引物序列表Tab. 1 Primer sets used for quantitative real-time PCR
1.4 实时定量PCR验证转录组差异表达基因
依据转录组差异表达分析结果, 选取2个与性别分化相关和10个参与卵巢类固醇合成相关的差异表达基因进行实时定量PCR验证。根据转录组的基因序列通过Oligo7设计引物。选择扩增效率在90%—110%且相关系数R2>0.98的引物作为后续实验的引物(引物序列如表 1)。利用PrimerScript®RT reagent Kit With gDNA Eraser试剂盒(TaKaRa, 日本)合成cDNA模板, 使用TB®Premix ExTaqTMII(Takara, 日本)配置20 μL反应体系, 体系包括TB Premix ExTapⅡ 10 μL、ROX Reference Dye Ⅱ0.4 μL、引物分别为 0.8 μL、cDNA模版2 μL、ddH2O 6 μL。利用QuantStudio6 Flex Real time PCR仪(Ap-plied Biosystems, 美国)进行荧光定量PCR反应, 反应程序: 95℃ 2min; 95℃ 15s, 60℃ 15s, 72℃ 15s,共40个循环。实验中每个样品设置3个重复及空白对照, 以β-actin作为内参基因, 利用2-ΔΔCt方法计算目的基因在样品中的相对表达量, 用SPSS 20.0软件的Kruskal-Wallis检验法统计其显著性。
2 结果
2.1 性腺组织石蜡切片观察
通过石蜡切片对施氏鲟性腺进行组织学分析,并根据鱼类性腺分期标准[30]以及西伯利亚鲟性腺分期研究[31]为参考, 确定5个卵巢样本中的生殖细胞主要以Ⅱ期的初级卵母细胞为主, 细胞质增多且呈嗜碱性, 细胞核相应增大, 少量核仁靠近核膜环形分布(图 1C)。可以判断5个卵巢样本发育时期为Ⅱ期。其中4个精巢样本(AcSc_M1、AcSc_M3、AcSc_M4和AcSc_M5)的生殖细胞多为精原细胞,少量的精原细胞开始进行有丝分裂, 判断其发育时期处于Ⅱ期(图 1A)。而精巢样本AcSc_M2的组织切片发现有初级精母细胞、少量的精子细胞和延长的精子细胞, 说明其发育时期相比其他精巢靠后,认为其处于Ⅲ期末(图 1B)。
2.2 转录组数据基础分析
雌雄各5个性腺样品经过转录组高通量测序、原始数据过滤后共计获得84.25 Gb有效数据。每个样品的数据信息如表 2所示, 其有效数据已上传至NCBI的Sequence Read Archive (SRA)数据库(Gen-Bank登录号: PRJNA509354)。通过Trinity软件将有效数据进行从头组装、ORF预测后共计获得99919个基因, 序列的平均长度为1123 bp,N50为1909 bp。其中, 52842个基因被注释到Swissprot蛋白数据库, 33066个和15156个基因分别被注释到GO数据库和KEGG数据库。
按P<0.001和|log2(fold-change)|≥1标准进行差异表达基因筛选, 共获得19690个差异表达基因。利用样品差异表达基因的表达量分别对样本相关性进行分析, 结果表明10个测序样品按照精巢和卵巢分成两组, 但精巢样品AcSc_M2与其余4个精巢样品相关性相对较低(R2<85%; 图 2)。因此, 在后续转录组数据分析时将AcSc_M2样本去除。

图 1 施氏鲟性腺组织切片Fig. 1 Gonadal tissue sections of Amur sturgeon
2.3 筛选与性别决定和分化相关差异表达基因
选取与性别决定与分化相关基因Dmrt1、Amh、Gata4、Ar、Cyp11a、Foxl2、Figla、Bmp15、Gdf9、Gsdf、Wnt4、Sf1、Cyp19a1、Cyp11b、Lhx9以及Sox基因家族在施氏鲟转录组注释结果中进行查找比对。结果发现,Sox基因家族注释到13个(Sox1、Sox2、Sox4、Sox5、Sox6、Sox7、Sox8、Sox9、Sox10、Sox13、Sox14、Sox17、Sox30), 其中只有Sox5和Sox9具有差异性表达且都在精巢中高表达。此外,Dmrt1、Amh、Gata4、Ar、Cyp11a在精巢中显著高表达,Foxl2、Figla、Bmp15、Gdf9在卵巢中显著高表达。Gsdf、Wnt4、Sf1、Cyp19a1、Cyp11b、Lhx9等基因在精巢和卵巢中没有差异性表达(图 3)。
2.4 差异表达基因KEGG富集分析
通过差异表达基因KEGG富集分析, 发现19690个差异表达转录本被富集到410条KEGG通路, 其中56条通路被显著富集(Q<0.001), 图 4所示富集最显著的前30条通路。与性腺发育相关的代谢通路有黄体酮介导的卵母细胞成熟(Progesterone-mediated oocyte maturation)、卵母细胞减数分裂(Oocyte meiosis)、卵巢类固醇合成(Ovarian ste-roidogenesis)、促性腺激素释放激素信号通路(GnRH signaling pathway)等。
卵巢类固醇合成通路共注释到18个差异表达基因, 其中在精巢高表达的有:Lhr、Fshr、Insr、Igf1r、Ldlr、Adcy3、Adcy9、Cyp11a1、Cyp17a1、Cyp1a1和Hsd3b1, 而Adcy5、Adcy8、Cyp2j6、Hsd17b1、Cyp1b1、Bmp15和Gdf9在卵巢中高表达。差异表达基因在卵巢类固醇合成通路的分布如图 5所示, 图 5根据KEGG Pathway数据库提供的参考代谢通路模式图绘制。
2.5 差异表达基因定量PCR验证
选取参与卵巢类固醇合成通路的Bmp15、Cyp1a1、Cyp1b1、Gdf9、Hsd17b1、Hsd3b1、Cyp17a1、Fshr、Ldlr和Lhr, 以及与性别分化相关的Sox9、Foxl2 共12个基因进行实时荧光定量PCR验证。结果显示, 选取的12个基因在精巢和卵巢中呈现显著差异表达且表达趋势与转录组分析结果一致, 即Bmp15、Cyp1a1、Gdf9、Hsd17b1和Foxl2在卵巢中高表达, 其余7个基因在精巢中高表达(图 6)。以上验证结果表明本研究转录组测序分析结果是可靠的。

表 2 施氏鲟性腺转录组数据信息表Tab. 2 Information of gonadal transcriptome high-throughput sequencing from Amur sturgeon
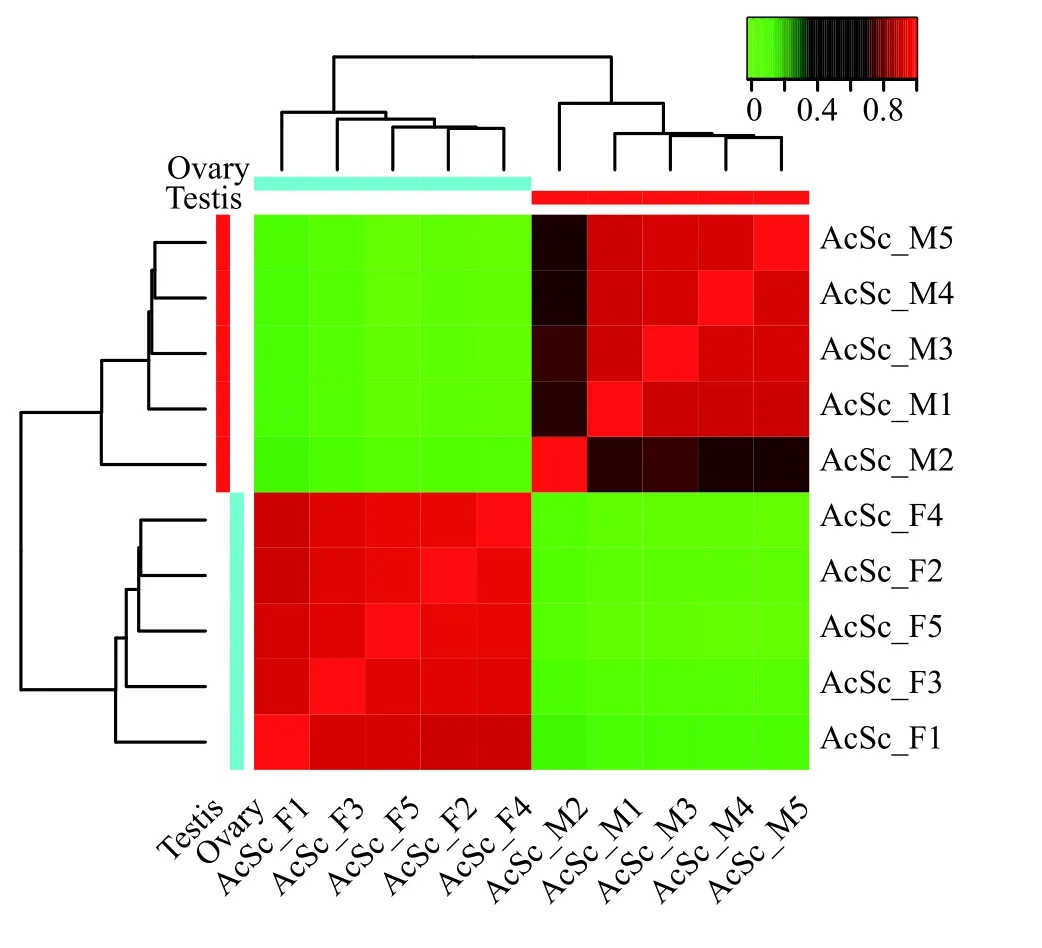
图 2 基于差异表达基因的表达量进行性腺样本相关性分析Fig. 2 Correlation analysis based on the relative expression level of differentially expressed gonadal genes
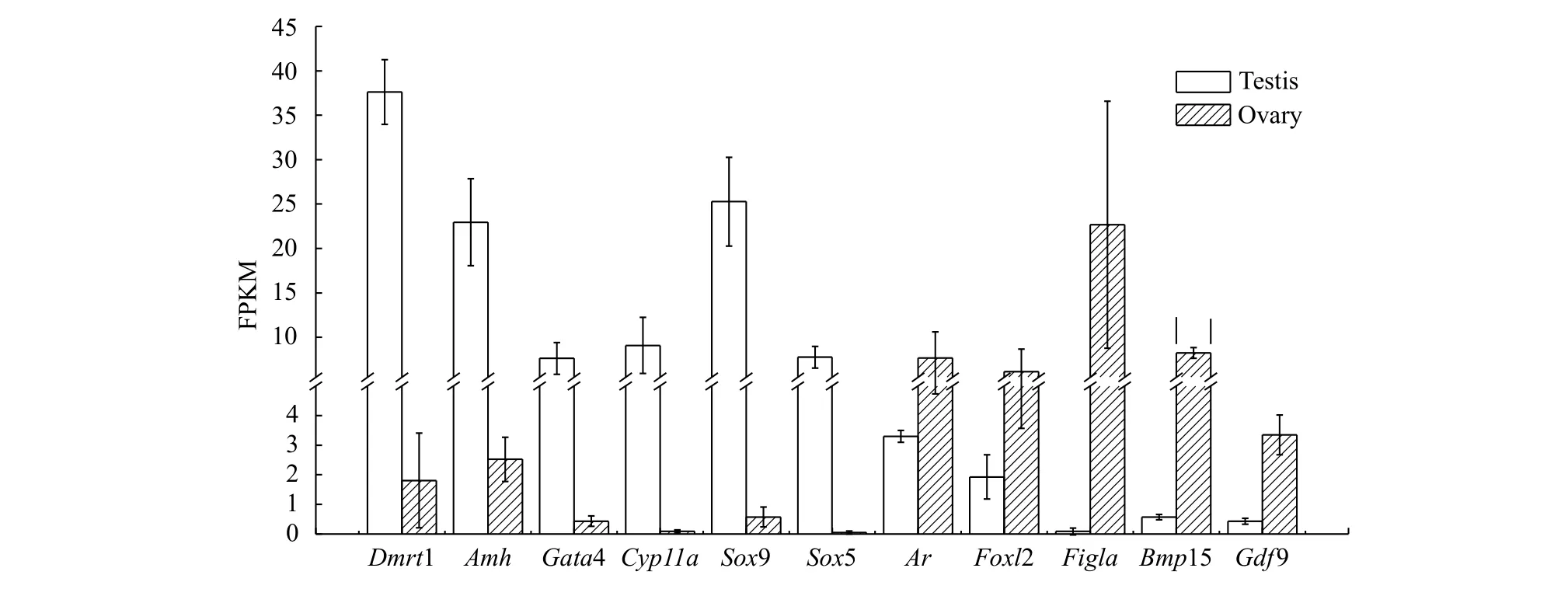
图 3 施氏鲟转录组中性别决定和分化相关差异表达基因的相对表达量Fig. 3 Expression profiles of differentially expressed genes involved in sex determination and differentiation in transcriptomes from Amur sturgeon
3 讨论
本研究对2龄人工养殖施氏鲟性腺进行转录组特征分析。首先通过性腺样本石蜡切片观察发现精巢样本AcSc_M2处于Ⅲ期末, 而另外4个精巢样本处于Ⅱ期、5个卵巢样本处于Ⅱ期。在自然条件下, 其雄性个体性成熟年龄为6—7龄, 雌性为9—11龄。章龙珍等[32]报道人工养殖下施氏鲟雄性个体4龄可以达到性成熟。以上表明人工养殖条件施氏鲟个体性腺发育存在差异, 且雄性个体发育较快。通过差异表达基因的表达量对10个样本进行相关性分析, 发现样本AcSc_M2虽然能够与其余4个精巢样本聚为一类, 但其相关性相对较低, 说明其基因表达模式与其余4个精巢样本存在较大差异,因此在后续差异表达分析中舍去。
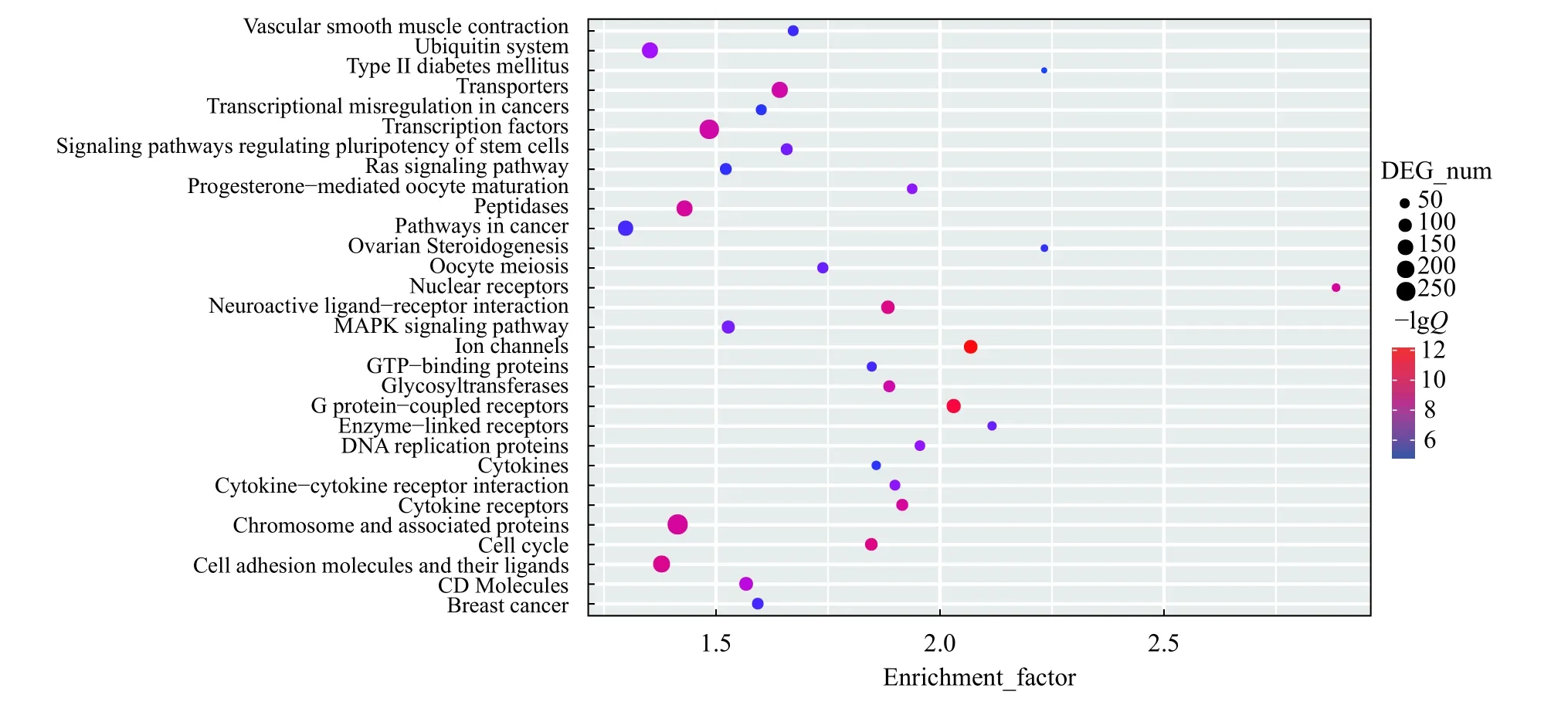
图 4 差异表达基因富集最显著的前30条KEGG通路Fig. 4 The top 30 most significantly enriched KEGG pathways based on the differentially expressed genes between the testis and ovary from two-year-old Amur sturgeon

图 5 差异表达基因在卵巢类固醇合成通路的分布(参考KEGG Pathway数据库提供的参考代谢通路模式图)Fig. 5 Distribution of differentially expressed genes in ovarian steroidogenesis (modified from the reference map of the KEGG Pathway)

图 6 实时定量PCR验证差异表达基因在性腺中的表达量Fig. 6 Relative expression levels of differentially expressed genes in gonads by real-time quantitative PCR
由于鲟为多倍体鱼类, 其染色体数量约为120条或240条以上, 目前还未发表基因组数据, 而且利用常规技术没有鉴定到鲟性别特异性分子标记。本研究通过转录组数据查找与性别相关基因,共注释到28个, 差异表达基因11个。其中,Dmrt1和Sox9作为雄性性别决定与分化以及性腺发育的重要转录因子, 并在多种鱼类中研究也表明其在雄性性腺高表达, 如罗非鱼(Oreochromis niloticusLinnaeus)[33]、虹鳟(Oncorhynchus mykissWalbaum)[34]、青鳉(Oryzias latipesTemminck & Schlegel)[35]、斑马鱼(Danio rerioHamilton)[36]、西伯利亚鲟[13,14]等。Foxl2是叉头框转录因子超家族成员之一, 在脊椎动物卵巢分化和发育中起重要作用。目前, 施氏鲟、欧洲鳇、小体鲟等研究中发现Foxl2在卵巢中高表达[15—17]。此外, 研究表明Foxl2可以调控Cyp19a1的转录表达[37], 且Cyp19a1能够促进肝脏卵黄蛋白原的合成, 确保卵子发生早期卵母细胞的正常发育和卵黄积累[38]。但是本研究中2龄施氏鲟性腺转录组分析中未发现Cyp19a1呈现差异性表达,而且其在精巢和卵巢转录组中的表达量相对很低(RPKM<0.5)。在欧洲鳇研究中, 表明Cyp19a1主要在卵黄形成早期和初期高表达, 暗示其可能与欧洲鳇卵黄合成有关[15]。Amh是一种以多肽形式存在的转化生长因子β (TGF-β)超家族成员, 能够抑制缪勒氏管的形成, 阻止卵巢的形成, 使性腺向精巢发育, 是雄性性别分化的重要因子。研究表明鱼类中并没有缪勒氏管, 但发现存在Amh或其同源基因,且表现为雄性性腺高表达, 如银汉鱼(Odontesthes hatcheriEigenmann)[39]。另外,Bmp15和Gdf9属于TGF-β超家族成员, 主要通过结合Ⅰ型和Ⅱ型两种Ser/Thr激酶受体进行信号转导, 发挥调节卵巢发育等生物学功能[40]。在欧洲海鲈(Dicentrachus labraxLinnaeus)[41]、虹鳟[42]、斑马鱼[43,44]和异育银鲫(Carassius auratus gibelio)[45,46]等鱼类研究中, 表明Bmp15和Gdf9表达水平随卵细胞发育而降低。本研究中Dmrt1、Sox9、Foxl2、Amh、Bmp15和Gdf9也都呈现出性二态表达模式, 可以为其性腺分化和发育研究提供基础, 同时为从mRNA水平上及早鉴定施氏鲟性别提供了借鉴。
通过差异表达基因KEGG富集分析, 发现卵巢类固醇合成通路被显著富集。卵巢类固醇合成通路主要功能是合成雌二醇、黄体酮。按照双细胞双促性腺激素理论(two-cell/two-gonadotropin theory),首先卵泡膜细胞在LH作用下产生相应酶将胆固醇转化为雄激素(雄烯二酮和睾酮), 雄激素通过扩散进入颗粒细胞, 在FSH信号通路作用使颗粒细胞芳香化酶活性增强将雄激素转变为雌酮和雌二醇。而发育早期的雄性个体则通过GnRH调控LH激活雄激素合成相关酶, 以及与LH受体结合激活cAMP磷酸化途径激活芳香化酶的转录[47—49]。在本研究中, 发现Ⅱ期卵巢中Lhr、Insr、Igf1r、Ldlr、Fshr基因表达量显著低于Ⅱ期精巢, 而这些受体基因在卵巢中的低表达可能抑制卵巢雌激素的合成,但精巢中雄激素的合成可能未受影响。同时,Bmp15能够明显抑制FshrmRNA的表达, 从而使Fsh诱导的P450arom表达减少[50—53];Gdf9能够通过抑制Fsh诱导的cAMP的产生, 进一步抑制颗粒细胞产生雌激素和孕酮[51,54]。另外, 睾酮生成关键酶Cyp1b1、Cyp17a1和Hsd3b1在施氏鲟Ⅱ精巢中的表达量更高, 可能促进雄激素的产生和维持精巢组织的发育。综上所述, 2龄施氏鲟雌性个体可能通过限制雌激素的合成使卵细胞处于减数分裂阻滞期, 而雄性个体保持精巢发育, 这可能是导致鲟雌雄发育不同步的原因, 同时为今后研究鲟性腺发育提供了参考。

