斜带石斑鱼L-氨基酸氧化酶基因克隆及表达分析
杜贾贾 江 飚 唐嘉嘉 李安兴
(中山大学生命科学学院,中山大学有害生物控制与资源利用国家重点实验室,广东省水生经济动物繁育重点实验室,广州 510275)
L-氨基酸氧化酶(L-amino acid oxidase, LAAO)是一类特异性氧化L-氨基酸生成α-酮酸、氨和H2O2的黄素蛋白酶[1—3], 广泛存在于自然界的各种生物中: 细菌、真菌、藻类、鱼类和哺乳动物等[4]。目前, 蛇毒LAAO研究最为深入, 其含量丰富, 性质稳定, 并且生物活性较广[5—8]。研究表明, LAAO具有抑制细菌生长、杀伤寄生虫、诱导细胞凋亡和降低艾滋病毒活性等功能, 在脊椎动物和无脊椎动物的免疫防御中发挥重要作用[9—12]。
目前关于鱼类LAAO仅见少量报道。Nagashima等[13]和Kitani等[14]分别从许氏平鲉(Sebastes schlegeli)皮肤黏液和血清中分离纯化出LAAO, 体外试验表明其具有良好抗菌活性。Nagashima等[9]还从棘头床杜父鱼(Myoxocephalus polyacanthocephalus)皮肤黏液中分离纯化出LAAO, 发现其同样具有良好抑菌活性, 进一步研究发现, 加入过氧化氢酶后, 其抗菌能力完全丧失, 推测其抗菌活性与H2O2有关。Wang等[15]从黄斑篮子鱼(Siganus oramin)血清中分离纯化的LAAO不但可抑制金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)的活性, 还可有效杀灭刺激隐核虫(Cryptocaryon irritans)幼虫和布氏锥虫(Trypanosoma brucei); 篮子鱼LAAO能引起刺激隐核虫幼虫纤毛脱落, 大核肿胀, 外膜破裂和胞质渗出, 导致幼虫死亡[16,17]。在自然条件下, 篮子鱼是刺激隐核虫非易感宿主, LAAO可能是其抵抗刺激隐核虫感染的主要因素[18]。
近年来, 斜带石斑鱼(Epinephelus coioides)养殖渔业快速发展, 但随着养殖密度增加和近海岸水质恶化, 刺激隐核虫病大量暴发, 给养殖业造成巨大的损失[19,20]。该实验室前期转录组结果显示, 在感染刺激隐核虫后, 石斑鱼LAAO表达量变化明显, 推测其可能参与了石斑鱼抵抗病原感染的免疫应答。为进一步了解石斑鱼LAAO的基因序列特征和在刺激隐核虫胁迫中的表达模式, 该研究克隆获得石斑鱼LAAO基因, 并对其序列结构特征进行分析,检测其在组织分布情况和刺激隐核虫感染后的表达情况。
1 材料与方法
1.1 试验用鱼与刺激隐核虫
斜带石斑鱼(90—110 g)购自广东省海洋渔业试验中心, 随机选取3条进行体表寄生虫检查, 同时将石斑鱼血清两倍稀释后取100 μL, 56℃ 30min孵育以灭活补体, 随后加入100 μL含200个刺激隐核虫幼虫的灭菌海水, 室温孵育1h后, 使用倒置显微镜观察其是否出现游动缓慢, 纤毛交联, 虫体凝集等阻动现象, 以确保试验用鱼未感染过刺激隐核虫[21]。
试验前暂养两周, 每天投喂2次商业颗粒饲料,日投喂量为鱼体重的2%—3%。
根据Dan等[22]的刺激隐核虫传代方法, 从感染了刺激隐核虫的卵形鲳鲹(Trachinotus ovatus)中分离得到包囊, 收集幼虫以进行石斑鱼感染实验。
1.2 RNA提取和基因克隆
根据说明书步骤, 使用RNAiso Plus(TaKaRa)提取斜带石斑鱼头肾RNA, 用1.2%琼脂糖凝胶电泳和A260/A280分别检测RNA完整性和纯度。利用Rever-Tra Ace反转录试剂盒(TOYOBO)进行cDNA第一链的合成。
石斑鱼转录组测序结果中有两段序列注释到LAAO上,EcLAAO-1和EcLAAO-2。据此设计特异性引物(表 1), 以石斑鱼cDNA为模板, 使用Prime-STAR HS DNA高保真聚合酶(TaKaRa)进行扩增,PCR程序为98℃ 3min; 98℃ 10s, 60℃ 15s, 72℃2min, 35个循环; 72℃ 8min。阳性条带用胶回收试剂盒(Omega)进行回收纯化, 加A尾后与PMD19T(TaKaRa)质粒连接, 转入DH5α感受态细胞, 经菌液PCR验证后的阳性克隆进行测序验证。

表 1 试验所用引物Tab. 1 Primers used in the study
1.3 分子特征和进化分析
使用ORF-Finder(https://www.ncbi.nlm.nih.gov/orffinder/)分析测序结果的开放读码框, ExPAsy(https://web.expasy.org/compute_pi/)预测蛋白分子量与等电点, SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)分析信号肽序列, Smart Main Page(http://smart.embl-heidelberg.de/)分析蛋白保守结构域, NetNGlyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)分析N-糖基化位点, NCBI BLASTp(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行氨基酸多序列比对, MEGA7.0软件邻接法构建系统进化树。
1.4 LAAO基因组织表达分析
根据Jiang等[23]石斑鱼组织样品采集方法, 麻醉后取样3尾健康石斑鱼鳃、皮肤、胸腺、肝脏、脾脏、中肠、后肠、头肾、尾肾、肌肉、心脏和大脑共12个组织。参照1.2方法提取组织样品RNA,并根据PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa)说明书步骤将其反转录为cDNA样品。根据测序结果设计荧光定量引物(表 1), 以组织cDNA为模板,β-actin为内参基因, 使用SYBR Green Real-time PCR Master Mix(TaKaRa)试剂, 在荧光定量PCR仪(Roche LightCycler 480)上进行定量分析,扩增反应程序为: 95℃ 3min; 95℃ 5s, 60℃ 30s,40个循环, 每个组织样品3个重复。根据溶解曲线分析扩增产物的特异性, 使用2-ΔΔCt法计算目标基因的相对表达量[24]。
1.5 刺激隐核虫感染后LAAO的表达模式
将石斑鱼随机分为两组: 感染组和对照组, 每组40尾鱼。参照Dan等[22]的刺激隐核虫传代和感染方法, 感染组感染剂量为1.0×104幼虫/鱼, 5 L海水/鱼, 感染2h后将试验鱼转移至含干净海水的桶中养殖, 对照组则放在不含刺激隐核虫幼虫的水体中以同样方式处理。在感染后6h、12h、24h、48h和72h时间点, 感染组和对照组分别取3尾鱼的鳃和脾脏组织, 参照1.4的方法提取组织RNA、合成cDNA和采用RT-PCR分析感染后石斑鱼LAAOmRNA表达量变化。使用SPSS软件独立样本t检验进行试验组和对照组的差异显著性分析, 显著性水平设为P<0.05。
2 结果
2.1 斜带石斑鱼LAAO cDNA克隆及序列特征
该试验克隆获得了EcLAAO-1和EcLAAO-2 cDNA序列, ORF长度分别为1536和1569 bp, 编码511和522个氨基酸, 理论蛋白分子量大小为56.75和58.52 kD, 等电点为6.29和6.20。两个蛋白都有信号肽序列(1—28 aa); EcLAAO-1含跨膜结构(5—27 aa),位于信号肽序列内, EcLAAO-2无跨膜结构; 经SMART软件分析两者都包含Amino_oxidase结构域(67—507 aa、71—501 aa); 序列分析显示皆含LAAO保守序列: DBM(64—87 aa、68—91 aa)和GG motif(91—98 aa、95—102 aa); NetNGlyc软件分析N-糖基化位点表明: EcLAAO-1有5个糖基化位点, EcLAAO-2含3个糖基化位点。
2.2 同源性分析
氨基酸序列比对显示, EcLAAO-1与EcLAAO-2序列相似度为61.09%, 皆与其他鱼类氨基酸序列有较高的一致性, EcLAAO-1与尖吻鲈相似度高达90.61%, EcLAAO-2与大黄鱼LAAO蛋白相似度最高, 为78.90%。但与哺乳动物序列一致性相对较低, 例如EcLAAO-1和EcLAAO-2与大鼠的相似度分别为47.9%和47.71%。与不同物种的LAAO氨基酸序列多重比对显示, 不同物种间氨基酸序列存在差异, 但Amino_oxidase结构域高度保守。
MEGA7.0邻接法构建进化树结果显示, 硬骨鱼LAAO的14个分子聚为一支, 并与爬行纲、鸟纲和哺乳纲聚为一大支, 腹足纲则位于另一支。在硬骨鱼纲中, EcLAAO-1与伯氏朴丽鱼、奈氏朴丽鱼和斑马拟丽鱼聚在一支; EcLAAO-2与贝氏隆头鱼聚为一支(图 1)。
2.3 组织表达分析
为研究LAAO在健康石斑鱼各组织的分布情况, 使用RT-PCR对12个组织进行了分析, 结果显示,EcLAAO-1和EcLAAO-2在石斑鱼12个组织中都有表达。2个基因均在皮肤、鳃、胸腺、肌肉和肝脏中有较高的表达量, 心脏、脑、脾脏、头肾和后肾中表达量则较少, 但EcLAAO-1在中肠和后肠表达量较高, 而EcLAAO-2则在肠道组织中表达量较低(图 2)。

图 1 LAAO系统进化树Fig. 1 Phylogenetic tree of LAAO
2.4 刺激隐核虫感染后LAAO的表达模式
该试验采用RT-PCR分析石斑鱼感染刺激隐核虫后不同时间点LAAO表达特性的变化, 结果显示,刺激隐核虫感染后, 石斑鱼鳃和脾脏LAAO表达量均出现明显升高(P<0.05)。鳃组织EcLAAO-1,Ec-LAAO-2表达量在感染后迅速上升, 第12h达到峰值,第24h显著下降(P<0.05), 随后EcLAAO-1恢复到对照组水平, 而EcLAAO-2仍显著低于对照组(P<0.05)。脾脏组织中EcLAAO-1表达量在感染后第6h明显升高(P<0.05), 随后均保持高于对照组的表达水平。EcLAAO-2在感染早期(6h)表达量显著下降(P<0.05),第12h开始升高, 并在第24h达到最高值(P<0.05), 随后下降至对照组水平(图 3)。
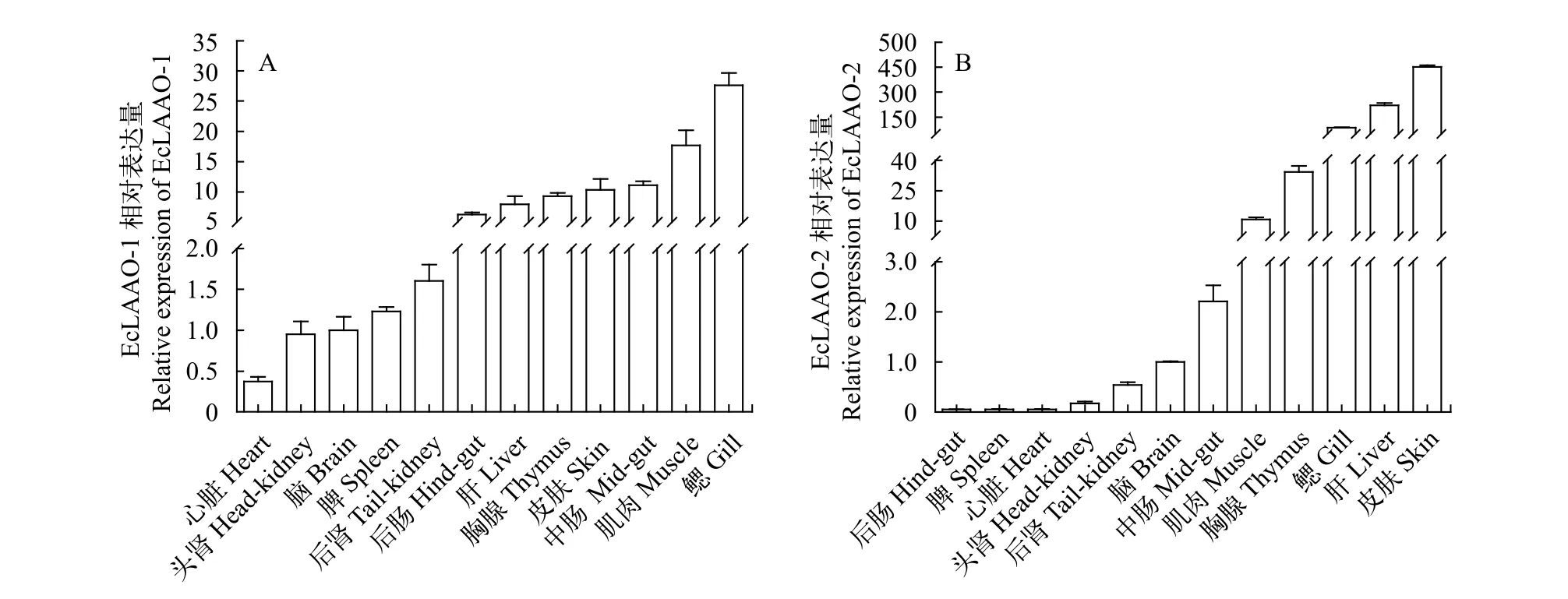
图 2 斜带石斑鱼不同组织中EcLAAO-1(A)和EcLAAO-2(B)表达量Fig. 2 Expression of EcLAAO-1(A) and EcLAAO-2(B) in different tissues of E. coioides
3 讨论
该研究克隆获得2个斜带石斑鱼LAAOcDNA序列, 并对其序列特征和感染刺激隐核虫后表达模式进行了分析。EcLAAO-1和EcLAAO-2理论蛋白分子量大小为56.75和58.52 kD, 与其他海洋动物的LAAO单体大小相近[25]。作为胞外分泌蛋白,LAAO具有信号肽序列[4], 预测结果显示2个石斑鱼LAAO序列均具有信号肽。研究表明, LAAO多为糖蛋白[5], 糖基化位点位于酶活性位点附近[26], 通过与靶细胞表面唾液酸结合性免疫球蛋白样凝集素结合从而锚定在细胞膜上, 随后生成高浓度的H2O2, 继而诱导细胞凋亡[27—29], 在石斑鱼EcLAAO-1和Ec-LAAO-2也分别发现了5个和3个N-糖基化位点, 推测其有助于LAAO与病原结合。保守结构域分析显示EcLAAO-1和EcLAAO-2均含Amino_ oxidase结构域(AOD), AOD结构在含黄素胺氧化酶家族中高度保守, 包括L-氨基酸氧化酶、单胺氧化酶和黄素单胺氧化酶, AOD结构包含三个子域: FAD结合域、螺旋域和底物结合域[30,31], 其中FAD作为LAAO的辅因子, 在酶促反应中催化电子转移[32]; 底物结合域和螺旋域可在酶表面形成Y型通道, 以便底物进入与活性位点结合, 产物释放, 均与酶发挥生物学活性紧密相关[5,33]。除此之外, 石斑鱼LAAO还具有LAAO保守序列: DBM和GG motif, DBM可与辅酶结合, GG-motif位于DBM序列后第四个氨基酸处, 可增加辅酶与LAAO结合的稳定性[5,34]。同时EcLAAO-1和EcLAAO-2氨基酸序列与其他硬骨鱼类LAAO具有较高的相似性, LAAO家族进化树分析也显示其聚为一支, 推测斜带石斑鱼LAAO与其他硬骨鱼类LAAO可能有着相似的结构和功能。
研究表明, 海洋动物LAAO具有较强的抗菌杀虫以及抗肿瘤作用[25,35—37], 广泛分布在鱼体的各个组织中, 包括皮肤黏液、血清、鳃和脾脏等[16]。斜带石斑鱼所有被检组织中均发现LAAO存在,Ec-LAAO-1和EcLAAO-2在皮肤、鳃、胸腺、肌肉、肝脏中都有较高的表达量。许氏平鲉[14]、黄斑篮子鱼[38]、棘头床杜父鱼[9]和大西洋鳕(Gadus morhua)[39]等硬骨鱼的鳃和皮肤也含有大量的LAAO。鳃和皮肤是鱼体与外界环境直接接触的场所, 也是重要的黏膜相关淋巴组织[40,41], LAAO在免疫器官中的大量存在可能有助于其抵抗病原入侵。鳃是刺激隐核虫主要寄生部位[42], 石斑鱼感染刺激隐核虫后,鳃组织EcLAAO-1和EcLAAO-2迅速响应, 在感染早期表达量显著上调, 表明鳃组织LAAO主要在感染早期参与机体的免疫应答, 而在感染中后期参与机体免疫应答的程度有所下降。脾脏是鱼体重要的外周免疫器官, 在鱼体固有免疫和获得性免疫中均发挥重要作用[43]。在刺激隐核虫感染后, 脾脏组织EcLAAO-1和EcLAAO-2表达量均出现显著变化, 但两者变化趋势存在差异, 脾脏组织EcLAAO-1在感染后均处于较高的表达水平, 而EcLAAO-2表达量变化则略为滞后, 出现先下调后上升的趋势, 而造成这种差异的调控模式还有待进一步研究。病原胁迫后LAAO表达量显著变化的现象在其他研究中也有报道, 黄斑篮子鱼鳃和脾脏LAAO在感染刺激隐核虫后, 表达量迅速上调, 24h达到峰值[38]; 在感染了无乳链球菌的罗非鱼肠道、肝脏和脾脏等组织均发现LAAO表达量升高[43]。大西洋鳕鱼感染鳗弧菌后48h, 皮肤、鳃、脾脏和头肾组织LAAO均出现明显上调[39]。LAAO在机体抵抗病原感染时大量表达, 推测其参与鱼体先天性免疫, 并在机体免疫调控中发挥重要的作用[38]。
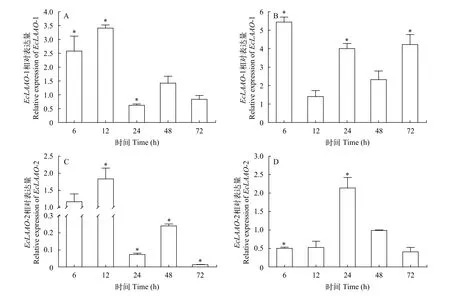
图 3 感染刺激隐核虫后LAAO在斜带石斑鱼鳃(A和C)和脾脏(B和D)组织中的表达量变化Fig. 3 The relative level of LAAO in the gill (A and C) and spleen (B and D) of E. coioides at various time points post C. irritans challenge
同工酶是催化相同反应但氨基酸序列不同的一类酶, 存在于生物同一种属或同一个体的不同组织内[45]。LAAO同工酶现象也有报道, 一种蛇毒中可同时存在酸碱性不同的LAAO[5]。鱼体中也含有多种不同类型LAAO, 棘头床杜父鱼皮肤黏液中分离纯化得到3种大小不同的LAAO, 其中LAAO-1和LAAO-3亚基大小相似, 与LAAO-2差异明显, 三者含量不同, 但均具有酶活性和抗菌能力[9]。许氏平鲉皮肤黏液和血清中也发现了几种结构不同的LAAO, 都具有抵抗细菌感染的能力, 但血清LAAO抗菌谱更宽, 在天然免疫系统中发挥更为重

