蜂房蜜蜂球菌环介导等温扩增检测方法的建立及应用
段进刚,陈建豪,杨荣荣,马春江
(哈密市动物疫病预防控制中心,新疆 哈密 839000)
蜜蜂欧洲幼虫腐臭病(Europe foulbrood,EFB) 是一种蜜蜂幼虫病,又称烂子病、黑幼虫病,是由蜂房蜜蜂球菌(Melissococcus pluton,MSP) 引起蜜蜂幼虫发病的一种恶性、细菌性传染病[1]。该病于1885 年首次在欧洲系统报道,目前广泛发生,其传播迅速快,危害性大,以3~4 日龄未封盖幼虫死亡为特征[2]。国际兽医局(OIE)将其列为B 类疫病。
该病为多种细菌综合作用所引起,其中以蜂房蜜蜂球菌为主要致病菌[3]。被污染的蜂蜜、花粉、巢脾是主要传染源。蜂房蜜蜂球菌能在尸体及蜜粉脾、空脾中存活多年,蜜蜂幼虫为主要感染对象,各龄及各个品种未封盖的蜂王、工蜂、雄蜂幼虫均可感染,尤以1~2 日龄幼虫最易感,成蜂不感染[4-6]。该病多发生于春季,夏季少发或平息,秋季可复发,但病情较轻。该病潜伏期一般为2`3 d,主要会引起3~4 日龄未封盖幼虫死亡、腐烂。死亡幼虫开始呈灰白色,不饱满,无光泽,死后虫体呈黄灰色,在巢房里腐烂,发出酸臭味,有渗出液,无黏性,不拉丝。该病为细菌感染引起,用抗菌素治疗可以得到较好的效果[7-10]。
近年来,欧洲蜜蜂幼虫腐臭病呈流行性趋势,并且在蜜蜂中危害更大,有的已造成重大经济损失,引起了人们的广泛关注和重视。目前,用于检测蜜蜂病原的诊断技术很多,LAMP 技术已用于检测多种蜜蜂病原微生物,如黑蜂王台病毒(Black queen cell virus,BQCV)、以色列急性麻痹病毒(Israel acute paralysis virus,IAPV)、欧洲幼虫腐臭病(Europe foulbrood,EFB)、美洲幼虫腐臭病(American foulbrood,AFB)、黄曲霉病(Stone brood,SB)、蜜蜂微孢子虫病等[11-16]。
在养蜂过程中,开盖检查对该病的预防有滞后性,光学显微镜检使用相对不可靠,PCR检测需要昂贵的仪器且核酸扩增反应时间较长。欧洲蜜蜂幼虫腐臭病的防控亟需准确、快速、方便且特性强的检测蜂房链球菌的方法。本研究以蜂房蜜蜂球菌16S rRNA 基因序列为保守序列设计6 条特异引物,建立特异检测蜂房蜜蜂球菌的LAMP 检测方法,丰富欧洲蜜蜂幼虫腐臭病分子检测手段,为基层快速诊断和预防该病提供了新的技术。
1 材料与方法
1.1 毒株与病料
蜂房蜜蜂球菌(Melissococcuspluton,MSP)、蜜蜂球囊菌(Ascosphaeraapis,APA)、蜜蜂残翅病毒(Deformed wing virus,DWV)、蜜蜂囊状幼虫病毒(Sacbrood virus,SBV)、黑蜂王台病毒(B lack queen cell virus,BQCV)、以色列急性麻痹病毒(Israel acute paralysis virus,IAPV) 均购自中国兽药监察所;疑似蜜蜂欧洲幼虫腐臭病幼虫及其他样品(100 份) 由本单位分离保存。
1.2 主要仪器和试剂
PCR 仪、凝胶成像仪、紫外分光光度仪、三气培养箱、离心机,均购自Thermo Fisher公司;高通量水平电泳仪及电泳槽,购自君意东方公司;恒温水浴锅、金属浴,购自GRANT 公司;移液器,购自Eppendorf 公司,电子天平购自北京赛多利斯公司。
RCR 扩增试剂盒购自TAKARA 公司,Bst DNA 聚合酶、10×ThermoPol 反应缓冲液购自自赛默飞生物技术有限公司公司;dNTPs、甜菜碱(betaine) 购自鼎国昌盛(北京) 有限公司;DL 2000 DNA Marker 购自TaKaRa 公司;硫酸镁(MgSO4) 购自天津市福晨化学试剂厂;溴化乙锭(EB) 和琼脂糖粉购自上海生工生物公司;细菌基因组DNA 抽提试剂盒购自上海生工生物公司;牛肉膏、蛋白胨均购自北京奥博星生物技术公司。
1.3 引物的设计与合成
检索GenBank 中的所有蜂房蜜蜂球菌的基因序列,通过DNAMAN 和DNASTAR 软件分析找出特异性的保守靶DNA 序列,然后再通 过 PrimerExplorer V5 在 线 软 件 (https://primerexplorer.jp) 设计出一套特异性的LAMP引物,包括两条外引物F3、B3,两条内引物FIP、BIP 及两条环引物FL、BL,上海生工生物工程公司合成,引物序列见表1。

表1 LAMP 扩增引物序列
1.4 蜂房蜜蜂球菌的培养及核酸的提取与验证
将疑似有蜂房蜜蜂球菌的蜜蜂样品在破碎机上打碎,然后按无菌操作取少量样品,加入少许无菌生理盐水制成悬浮液,用接种环蘸取悬浮液,以画线法接种于牛肉膏琼脂平板,置于37 ℃的培养箱中(5% CO2) 观察,24 h 后挑取单个菌落,接种于新的牛肉膏琼脂中,37 ℃培养24-48 h。蜂房蜜蜂球菌核酸提取,按生工生物工程(上海)有限公司细菌基因组小量提取试剂盒说明书的方法提取蜂房蜜蜂球菌DNA,并根据其PCR 特异性引物(F:5′-GAAGAGGAGTTAAAAGGCGC -3′;B:5′-TTATCTCAAGGCGTTCAAAGG -3′)验证,琼脂糖凝胶电泳条件为100 V,30 min。置-20 ℃保存备用。
1.5 LAMP 法体系的建立及优化
以蜂房蜜蜂球菌DNA 为模板,LAMP 反应体系如下:8 U Bst DNA 聚合酶,10×ThermoPol缓冲液,Mg2+终浓度为5~30 mmol/L,dNPTs终浓度为0~1.8 mmol/L,甜菜碱终浓度为0.4~1.4 mol/L,反应温度分别为54℃、56℃、58℃、60℃、62℃、64℃,反应时间10 min、20 min、30 min、40 min、50 min、60 min,内、外、环引物浓度比的优化,最后80℃热处理5 min 终止反应。反应在恒温水浴锅和金属浴中进行,用移液器取LAMP 扩增反应产物5 μL,加入到1.0%琼脂糖凝胶中电泳,经凝胶成像仪检测得到结果。在优化反应体系及反应条件时都必须进行多次重复实验,根据试验结果的稳定性,最终确定最佳的浓度及最佳温度和时间。
1.6 LAMP 与PCR 方法特异性检测
用优化好的LAMP 方法和PCR 方法分别将蜜蜂球囊菌(Ascosphaera apis,APA)、蜜蜂残翅病毒(Deformed wing virus,DWV)、蜜蜂囊状幼虫病毒(Sacbrood virus,SBV)、黑蜂王台病毒(Black queen cell virus,BQCV)、以色列急性麻痹病毒(Israel acute paralysis virus,IAPV) 等作为参照,釆用最佳反应条件在LAMP 和PCR 中扩增。每次扩增反应的同时设DEPC 水作阴性对照和蜂房蜜蜂球菌作为阳性对照,以本研究建立的检测方法进行特异性检测,同时以常规PCR 检测方法为对照,验证LAMP 检测方法的特异性,检测结果通过电泳及凝胶成像仪分析判断结果。
1.7 LAMP 与PCR 方法灵敏性检测
对蜂房蜜蜂球菌DNA 溶液10 倍梯度稀释,然后采用本研究建立的LAMP 检测方法进行检测,同时进行常规PCR 检测,并对各自产扩增物进行琼脂糖凝胶电泳对比分析,进行灵敏度评估。其中,LAMP 反应体系和反应条件以本研究优化的最佳体系和条件进行检测;PCR 反应体系为:上下游引物各0.5 μL,PCR Mix 10 μL,蜂房蜜蜂球菌DNA 2μL,d dH2O 6μL,PCR 反应条件:95 ℃预变性2 min;95℃预变性30 s、58℃预变性15 s、72℃预变性60 s,40 个循环;72℃预变性5 min。
1.8 临床样本检测
从10 群蜂中采取蜜蜂幼虫检测,产物用琼脂糖凝胶电泳分析,同时做加入钙黄绿素荧光试剂试验,用紫外仪检测结果。
2 结果与分析
2.1 蜂房蜜蜂球菌DNA 的提取及验证
将PCR 的上下游引物作为验证性引物,检测蜂房蜜蜂球菌的核酸,PCR 特异性引物产物条带为829 bp,产物经琼脂糖凝胶电泳和凝胶成像仪分析,结果显示目的序列的理论扩增片段大小与实验结果基本相符,说明DNA 是蜂房蜜蜂球菌的。结果见图2-0。

图2-0 PCR 验证结果
2.2 LAMP 方法反应体系的优化结果
LAMP 扩增体系也会受到一些相关因素的影响。根据最新文献显示[17,18],影响扩增反应的几个主要影响因素如:扩增温度、反应时间、引物浓度、Mg2+浓度、Betaine 浓度、dNPTs 浓度等,只有通过进行反复实验来优化出整个反应体系的最佳反应条件。
2.2.1 扩增温度的优化
参照引物的退火温度,选取54 ℃、56 ℃、58 ℃、60 ℃、62 ℃、64 ℃六个温度做平行对照实验,电泳检测结果(见图2-1),试验反复2 次后,当温度控制在58 ℃、60 ℃、62 ℃或64 ℃时,扩增效率均较高。因此,将本试验的退火温度设在58 ℃。
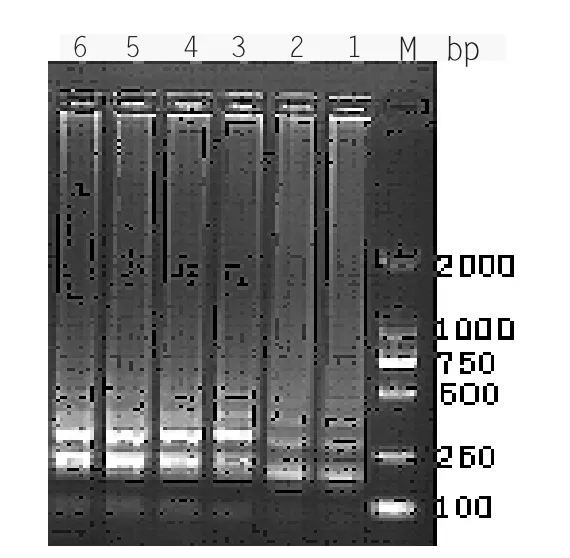
图2-1 LAMP 温度优化结果
2.2.2 反应时间的优化
分别选取10 min、20 min、30 min、40 min、50 min、60 min 六个扩增时间做平行对照实验,电泳检测结果(见图2-2),20 min、30 min、40 min、50 min、60 min 均有条带,50 min 和60 min 的条带梯度性更好。因此选择扩增时间为50 min。
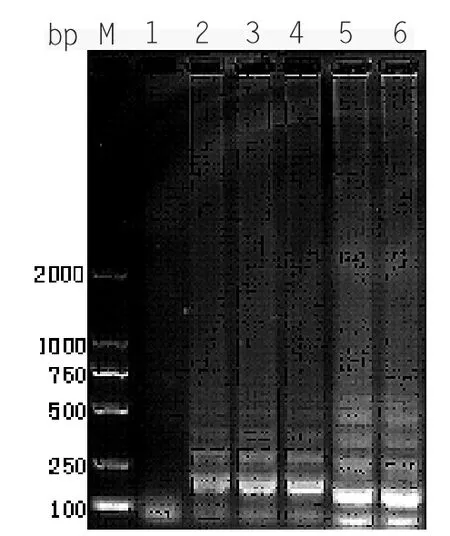
图2-2 LAMP 时间优化结果
2.2.3 引物浓度的优化
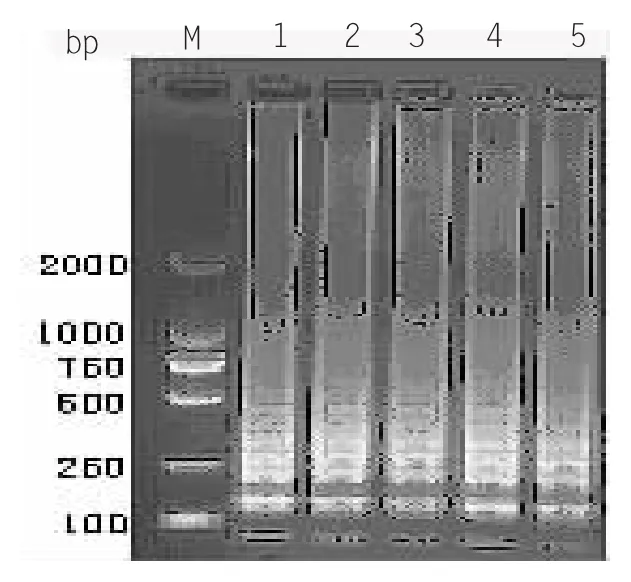
图2-3 LAMP 引物浓度优化结果
58℃,50min 的条件下,做5 组不同引物浓度的平行对照实验,检测结果显示(见图2-3)。.1~5 泳道分别代表不同的引物浓度扩增结果。在第4 组可见明显的特异性扩增,其余泳道扩增条带梯度型不是很好,即内、外、环引物的最佳反应浓度比为1∶4∶8。
2.2.4 镁离子浓度的优化
选取5 mM、10 mM、15 mM、20 mM、25 mM、30 mM 共6 个Mg2+浓度,在上述最佳反应条件下进行LAMP 扩增。检测结果显示(见图2-4),6 个泳道都可见梯状条带出现,但第6 泳道亮度、梯度较高。因此认为Mg2+最优终浓度为30 mM。
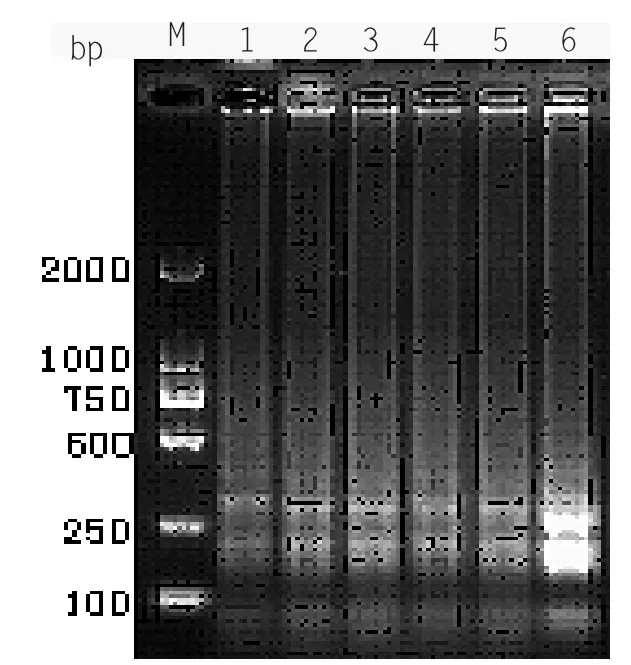
图2-4 LAMP Mg2+浓度优化结果
2.2.5 Betaine 浓度的优化
在58 ℃的温度条件下,选择引物浓度最佳的进行RT-LAMP 扩增,电泳检测结果(见图2-5),1、2、3、4、5 泳道均可见扩增的梯状带,亮度相似,但1 泳道的条带梯度性略高于其它四个泳道。因此认为甜菜碱最适终浓度为0.4 M。
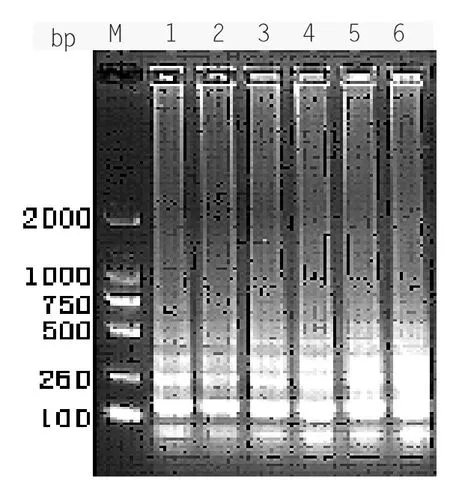
图2-5 LAMP Betaine 浓度优化结果
2.2.6 dNPTs 浓度的优化
选取0.3 mmol/L、0.6 mmol/L、0.9 mmol/L、1.2 mmol/L、1.5 mmol/L、1.8 mmol/L 共6 个dNPTs 浓度,在上述最佳反应条件下进行LAMP 扩增。电泳结果显示(见图2-6),1、2、3、4 泳道可见梯状条带出现,但第3 泳道的梯度性最好。因此认为dNPTs 最优终浓度为0.9 mmol/L。
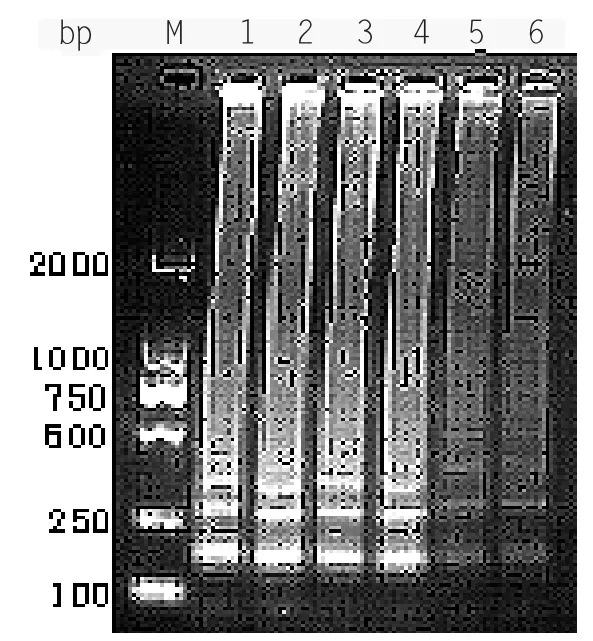
图2-6 LAMP dNPTs 浓度优化结果
2.2.7 LAMP 与PCR 方法特异性检测结果
利用优化后的最佳LAMP 反应条件,对蜂房蜜蜂球菌、蜜蜂球囊菌蜜蜂残翅病毒、蜜蜂囊状幼虫病毒、黑蜂王台病毒、以色列急性麻痹病毒的核酸样品同时进行LAMP 和PCR扩增。结果如图2-7、2-8 所示,表明该引物与上述其他病毒核酸样品间均没有扩增条带,说明该LAMP 方法和PCR 方法具有很好的特异性。

图2-7 LAMP 特异性检测结果
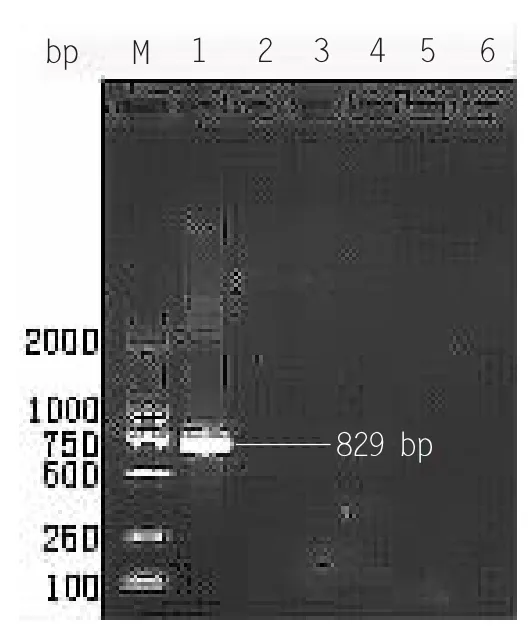
图2-8 PCR 特异性检测结果
2.2.8 LAMP 与PCR 方法灵敏性检测结果
用TE 缓冲液将上述已知拷贝数的DNA 进行10 倍稀释,取稀释度为7.231×106拷贝/μL~7.231×10-1拷贝/μL 作为模板,进行LAMP和PCR 扩增,结果显示(如图2-9),LAMP 可以检测到7.231×101拷贝/μL 的模板量,PCR只能检测到7.231×103拷贝/μL 的模板量,LAMP 方法的敏感性是常规PCR 方法的100倍。可见本试验所建立的LAMP 检测方法在检测蜂房蜜蜂球菌中具有很高的敏感性,对于早期诊断和基层检疫具有很重要的意义。

图2-9 LAMP 敏感性检测结果
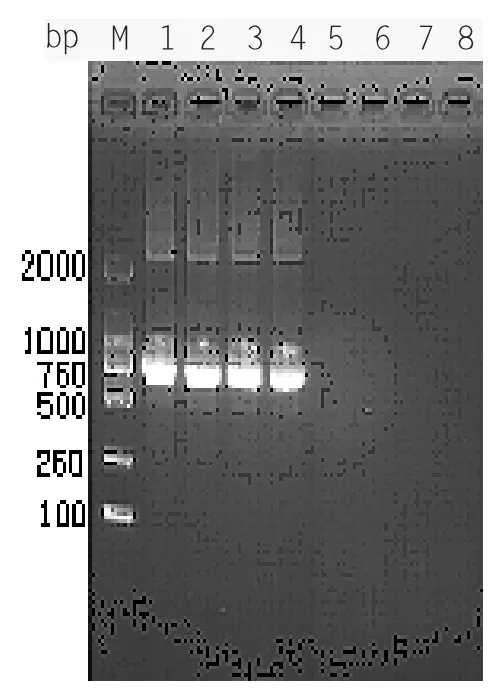
图2-10 PCR 敏感性检测结果
2.2.9 LAMP 和PCR 方法样品检测结果
利用本试验建立的LAMP 和PCR 检测方法,对采集的100 份蜜蜂样品进行检测,结果显示(如图2-11、2-12),用LAMP 方法检测出8 份为阳性,通用PCR 检测出6 份阳性,说明在LAMP 方法具有很好的检出率。

图2-11 LAMP 样品检出结果

图2-12 PCR 样品检出结果
2.2.10 LAMP 的可视化结果
在LAMP 反应结束后瞬时离心后,将EP管放到紫外箱中观察,结果显示,反应结束后将PCR 管进行离心,阳性管管底有少量白色沉淀,阴性管反应液体清亮无沉淀,加入染料的阳性管为翠绿色,而阴性管为本来的淡橙色;在紫外光下阳性管溶液发出绿色荧光,阴性对照管溶液为原来的橘黄色荧光(如图2-13)。

图2-13 LAMP 的可视化结果
3 讨论
LAMP 是一种新的体外核酸扩增方法,日本R.Vrund 团队于2000 年开发,适用于多种基因的体外诊断,也叫环形核酸扩增法[18]。它利用链置换DNA 聚合酶和两个内引物(FIP和BIP) 和两外引物(F3 和B3),特异识别目标靶序列上6 个区域[17],另外两个环引物(loop-f,loop-b),LAMP 可以在退火扩增循环的结构上提高反应速度和特异性[19]。可以在网上找到有助于理解的相应动画,LAMP已经检测了许多病原体,认为该技术的性能具有优于常规PCR 的优势。这些包括蜜蜂疾病的检测,例如蜜蜂球囊菌[20]、以色列急性麻痹病毒[21]、囊状幼虫病毒[22]的检测。
LAMP 技术是一个非常实用的检测工具,可以用于目标细菌、病毒的验证性诊断和快速分化。LAMP 在检测过程中,为了防止开盖造成的气溶胶的污染,在试验前嵌入染料作为LAMP 实时监测的检测策略,这种方法已被成功应用[23]。LAMP 的反应可以在一个简单的热块或水浴锅中进行,结果可以通过肉眼观察荧光染料的颜色变化来获得[24],这使得该技术在资源有限的基层特别具有吸引力。然而研究发现,复杂的引物设计是LAMP 的主要缺点,即使使用在线设计软件,整个过程也是耗时的,LAMP 引物的好坏直接影响整个试验的成功与否,所以LAMP 反应的成功依赖于所选的引物[25]。
本研究建立的LAMP 体系特异性强,灵敏性高,在58℃反应50 min 就可以完成临床检测。根据凝胶电泳建立的反应体系在恒温水浴锅和金属浴中就可以实现,而且判定结果的方法比PCR 法多,较PCR 法更方便早期检测欧洲幼虫腐臭病,因此很适合基层的现场检疫和临床检测。
4 结论
本研究建立了蜂房蜜蜂球菌的LAMP 检测方法,通过多次重复试验优化确定了最优LAMP 反应体系和反应条件,反应体系中镁离子浓度为30 mM,Betaine 浓度为0.4M,dNTPs 浓度为0.9 mmol/L,内、外、环引物浓度比为1∶4∶8,最优反应条件为58℃,50min。在最优条件下LAMP 可检测蜂房蜜蜂球菌DNA 的最低检测量为7.231×101拷贝/μL,通过特异性检测实验表明LAMP 检测方法具有良好的特异性。本研究所建立的蜂房蜜蜂球菌LAMP 检测方法具有准确、灵敏、便捷、成本低以及特异性强等优点,为基层快速诊断和预防该病提供了新的技术,并且为提前预防、有效控制欧洲幼虫腐臭病和降低蜂产品中药物残留提供了依据。

