酪蛋白-葡萄糖共聚物的制备
董建琼,高昕悦,张春兰, *
1. 塔里木大学生命科学学院(阿拉尔 843300);2. 南疆特色农产品深加工兵团重点实验室(阿拉尔 843300)
乳中含量较高的蛋白质是酪蛋白,它是一种含有磷和钙的结合蛋白质。在牛奶中主要以磷酸二钙、磷酸三钙或两者的复合物形式存在,结构比较复杂[1]。目前利用蛋白质作为天然的乳化剂和功能因子载体的研究报道较为常见。但是目前酪蛋白的一些功能特性还是存在一定的不足,极大地影响在一些领域的应用,例如酪蛋白在较低的pH下,溶解性和乳化性都较差,限制了其使用范围。因此,为了改善酪蛋白的功能特性,扩大其使用途径、范围,需要对酪蛋白进行改性研究。
蛋白质和糖类作为食品中不可缺少的一部分,在食品体系中往往共存,在加热条件下两者会自发地进行美拉德反应,不需要使用任何化学物质作为催化剂。反应后蛋白质的水溶性、乳化性等都有较显著的提高[2-3],是目前蛋白质改性众多方法中较为理想的方法。蛋白质接枝改性能提高蛋白质的功能特性[4-7],并具有安全性,在食品行业中得到广泛的应用。试验以湿法接枝反应制备酪蛋白-葡萄糖的接枝物,通过在不同的条件(pH、温度、时间、底物浓度)对该接枝反应进行分析,以期为酪蛋白-葡萄糖的实际制备提供理论依据。
1 材料与方法
1.1 材料与仪器
磷酸氢二钠、磷酸二氢钠、四硼酸钠、氯化钠、盐酸、氢氧化钠、十二烷基硫酸钠、葡萄糖、β-巯基乙醇、邻苯二甲醛等均为分析纯,国药集团化学试剂有限公司;酪蛋白,阿拉丁试剂有限公司。
UM-4T磁力搅拌器,北京优晟联合科技有限公司;LE 2002E/02电子天平,梅特勒-托利多仪器(上海)有限公司;PHS-2F精密pH计/酸度计,上海仪电科学仪器股份有限公司;UM-4T数显恒温磁力搅拌水浴锅,金坛区科顺仪器厂;GZX-9240 MBE电热鼓风干燥箱,上海博讯实业有限公司;TGL-16C高速离心机,上海安亭科学仪器厂。
1.2 试验方法
1.2.1 酪蛋白-葡萄糖共聚物的制备
取1 g酪蛋白,加入5 mL的0.1 mol/L NaOH溶液使酪蛋白溶解,用pH 7的10 mmol/L磷酸盐缓冲液定容至100 mL,加入转子,在磁力搅拌器上以1 000 r/min的转速持续搅拌3 h,放入冰箱静置过夜,待用。
酪蛋白-葡萄糖共聚物制备方法:将一定量的酪蛋白溶液与一定量的葡萄糖溶于10 mmol/L的磷酸盐缓冲液中,在磁力搅拌器上搅拌使其充分混匀,用1 mol/L的HCl或NaOH调节pH至适宜的酸碱度。取2 mL处理好的溶液于离心管中,密封后在一定温度下反应一段时间后,立即用冰水浴冷却至室温,以7 000 r/min离心10 min,取上清液测定游离氨基含量。分别考察反应时间(40,50,60,70和80 min)、反应温度(60,70,80,90和100 ℃)、pH(6,7,8,9和10)以及酪蛋白、葡萄糖这两种底物的质量配比(0.5︰10,1︰10,1.5︰10,2︰10和2.5︰10 g/g)对酪蛋白-葡萄糖共聚物接枝度的影响。
1.2.2 游离氨基的测定及接枝度的计算
采用OPA法进行游离氨基的测定[8]。OPA试剂的配制:称取40 mg的邻苯二甲醛于1 mL甲醇中搅拌溶解,加入2.5 mL 20%的SDS、25 mL 0.1 mol/L的硼砂和100 μL的β-巯基乙醇,用蒸馏水定容至50 mL。取4 mL的OPA试剂于试管中,加入200 μ L的样品溶液,混合均匀后在35 ℃下水浴2 min,在340 nm下测定吸光度A1,以在OPA试剂中注入200 μL蒸馏水为空白样。接枝度(DG)按式(1)计算。

式中:A0为未反应时游离氨基的吸光度;A1为反应一定时间后的游离氨基吸光度。
2 结果与分析
2.1 不同反应时间对酪蛋白-葡萄糖接枝度的影响
在反应初始pH为8、温度为90 ℃条件的情况下,DG随反应时间变化的关系如图1所示。随着加热时间的延长,酪蛋白-葡萄糖接枝度呈先升后降趋势。酪蛋白的ε-氨基酸与葡萄糖分子的还原性醛基接触后才会发生反应,随着加热时间的延长,蛋白质结构逐渐展开,将ε-氨基酸暴露在外,接枝度逐渐提高。在70 min时接枝度达到17.07%。当加热时间达到80 min时,接枝度稍有下降,这可能是过度加热会使蛋白质分子的一些赖氨酸结构被破坏,并使蛋白质结构伸展而增加蛋白质之间的相互作用而导致絮凝和沉淀,不利于接枝反应进行。
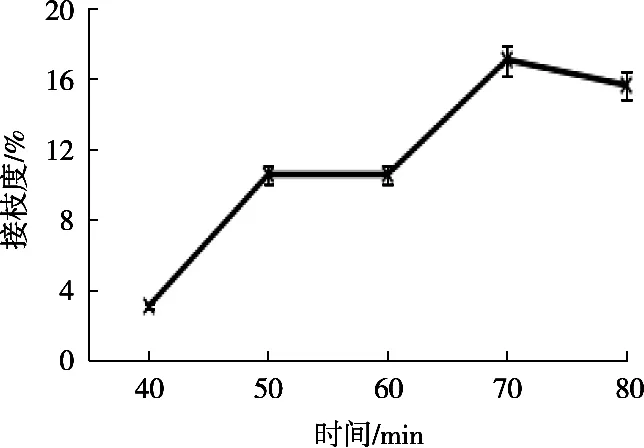
图1 不同反应时间对酪蛋白-葡萄糖接枝度的影响
2.2 不同反应温度对酪蛋白-葡萄糖接枝度的影响
在反应初始pH为8、反应时间为70 min条件的情况下,DG随反应温度变化的关系如图2所示。随着温度的提高,接枝度在不断提高,当温度为90 ℃时,DG达到12.73%;当温度大于90 ℃时,接枝度降低。这可能是反应温度过高使蛋白质分子的赖氨酸部分破坏或蛋白质的絮凝沉淀,阻碍了接枝反应的进行。

图2 不同温度对酪蛋白-葡萄糖接枝度的影响
2.3 不同pH对酪蛋白-葡萄糖接枝度的影响
将酪蛋白与葡萄糖以质量比1︰10(g/g)混合后,调节pH至6,7,8,9和10,在水浴温度90 ℃下加热70 min,测定接枝度。由图3可知,当pH小于8时,接枝度随pH的增大而增大;当pH为8时,接枝度达18.61%;而pH大于8时,接枝度随pH增加而减小。导致这一结果的原因可能是在pH小于8时,美拉德反应由于反应环境偏酸而被抑制;在pH大于8时碱性逐渐增强,从而导致酪蛋白的一级结构发生变化如脱氨、脱羧和肽键断裂,引起“胱赖反应”,将氨基酸转变成有毒的化合物[9-10],因此不利于接枝反应的进行。

图3 不同pH对酪蛋白-葡萄糖接枝度的影响
2.4 不同酪蛋白-葡萄糖配比对接枝度的影响
在反应初始pH为8、水浴温度90 ℃下加热70 min后,测定接枝度。如图4所示,随着酪蛋白-葡萄糖配比的增加,接枝度呈先上升后下降的趋势。当底物配比为1︰10(g/g)时,接枝度最大,为24.82%;当底物配比大于1︰10(g/g)时,接枝反应受到抑制,说明适当的底物配比有利于酪蛋白的接枝反应。若添加比例过高,羰基供体不足以与氨基供体结合,接枝反应程度不足;若添加比例过低,葡萄糖会使溶液的空间位阻增大,分子之间的碰撞概率会减少而阻碍反应的进行。

图4 不同酪蛋白-葡萄糖配比对接枝度的影响
2.5 酪蛋白-葡萄糖湿法接枝反应工艺优化
从表1可以看出,影响酪蛋白-葡萄糖接枝反应的因素依次为:pH>底物配比>时间>温度。酪蛋白-葡萄糖接枝反应的最佳条件是A3B3C2D1,即反应时间为80 min,反应温度为100 ℃,pH为8,底物配比为1︰10(g/g),此条件下接枝度为23.31%。

表1 酪蛋白-葡萄糖湿法接枝反应正交试验结果
3 结论
试验研究了不同反应时间、温度、pH以及酪蛋白-葡萄糖配比对酪蛋白-葡萄糖共聚物接枝度的影响。结果表明:影响酪蛋白-葡萄糖湿法接枝反应的因素依次为pH>底物配比>时间>温度,湿法接枝反应时间为80 min,反应温度为100 ℃,pH为8,酪蛋白与葡萄糖比例为1︰10(g/g),此条件下接枝度可达23.31%。

