3D打印骨科钛合金的亚慢性全身毒性研究
王涵 赵丹妹 许建霞 连环 曲明悦 何牧野 王春仁
3D打印技术又称为增材制造技术或快速成型技术,已广泛应用于医疗器械领域。就钛合金植入物而言,目前我国已有3D打印钛合金植入物获得CFDA的注册许可证,更多的增材制造医用钛合金植入物也逐步进入医疗器械注册审评环节[1]。
3D打印骨科植入物作为长期植入体内的医疗器械产品,存在体液环境中微粒析出、动态环境中材料脱落等风险,对其进行合理的临床前安全性评价很重要[2]。本研究对3D打印的骨科钛合金的亚慢性全身毒性进行研究,以判断其是否具有潜在的亚慢性全身毒性,为相关的临床研究和应用提供毒理学数据支持。
1 材料与方法
1.1 材料
1.1.1实验动物
SPF级SD大鼠,4~5周龄(中国食品药品检定研究院实验动物资源中心),适应性喂养5 d后用于实验。大鼠独立通气笼(IVC)条件下饲养,饲养密度2只/笼,换气次数大于50次,笼盒内风速小于0.2 m/s,室温20 ℃~25 ℃,相对湿度40%~70%。光照采用自动定时方式控制12 h光照12 h黑暗。实验动物生产许可证号:SCXK(京) 2014-0013;实验动物使用许可证号:SYXK(京) 2017-0013;饲料生产许可证号:京饲证(2014)06054。
1.1.2试剂与仪器
生化检测试剂盒(中生北控生物科技股份有限公司);凝血酶原时间PT检测试剂盒、活化部分凝血活酶时间APTT检测试剂盒、血液学检测试剂盒(希森美康医用电子有限公司,日本);水合氯醛、柠檬酸三钠(国药集团化学试剂有限公司);0.9%氯化钠注射液、甲醛(石家庄四药股份有限公司)。
HITACHI 7080全自动生化分析仪、低温离心机(日立公司,日本),Sysmex CA 1500全自动凝血分析仪、Sysmex XT-1800i全自动血液分析仪(希森美康医用电子有限公司,日本),显微镜(莱卡公司,德国),电子天平(上海跃平科学仪器有限公司)。
1.2 方法
1.2.1试验样品
3D打印骨科钛合金试样(国产;规格:6×10×30),辐照灭菌。
1.2.2样品浸提液制备
采用0.9%NaCl注射液按0.2 g/mL比例制备浸提液,在37 ℃下振摇浸提72 h。用同批号浸提介质作为阴性对照。
1.2.3试验步骤
注射前随机将大鼠分为对照组和试验组,每组20只,雌雄各半。试验组大鼠尾静脉注射检测样品浸提液,对照组大鼠尾静脉注射浸提介质,每天注射1次,注射量为10 mL/Kg,共注射28 d。根据大鼠体重增长情况调整检测样品浸提液注射体积。28 d后解剖,解剖前禁食16 h,称取空腹体质量,10%水合氯醛溶液以0.4 mL/100 g BW大鼠腹腔注射麻醉后,下腔静脉取血,分别测定血液学、血液生化学各项指标;放血处死大鼠,解剖观察各组织器官是否出现异常,称取各脏器湿重值,计算各组织器官的脏器系数(g/100 g),浸泡在10%甲醛溶液固定后进行常规组织病理学检查。
1.2.4检测指标
试验结束日,麻醉后下腔静脉取血。测定血红蛋白浓度(HGB)、红细胞数(RBC)、血小板数(PLT)、白细胞数(WBC)和凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)等血液学指标;血液经离心分离血清,测定天门冬氨酸氨基转换酶(AST)、丙氨酸氨基转换酶(ALT)、碱性磷酸酶(ALP)、尿素(UREA)、总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、肌酐(CRE)、总胆固醇(T-CHO)等临床生化指标。大鼠处死后系统尸解,称取脑、心、肝、脾、肾、肾上腺、胸腺、睾丸、附睾、子宫、卵巢的质量并计算脏器系数(g/100 g)。
1.3 统计学方法
以SPSS 21.0软件进行统计学分析。若两组样本方差齐性且符合正态分布,选择两独立样本t检验;若方差不齐选用两样本秩和检验。P<0.05表示两组间差异有统计学意义。
2 结果
2.1 一般状况观察
对照组和样品组大鼠外观及行为正常,活动自如,呼吸均匀,心跳匀速,反应敏捷,被毛润泽,皮肤和黏膜无改变,眼、耳、鼻、口、生殖腺和肛门无异常分泌物,粪便软、色棕黄、成型。每日观察未见大鼠出现明显异常反应或濒死状态。
2.2 对体质量的影响
各时间点样品组与对照组大鼠体质量差异无统计学意义(P>0.05)(表1)。
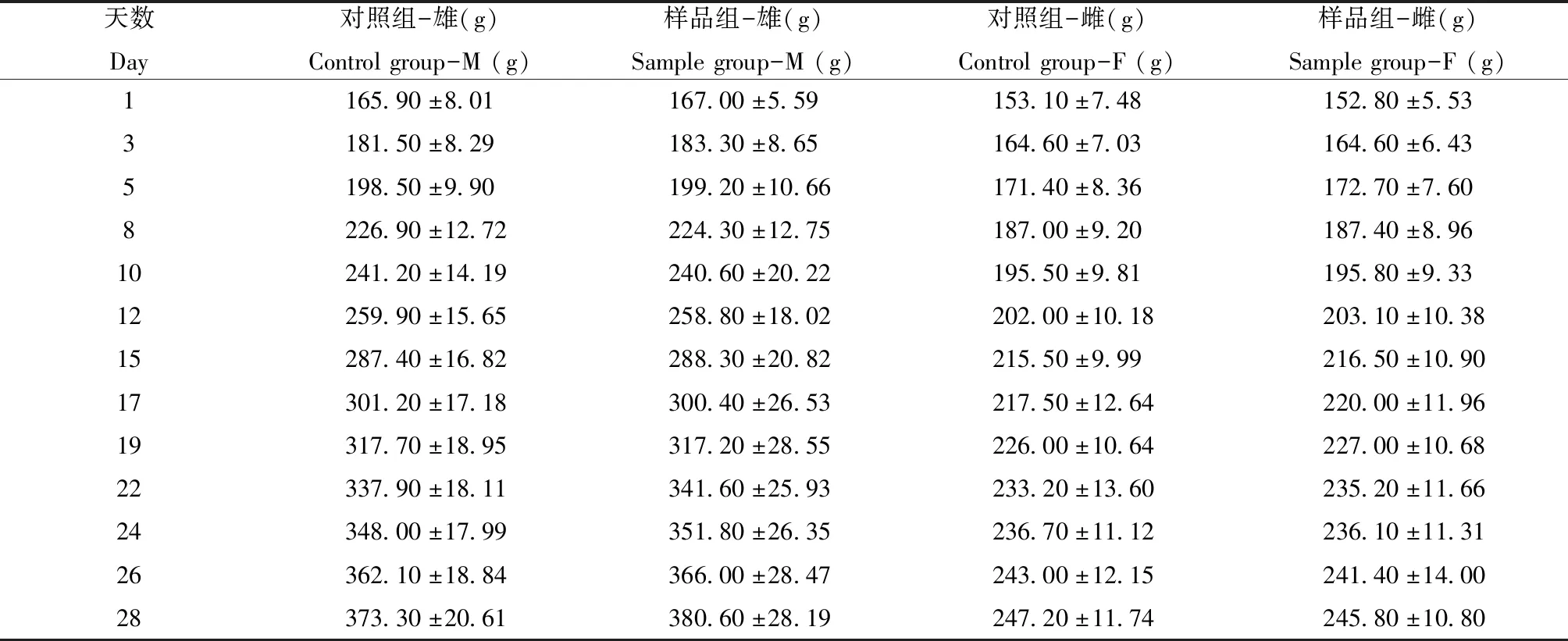
表1 大鼠体质量
2.3 血细胞
雄性大鼠样品组淋巴细胞数(L)与同性别对照组有显著统计学差异(P<0.05);其余各指标雌雄样品组与对照组差异无统计学意义(P>0.05)(表2)。
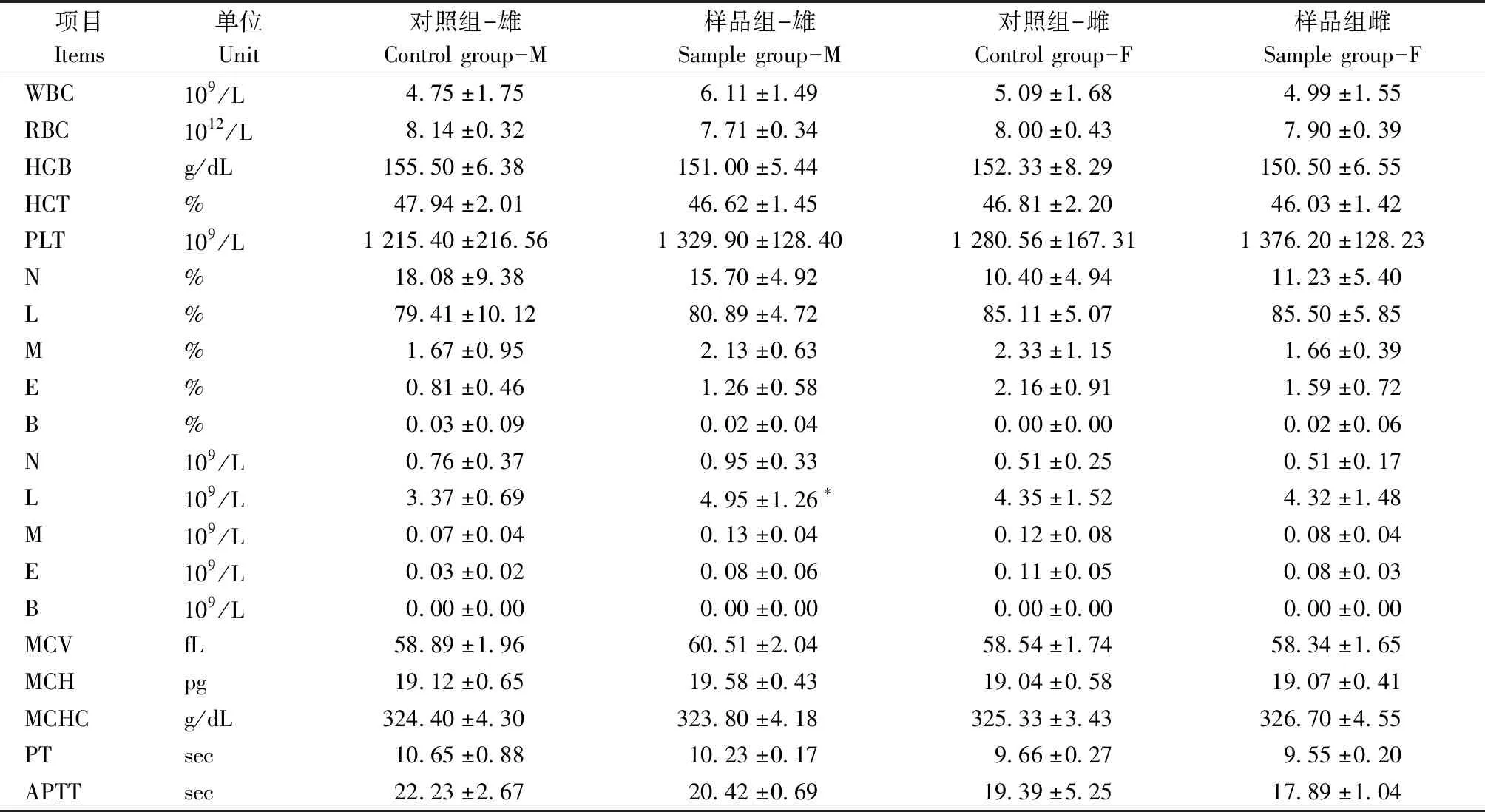
表2 大鼠血液学数据
*:与同性别对照组比较,P<0.05
*: Compared with the control group of the same sex,P<0.05
2.4 临床生化
雄性大鼠样品组天门冬氨酸氨基转换酶(AST)、肌酐(CRE)与同性别对照组有显著统计学差异(P<0.05);雌性大鼠样品组甘油三酯(TG)与同性别对照组差异显著(P<0.05);其余各指标雌雄大鼠样品组与对照组差异无统计学意义(P>0.05)(表3)。
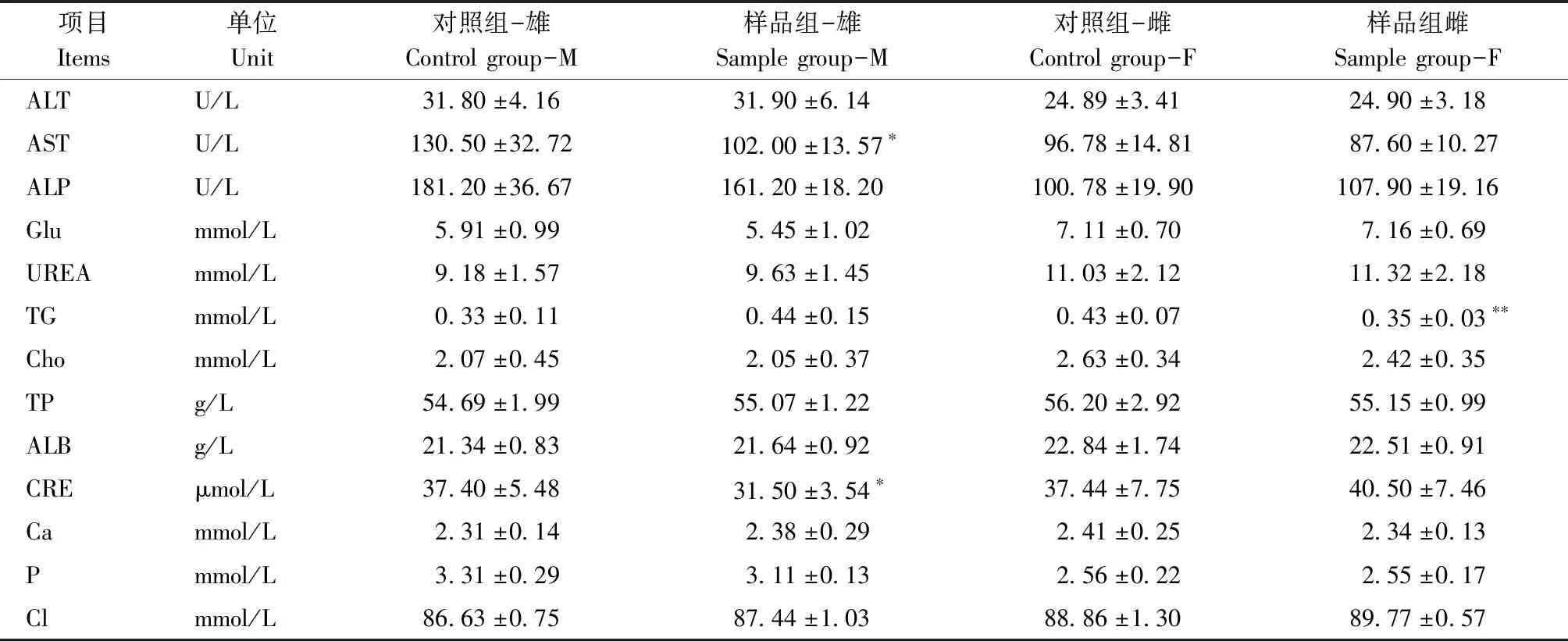
表3 大鼠血生化数据
*:与同性别对照组比较,P<0.05
*: Compared with the control group of the same sex,P<0.05
2.5 大鼠解剖观察
解剖过程中未发现与试验材料相关的肉眼可见的器官组织病变。
2.6 对脏器湿重的影响
雄性大鼠脾及肾上腺脏器质量与同性别对照组有显著统计学差异(P<0.05);其余脏器雌雄大鼠样品组与对照组差异无统计学意义(P>0.05)(表4)。
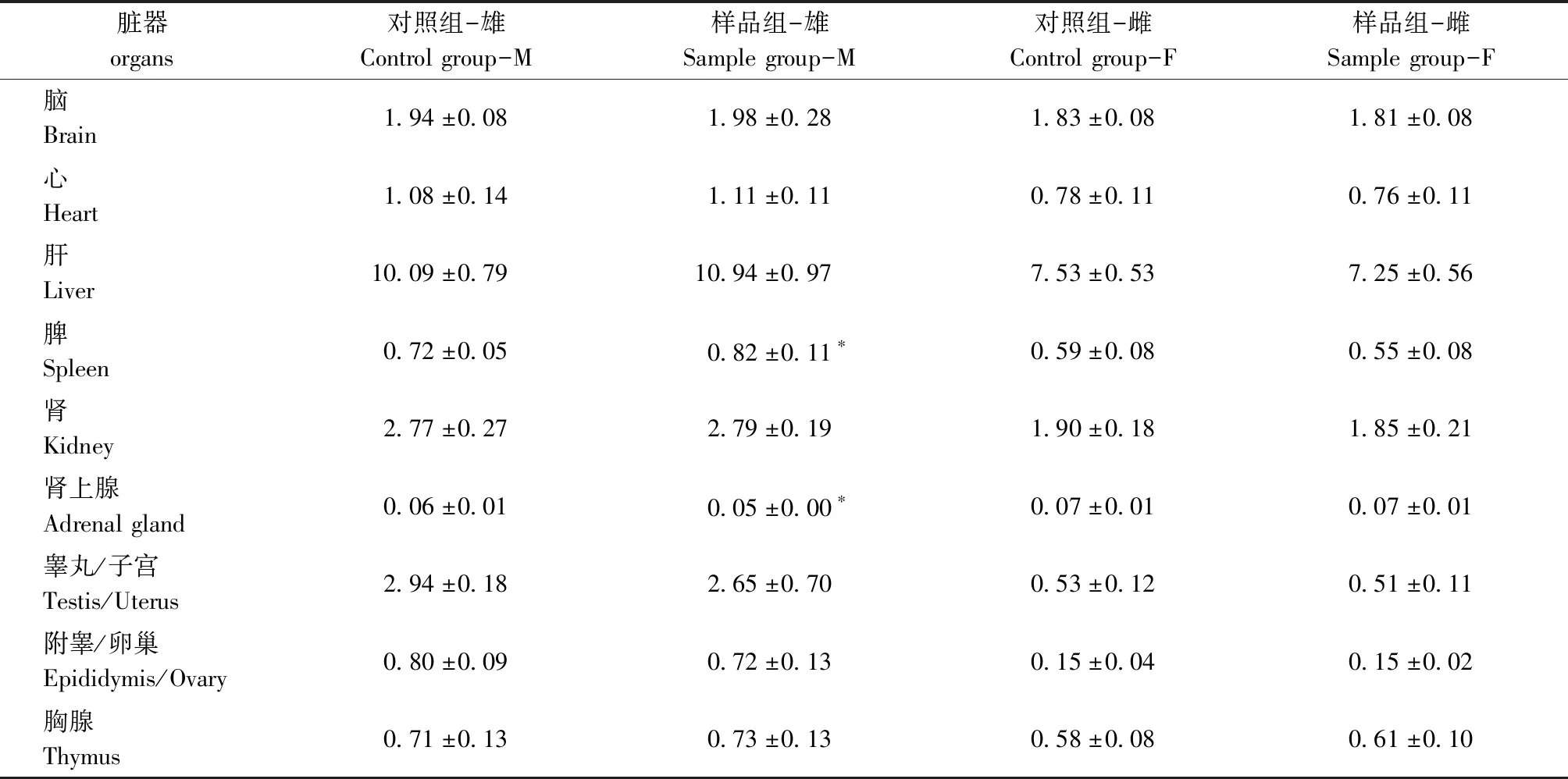
表4 大鼠脏器湿重数据
2.7 对脏器系数的影响
雄性大鼠肾上腺脏器系数值与同性别对照组有显著统计学差异(P<0.05);其余指标雌雄大鼠样品组与对照组差异无统计学意义(P>0.05)(表5)。
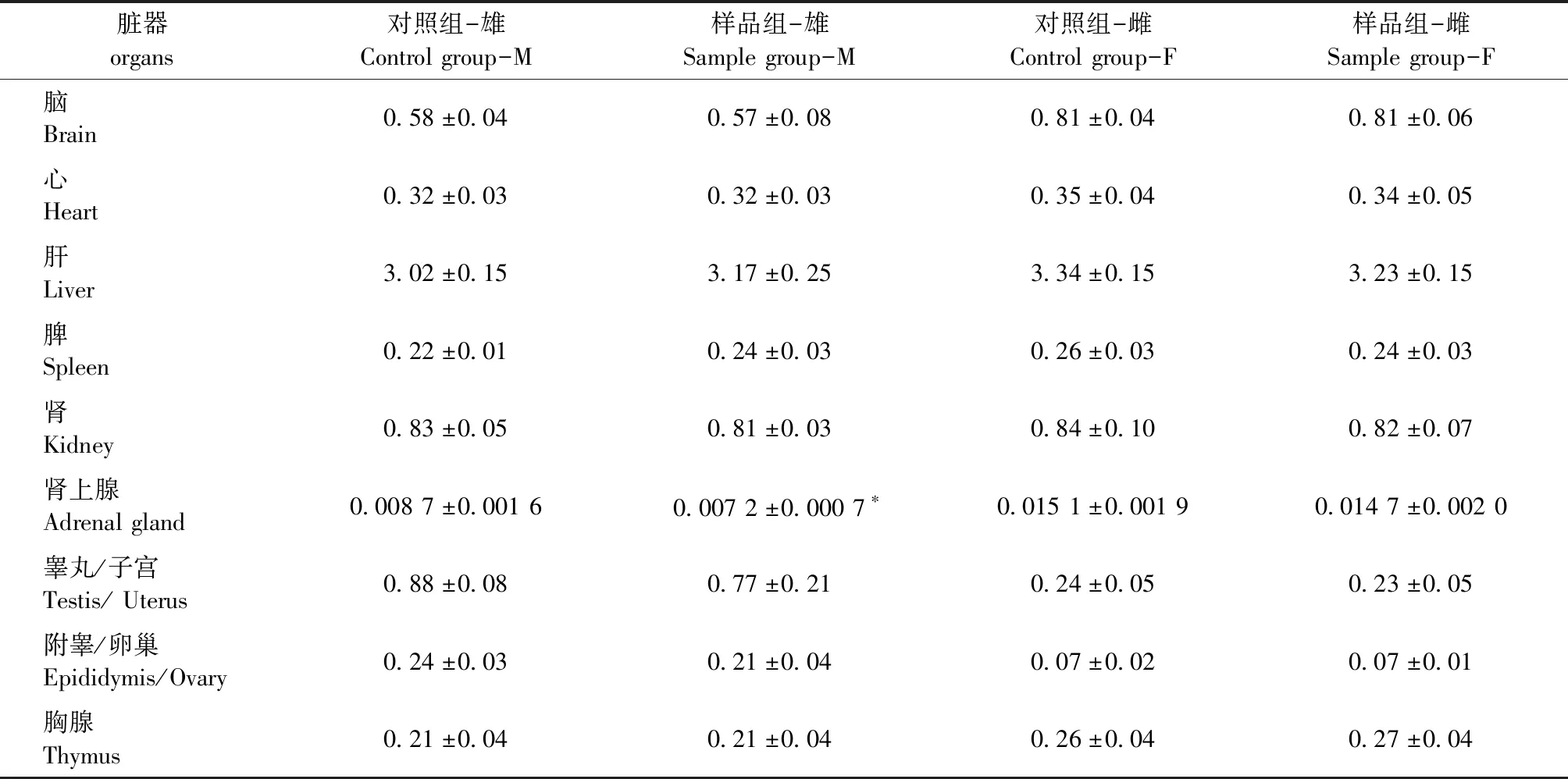
表5 大鼠脏器系数数据
*:与同性别对照组比较,P<0.05
*: Compared with the control group of the same sex,P<0.05
2.8 组织病理学检查结果
对照组及样品组个别动物出现了轻度肝细胞脂肪变性、肺轻度间质炎症、轻度慢性间质性肾炎,其余各组织脏器未见明显异常。两组均有个别动物出现上述病变,不考虑为样品的毒性反应。
3 结论
SD大鼠静脉注射样品浸提液28 d后,经各项指标检测,与浸提介质对照组比较,有统计学差异但无临床意义的指标如下:
①雄性大鼠样品组淋巴细胞数(L)与同性别对照组有显著统计学差异(P<0.05)。但这些值均在本实验室参考值范围内,不考虑为毒性反应。
②雄性大鼠样品组天门冬氨酸氨基转换酶(AST)、肌酐(CRE)与同性别对照组有显著统计学差异(P<0.05);雌性大鼠样品组甘油三酯(TG)与同性别对照组有显著统计学差异(P<0.05)。但这些值均在本实验室参考值范围内,不考虑为毒性反应。
③雄性大鼠脾及肾上腺脏器质量与同性别对照组有显著统计学差异(P<0.05),雄性大鼠肾上腺脏器系数值与同性别对照组有显著统计学差异(P<0.05)。但这些值均在本实验室参考值范围内,不考虑为毒性反应。
本试验结果表明,该检测样品未显示出具有临床意义的异常指标或毒性靶器官。
4 讨论
3D打印骨科钛合金植入物作为长期植入体内的医疗器械产品,除其治疗的精准性、有效性之外,其安全性同样值得关注。目前,我们进行3D打印植入物的生物相容性评价时,还是按照GB/T 16886系列标准进行评价。本研究通过SD大鼠尾静脉注射途径进行了3D打印骨科钛合金的亚慢性毒性试验。本试验中样品浸提介质为生理盐水,连续给样时间为28 d,通过对大鼠体质量、血液学、临床生化、脏器系数、组织病理学检测等指标综合分析,未检测到该样品的亚慢性全身毒性。但本试验中只检测了试验样品生理盐水(极性介质)浸提液,还可参照ISO 10993.11-2017中的胃肠外双途径接触试验方法,综合评价该样品极性及非极性可沥滤物同时接触人体时产生重复接触全身毒性的可能性。
对3D打印医疗器械来说,需从数据和软件、原材料、工艺稳定性等方面进行控制及标准化,以实现对其全过程的控制,才能确保最终的产品质量[3-4]。FDA关于增材制造的指导原则《Guidance for Industry and Food and Drug Administration Staff》于2017年12月发布[5],目前国家药品监督管理局医疗器械技术审评中心已制定《定制式增材制造医疗器械注册技术审查指导原则》,其他增材制造相关的医疗器械注册审查指导原则也在陆续编写过程中。

