复合膜固定化酶提高米糠稳定性
于殿宇,陈书曼,王 彤,李 丹,张 雪,吴 楠,唐洪琳,秦兰霞,,姚 凯
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.湖北天星粮油股份有限公司,湖北 随州 441300)
米糠是稻谷加工中主要副产物,含有稻谷中大部分的生理活性成分[1-3]。但目前我国对米糠的利用率只有20%左右,大部分用作动物饲料或者废物丢弃,造成严重的资源浪费[4-5]。米糠本身化学性质极不稳定,碾米后米糠中的脂肪酶与油脂接触,脂肪被水解生成游离脂肪酸,进而在过氧化物酶、光、热等因素的共同作用下发生脂肪氧化酸败,使米糠酸败变质[6-9],难以长期贮存。
目前国内外稳定米糠的方法有很多,但热稳定米糠会使部分米糠蛋白质变性,抗氧化剂含量降低等问题[10-11]。 化学法稳定米糠所需的化学试剂用量过多,不仅会造成米糠体系pH值过低,还可能存在化学残留等问题[12-13]。酶法稳定米糠是将蛋白酶与米糠和水混合,在一定温度下维持一段时间以使脂肪酶失活的方法[14]。相比其他方法,酶法稳定米糠不仅作用条件温和,还能减少米糠成分变化和抗氧化剂化合物的损失。Laokuldilok等[15]选用 5 种蛋白酶对米糠进行稳定化处理,以处理前后米糠脂肪酶活力为指标,结果表明木瓜蛋白酶是稳定米糠的最佳处理酶。
木瓜蛋白酶对蛋白质的水解具有较好的催化活性[16-18], 但以游离酶的形式作用米糠,会存在易变性失活、反应条件不易控制等缺点,而将其进行固定化,不仅利于酶的分散和回收、增加循环使用次数还可提高稳定性[19]。利用醋酸纤维素(cellolose acetate,CA)和聚四氟乙烯膜(polytetrafluoroethylene,PTFE)制成的CA-PTFE复合膜具有吸附性、化学稳定性和机械性能优异等特点[20-22],以此为载体固定化木瓜蛋白酶,不仅能使蛋白酶与底物快速分离,提高酶的重复利用率,降低生产成本,也实现了酶的催化功能和膜的分离、载体功能的有机结合。
本实验利用CA修饰PTFE制备了CA-PTFE复合膜,再以CA-PTFE复合膜为载体通过吸附交联法固定化木瓜蛋白酶,以复合膜固定化酶对米糠进行钝化处理,探究酶膜钝化米糠效果及工艺条件,考察酶膜的重复使用次数对酶活力的影响,研究钝化后米糠的贮存稳定性,为工业化连续生产提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜米糠(水分13.6%) 湖北天星粮油股份有限公司;醋酸纤维素、木瓜蛋白酶(300 U/mg) 国药集团化学试剂有限公司;聚四氟乙烯微孔膜(平均孔径0.1 μm) 海宁市益博过滤器材厂;其他有机溶剂均为国产分析纯。
1.2 仪器与设备
DF-集热式恒温加热磁力搅拌器 上海耀特仪器设备有限公司;DK-2000-恒温水浴锅 天津市泰斯特仪器有限公司;LD4-2离心机 上海安亭科学仪器厂; SM-03B型电子雾化加湿器 江苏湿美电气制造有限公司; S-3400N型高分辨场发射扫描电镜 日本日立公司;UV9000紫外-可见分光光度计 上海元都有限公司;JY10002型号电子分析天平 上海精密仪器有限公司。
1.3 方法
1.3.1 复合膜的制备
将15.0 g醋酸纤维素60 ℃溶于85.0 g二甲基酰胺中得到铸膜液。将PTFE膜先用0.1 mol/L的NaOH溶液和0.1 mol/L的HCl溶液清洗,再用去离子水清洗,真空干燥后平铺在洁净的玻璃板上。控制厚度,将醋酸纤维素铸膜液用刮刀均匀涂在PTFE表面,在室温下挥发适当的时间完成干相转换后,浸入去离子水完成湿相转换。12 h后用去离子水清洗,自然干燥待用。
1.3.2 木瓜蛋白酶的固定化
采用吸附-交联相结合的固定化方法,将7.5 g木瓜蛋白酶溶解于55 ℃、500 mL、pH 6的磷酸盐缓冲溶液中配制成酶液,将CA-PTFE复合膜浸润在酶液中,恒温搅拌吸附4 h后,加入2.5 mL戊二醛进行交联反应3 h,反应结束后用去离子水冲洗酶膜,放于干燥处待其风干后测定酶活力。
1.3.3 固定化酶膜载酶量的测定
用单位面积的酶膜所固定的酶蛋白含量表示载酶量,采用Bradford[23]方法测定固定化前后的木瓜蛋白酶的酶液含量,同时测定清洗液中的酶蛋白含量,同一条件下平行重复实验3 次,取平均值,实验误差在5%以下。根据式(1)计算载酶量:
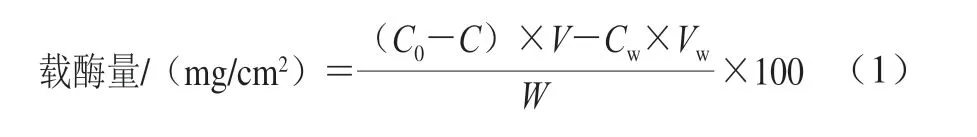
式中:C0为固定化前酶溶液蛋白质量浓度/(mg/mL); C为固定化后溶液中蛋白质量浓度/(mg/mL);Cw为清洗溶液蛋白质量浓度/(mg/mL);V为固定化所用酶溶液体积/mL;Vw为清洗溶液体积/mL;W为浸入酶溶液中膜的面积/cm2。
1.3.4 固定化酶膜酶活力的测定
固定化酶活力用酶活力单位表示,测定固定化酶活力时,每次固定化酶膜两份,其中一份做空白实验,另一份加入样品瓶中,参照游离酶活力测定[24]过程。将初始酶膜的酶活力记为100%,其余酶活力与其对比,即相对酶活力,如式(2):

式中:A为初始固定化酶膜酶活力/(U/cm2);B为使用后固定化酶膜酶活力/(U/cm2)。
1.3.5 米糠中脂肪酶活力测定
参照Laokuldilok等[15]的对硝基苯酚月桂酸法并加以修改。溶液A:0.2 g PNPL溶解在30.0 mL异丙酮中;溶液B:6.0 g TritonX-100+3.0 g阿拉伯胶溶解在500 mL磷酸盐缓冲液中。称取0.5 g米糠分别加入0.2 mL溶液A和10 mL溶液B,振荡混匀,35 ℃反应30.0 min,沸水灭酶5.0 min后快速冷却至室温,混合液以4 000 r/min离心10 min,上清液即为米糠脂肪酶提取液。取上清液于410 nm波长处测定吸光度,带入标准曲线计算对硝基苯酚浓度,根据取样量计算脂肪酶活力,以相同条件下未经酶解的米糠脂肪酶活力为基准计算处理后米糠脂肪酶的相对活力。
1.3.6 扫描电镜
将聚四氟乙烯膜、醋酸纤维素-聚四氟乙烯复合膜和醋酸纤维素-聚四氟乙烯复合膜固定的木瓜蛋白酶进行电镜扫描,观察其形貌变化情况。
1.3.7 复合膜固定化酶钝化米糠中脂肪酶的方法
在400 mm×400 mm×400 mm玻璃板制作的具有排风的密封室内,支撑一块300 mm×300 mm带有温控的电热板,电热板上放置一张不锈钢网架,网架与电热板温度误差为2 ℃,在网架上铺一层酶膜,将厚度大约5 mm的米糠平铺在酶膜上,米糠上再盖一层酶膜。调节电热板至一定温度,为防止物料吸湿,使用电子雾化器调节密封室内空气的相对湿度,期间每隔10 min将米糠搅拌并翻置1 次,一定钝化时间后,取样于50 ℃真空干燥至含水量10.0%以下,测定米糠的脂肪酶活力并计算相对酶活力。
1.3.8 单因素试验设计
研究在固定化酶钝化米糠脂肪酶工艺参数的优化,根据预实验选择空气相对湿度、钝化温度和钝化时间3 个因素对相对脂肪酶活力进行单因素试验。选择优化酶解钝化工艺,单因素固定条件分别为空气相对湿度80%、温度70 ℃、时间100 min。研究空气相对湿度分别为50%、60%、70%、80%、90%时对相对脂肪酶活力的影响;研究钝化温度分别为50、60、70、80、90 ℃时对相对脂肪酶活力的影响;研究钝化时间分别为40、60、80、100、120 min对相对脂肪酶活力的影响。
1.3.9 响应面试验设计
综合单因素试验结果,采Box-Behnken模型,对空气相对湿度(A)、钝化温度(B)、钝化时间(C)这3 个因素进行优化,以相对脂肪酶活力(Y)为响应值,进行3因素3水平的响应面分析,使用Design-Expert 8.0.6设计响应面试验以优化制油工艺参数。Box-Behnken设计试验因素与水平见表1。

表 1 Box-Behnken试验因素与水平Table 1 Code and level of independent variables used in Box-Behnken design
1.3.10 固定化酶膜操作稳定性分析
在响应面优化的最佳条件下对米糠进行钝化处理,每次结束后,从酶膜上取约1 cm2的酶膜测定其酶活力,重复上述实验过程,计算相对酶活力,考察重复使用次数对酶膜相对酶活力的影响。
1.3.11 复合酶膜钝化后米糠的贮存稳定性
对在最佳钝化条件下处理后的米糠进行贮存稳定性研究,以未经任何处理的新鲜米糠为对照(相对酶活力100%),将每个米糠样品包装在聚丙烯袋中并在一定环境温度下贮存2 个月,在整个贮存期间测定米糠样品相对脂肪酶活力。
1.4 数据统计分析方法
所得数据均为3 次重复实验的平均值,数据采用Origin 9.0与Design Expert 8.0.6进行分析和绘制。用SPSS 17.0进行ANOVA单因素方差分析,并检验数据的差异显著性,P<0.05,差异显著。
2 结果与分析
2.1 酶膜载酶量及酶活力测定
通过采用Bradford方法测定酶蛋白含量计算出单位面积酶膜的载酶量为0.75 mg/cm2,固定化酶膜的酶活力达到224.25 U/mg。虽然酶活力有所降低,但可增加重复利用次数,避免了酶的大量流失。
2.2 扫描电镜分析
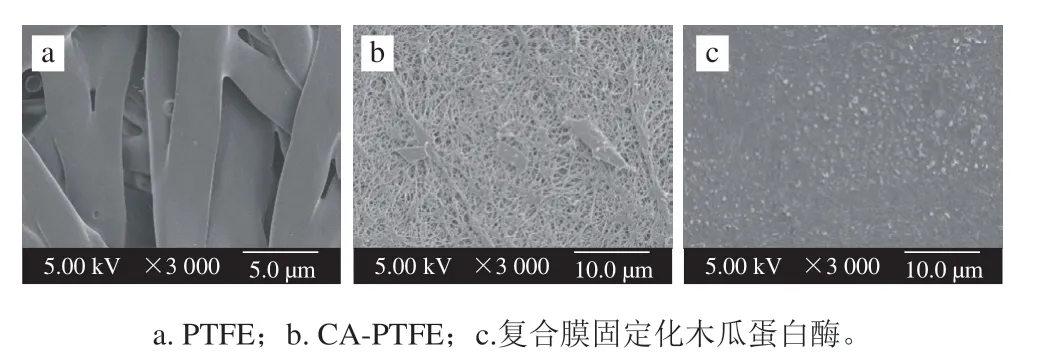
图 1 微孔膜及固定化酶膜的扫描电镜图Fig. 1 Scanning electron micrographs of microporous membrane and immobilized enzyme membrane
从图1a可知,空白PTFE微孔膜内部呈纤维状,错乱交叉,排列不规则,开孔率比较高,其平均孔径为0.1 μm,有较大的空间负载酶,但这种结构表面平整光滑,不利于酶的固定化[25]。图1b中CA-PTFE复合膜的表面平整、致密且均匀,这是由于经醋酸纤维素修饰后,聚四氟乙烯膜内部微孔被醋酸纤维素交织成网状结构,稳定性和生物兼容性得到提高,从而利于酶的固定[26]。图1c中CA-PTFE复合膜表面大部被酶覆盖,且在表面分布均匀,表明大部分的酶被固定在CA-PTFE的界面上,这种结构较利于木瓜蛋白酶的固定化。
2.3 单因素试验结果分析
2.3.1 钝化时空气相对湿度对相对脂肪酶活力的影响
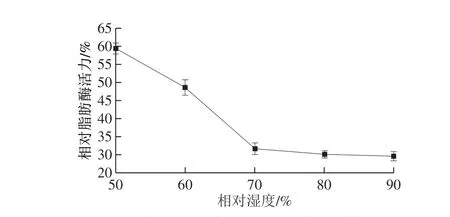
图 2 空气相对湿度对相对脂肪酶活力的影响Fig. 2 Effect of relative humidity of air on relative lipase activity
由图2可以看出,随着操作室内空气相对湿度的增大,米糠相对脂肪酶活力呈先降低后平缓趋势,在50%的空气相对湿度下,脂肪酶相对酶活力最高为59.4%,当空气相对湿度大于80%时,相对酶活力的降低趋于平稳,这是因为体系湿度较大,利于酶膜对米糠的钝化作用,但是由于酶的催化作用只与少部分与酶结合的“结合水”有关,增大空气相对湿度后,过高的水分含量会将酶和底物稀释,从而降低酶促反应速率[27],所以操作室内的相对湿度要适当。综合考虑,空气相对湿度在80%为宜。
2.3.2 钝化温度对相对脂肪酶活力的影响
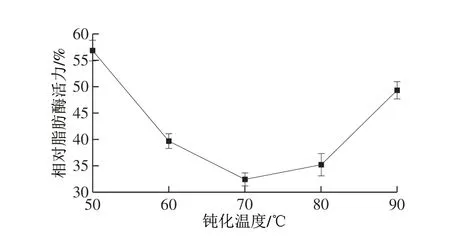
图 3 钝化温度对相对脂肪酶活力的影响Fig. 3 Effect of deactivation temperature on relative lipase activity
由图3可知,随着温度的升高,相对脂肪酶活力呈先降低后增加趋势,当温度达到70 ℃时,相对酶活力达到最低。这是由于温度升高后,木瓜蛋白酶的催化活性部位逐渐暴露,活性逐渐增强[28],与底物油脂竞争性的结合脂肪酶活性中心,从而阻碍脂肪酶与油脂结合,致使脂肪酶被钝化,酶活力降低。而温度继续升高后,相对酶活力出现上升趋势,这可能是因为较高温度使酶膜上固定化酶部分失活所导致的,木瓜蛋白酶的有效作用温度范围是20~80 ℃,超过80 ℃时,木瓜蛋白酶活性会下降,温度升高到90 ℃时木瓜蛋白酶会钝化[29]。因此,固定化木瓜蛋白酶膜作用的最佳温度在70 ℃左右。
2.3.3 钝化时间对相对脂肪酶活力的影响
由图4可以看出,随着钝化时间的延长,米糠的相对脂肪酶活力先急剧降低,在超过100 min后酶活力降低的速度减缓,在第120分钟时达到最低,这是因为随着时间的延长,酶膜的作用效果逐渐体现出来,虽然延长钝化时间,有利于脂肪酶的钝化效果,但时间过长会导致效率的下降,因此综合考虑钝化时间以100 min为宜。
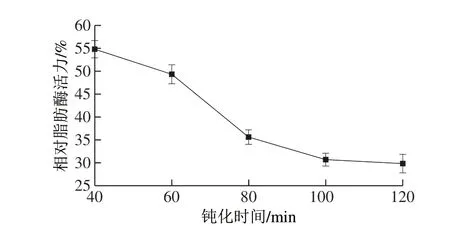
图 4 钝化时间对相对脂肪酶活力的影响Fig. 4 Effect of deactivation time on relative lipase activity
2.4 响应面法优化钝化工艺
2.4.1 响应面试验设计与结果
综合单因素试验的结果,以空气相对湿度(A)、钝化温度(B)、钝化时间(C)3 个因素进行优化,以相对脂肪酶活力(Y)为响应值,进行3因素3水平的响应面分析,使用Design-Expert 8.0.6设计响应面试验以优化参数。Box-Behnken试验设计及结果见表2。
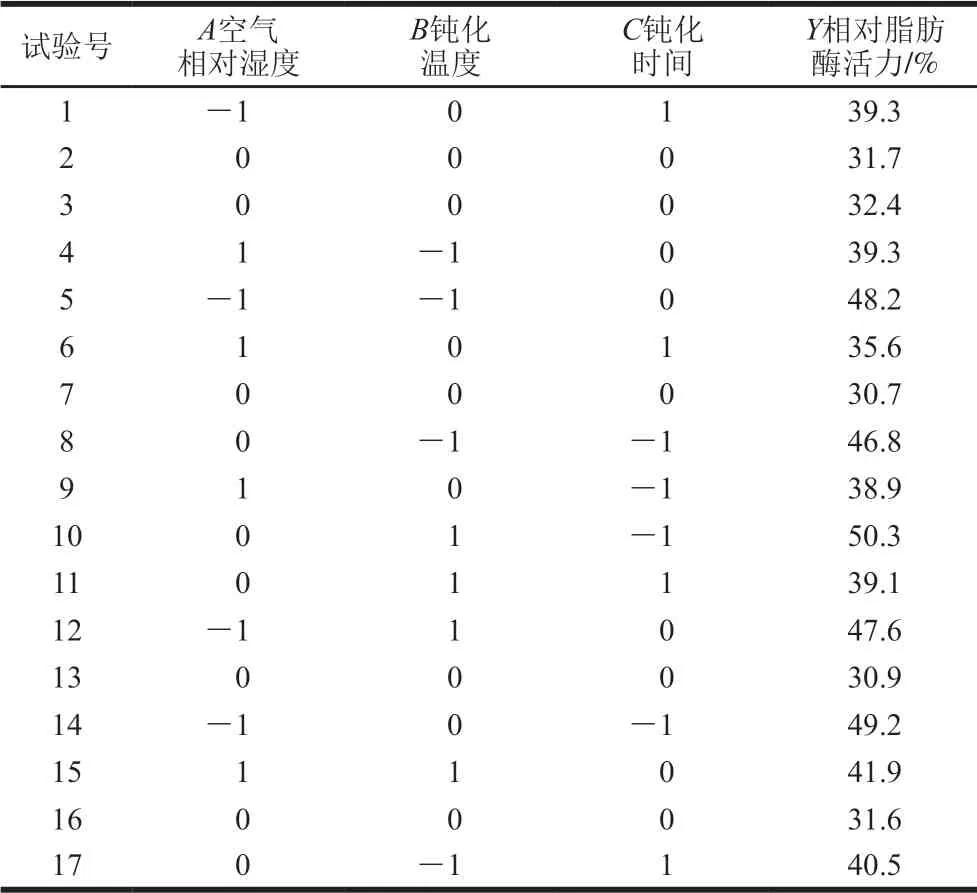
表 2 Box-Behnken试验设计及结果Table 2 Box-Behnken design with experimental results
2.4.2 响应面模型方程建立与显著性分析
利用Design-Expert软件进行拟合得到的空气相对湿度(A)、钝化温度(B)和钝化时间(C)与相对脂肪酶活力(Y)之间的二次多项回归方程如下:
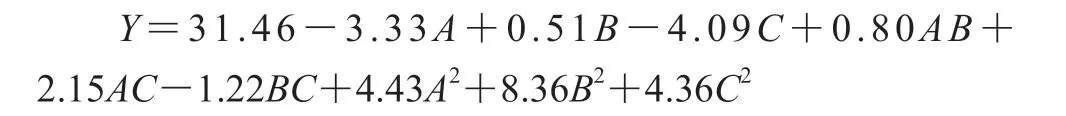
利用Design Expert 8.0.6软件对实验结果进行方差分析,响应面二次模型的方差分析见表3。
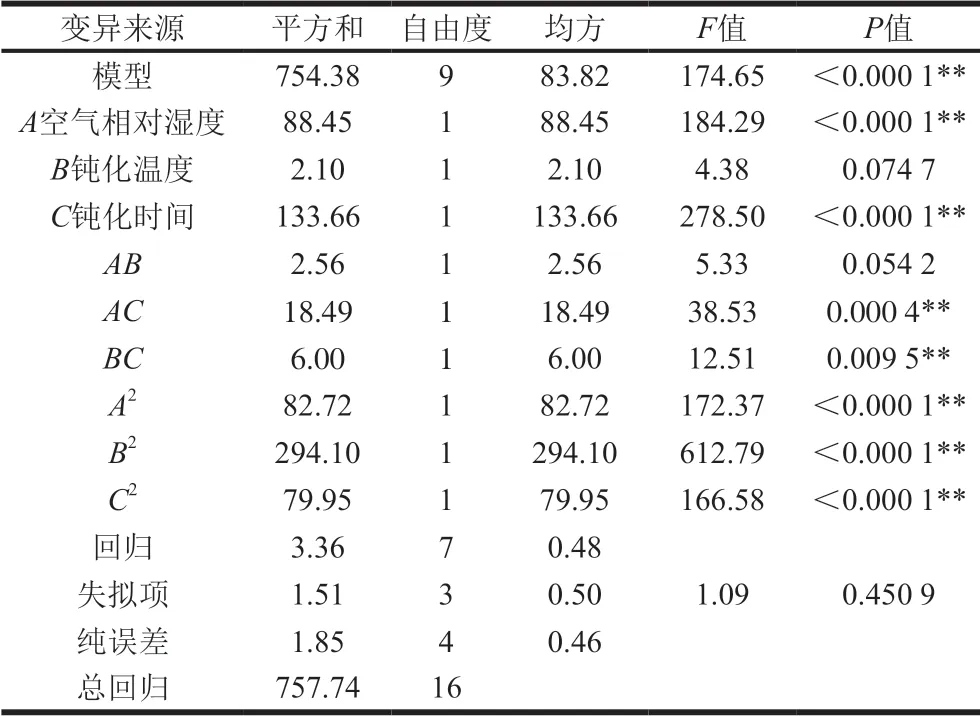
表 3 响应面二次模型的方差分析Table 3 Analysis of variance of response surface quadratic model
由表3可知,整体模型的F=174.65,P<0.000 1,模型极显著,表明回归方程描述各因素与响应值之间的关系时,因变量与所有自变量之间的线性关系显著,即这种实验方法是可靠的。失拟项是用来表示模型与试验拟合的程度,即二者差异的程度。表3中失拟项F值为1.09,P值为0.450 9,失拟项不显著,表明该模型选择正确,且模型中的调整系数R2Adj为98.99%,说明98.99%的响应值变化可通过拟合模型进行解释,相关系数R2为99.56%,表明模型与实验拟合良好,可以用此模型来分析和预测相对脂肪酶活力。从回归方程系数的显著性检验可看出:一次项A和C对响应值的影响极显著,B对响应值的影响不显著。
2.4.3 响应面交互作用分析
本研究考察空气相对湿度、钝化温度和钝化时间3 个因素对米糠的相对脂肪酶活力的影响,钝化参数交互作用对相对脂肪酶活力的影响如图5所示。
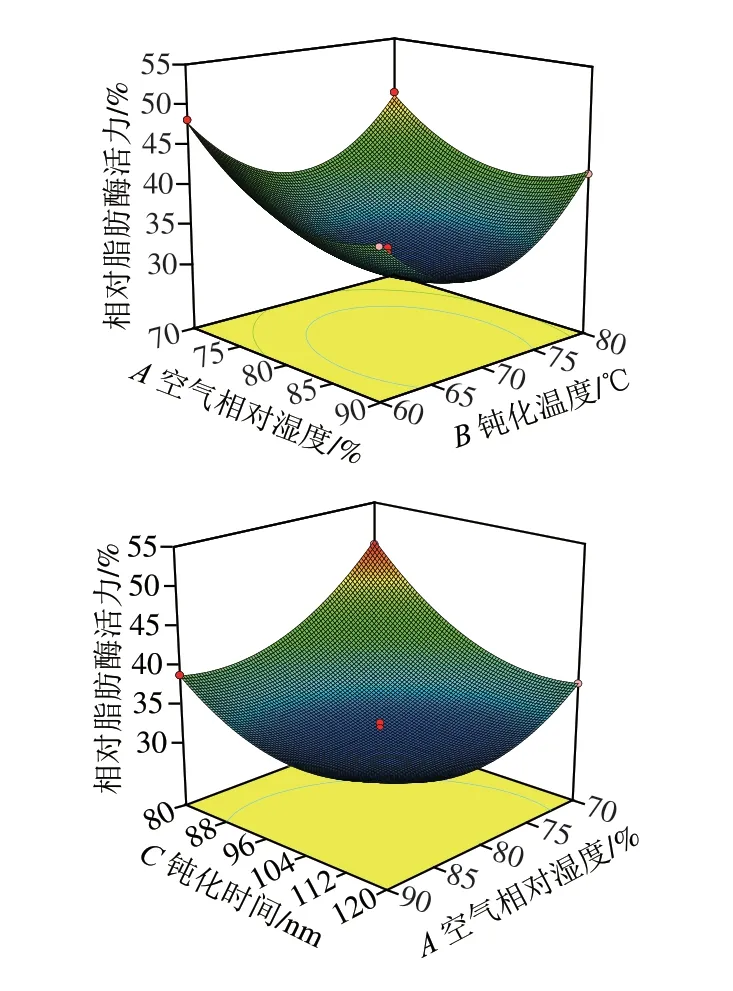

图 5 钝化参数交互作用对相对脂肪酶活力的影响Fig. 5 Response surface plots showing the interactive effect of various factors on relative lipase activity
从图5可以看出,空气相对湿度、钝化时间、钝化温度3 个变量在两两交互时,保持其中1 个变量不变,随着另外2 个变量的增加,相对脂肪酶活力呈现先降低的趋势,当达到一定值时又呈现出上升趋势。3 个因素中AC和BC交互作用为极显著,AB是不显著,即空气相对湿度和钝化时间之间以及钝化温度和钝化时间之间有极显著交互作用,空气相对湿度和钝化温度之间的交互作用不显著。通过试验设计优化得到酶膜稳定米糠的最佳工艺参数为空气相对湿度72.2%、钝化温度70.5 ℃、钝化时间113.4 min,该条件下米糠的相对脂肪酶活力预测值为34.8%。根据实际情况将工艺参数进行整理,得出整理值为空气相对湿度72%、钝化温度71 ℃、钝化时间113 min。在此条件下进行3 次平行实验,该条件下相对脂肪酶活力平均值为35.2%。实测值与预测值之间具有良好的拟合性,从而证实了模型的有效性。同时,测定了在此最佳工艺参数下固定化酶膜钝化后米糠的过氧化物酶活力[30],以新鲜米糠的过氧化物酶活力记为100%,测定结果为过氧化物酶的相对酶活力降到了23.3%,结果表明此方法可以有效钝化米糠中的关键酶,从而提高米糠的贮存稳定性。
2.5 固定化酶膜的操作稳定性
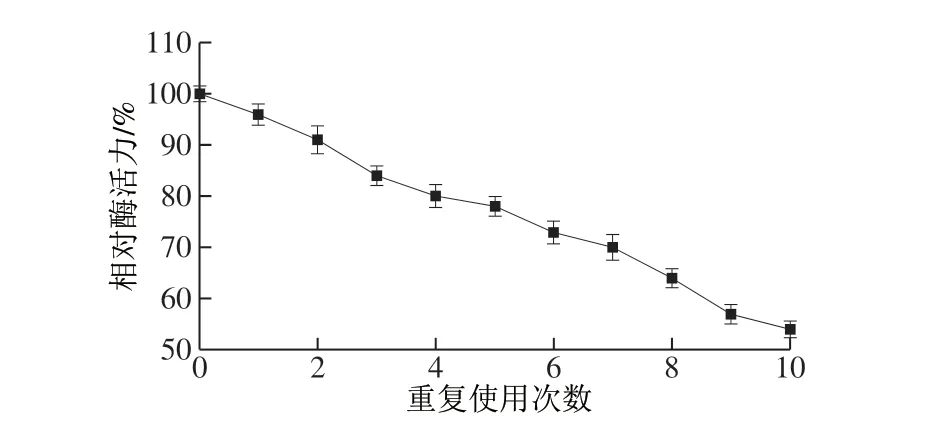
图 6 重复使用次数对固定化酶膜相对酶活力的影响Fig. 6 Effect of number of repeated use on relative activity of immobilized enzyme membrane
在响应面优化的最佳条件下(空气相对湿度72%、钝化温度71 ℃、钝化时间113 min)处理米糠后,重复使用次数对固定化酶膜相对酶活力的影响如图6所示。由图6可看出,酶膜的相对酶活力随重复使用次数的增加而降低,经10 次使用后,相对酶活力为54.2%。这可能是由于随着重复使用次数的增加,酶膜受到的机械损伤增加,出现部分破损、部分固定化酶脱落的现象,均会导致固定化酶活性的降低。同时由于酶本身的失活也会直接导致固定化酶相对酶活力的降低。但酶膜在重复使用6 次后,相对酶活力仍可保持在73.0%以上,这一结果与梁单琼等[21]研究固定化脂肪酶膜的结果一致,说明此酶膜具有良好的操作稳定性。
2.6 复合酶膜钝化后米糠的贮存稳定性

图 7 贮存期间固定化酶膜钝化后米糠中相对脂肪酶活力的变化Fig. 7 Changes in relative lipase activity of rice bran treated with the immobilized enzyme membrane during storage
由图7可以看出,在2 个月的贮存期间里,经固定化木瓜蛋白酶膜钝化后的米糠,其相对脂肪酶活力仍低于36.0%,几乎无明显变化。这与Laokuldilok等[15]研究用木瓜蛋白酶处理的米糠,在2 个月贮存期间里脂肪酶活力变化基本一致,结果证实,应用固定化木瓜蛋白酶膜稳定米糠是一种能有效提高米糠贮存稳定性的方法。
3 结 论
本实验针对米糠的不稳定性质导致其利用率低的缺点,应用CA-PTFE复合膜固定化木瓜蛋白酶对米糠进行钝化处理,降低了米糠中脂肪酶的活力并以此为指标,通过响应面法优化了空气相对湿度、钝化温度和钝化时间对钝化效果的影响,确定了固定化酶膜钝化米糠脂肪酶的最佳钝化条件,在最佳条件下处理后的米糠相对脂肪酶活力为35.2%,表明米糠中的脂肪酶得到有效钝化。且稳定后的米糠贮存2 个月后,其相对脂肪酶活力仍低于36.0%,同时固定化木瓜蛋白酶酶膜重复使用6 次后的相对酶活力仍保持在73.0%以上。本实验在提高米糠稳定性同时,解决了传统游离蛋白酶钝化米糠不可重复利用的问题,降低了生产成本,为酶法稳定米糠提供了新工艺与理论依据。

