水溶液中“三守恒”的应用
李春文
(黑龙江省望奎县第一中学 152100)
水溶液中微粒的三种守恒关系指的是原子(物料)守恒、电荷守恒和质子守恒.三种守恒关系的应用,一直是高考的热点和难点.学生对三种守恒关系理解的不透,不了解它的适用范围,不理解它的真正含义,导致应用时出现很多问题.
一、“三守恒”的含义和适用范围
1.原子(物料)守恒
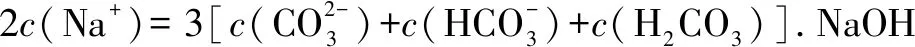
2.电荷守恒

3.质子守恒

二、高考链接
1.(2014·新课标全国卷Ⅱ)一定温度下,下列溶液的离子浓度关系式正确的是( ).
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
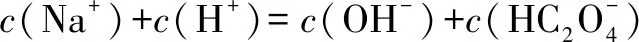
D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
解析A项,pH=5的H2S溶液中,H+的浓度为1×10-5mol·L-1,但是HS-的浓度会小于H+的浓度,H+来自于H2S的第一步电离、HS-的电离和水的电离,故H+的浓度大于HS-的浓度,错误;B项,弱碱不完全电离,弱碱稀释10倍时,pH减小不到一个单位,a
答案:D
2.(2015年江苏卷)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( ).
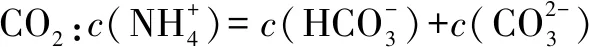
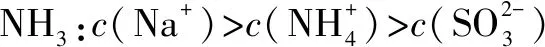
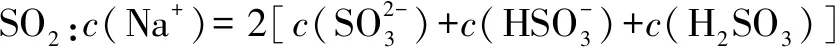
D.向0.10 mol·L-1CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-)
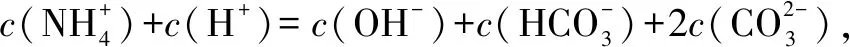
答案:D
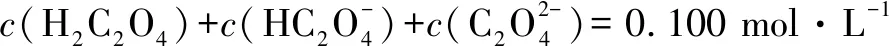
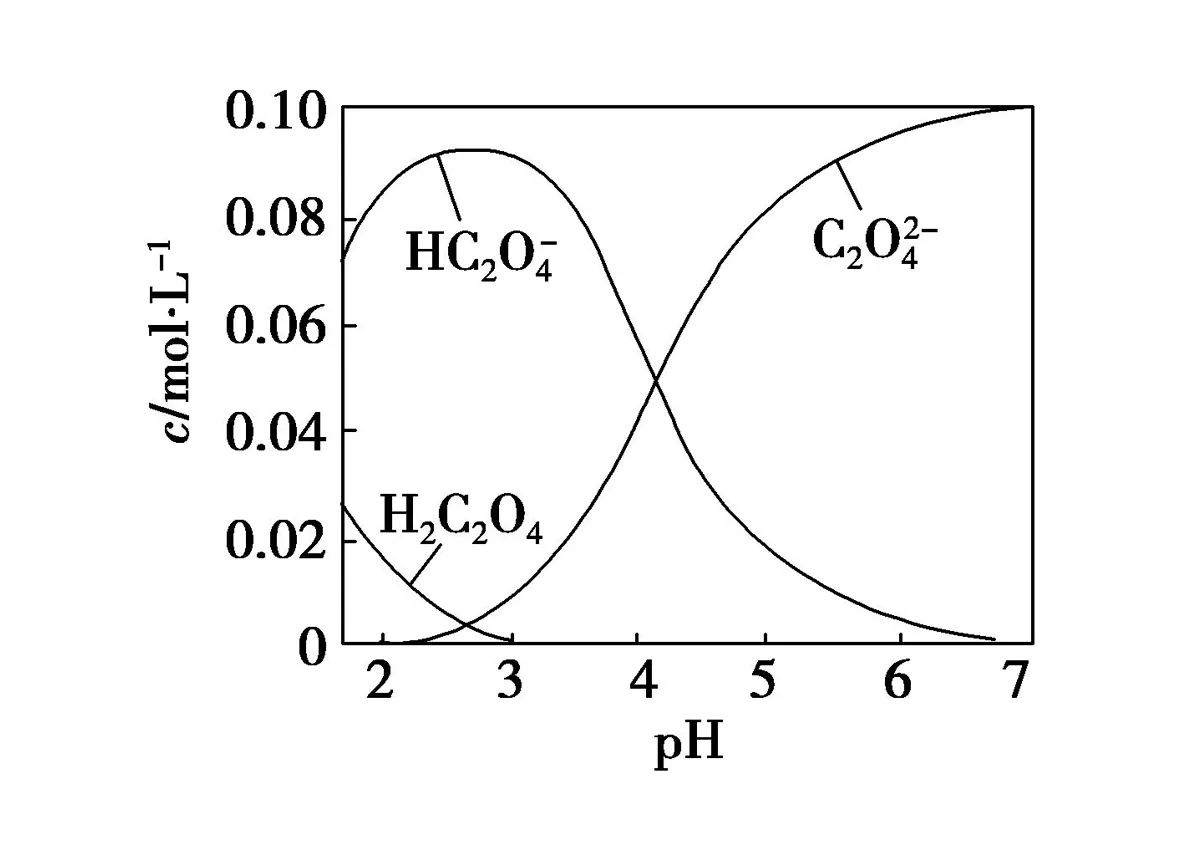
A.pH=2.5的溶液中:
B.c(Na+)=0.100 mol·L-1的溶液中:
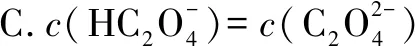

答案:BD
4.(2015年浙江卷)40℃,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示.下列说法不正确的是( ).
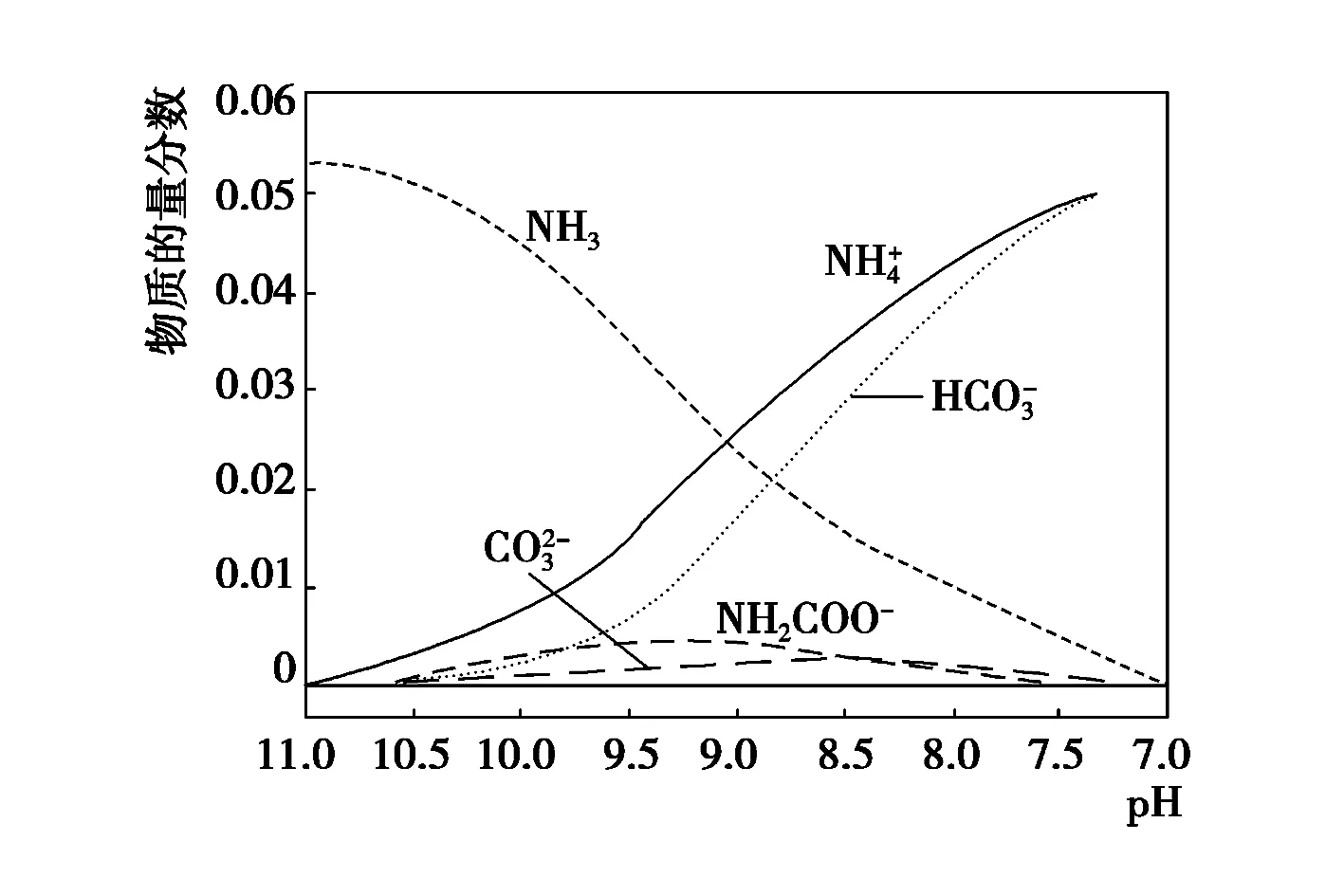
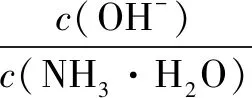
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
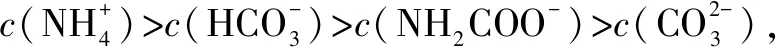
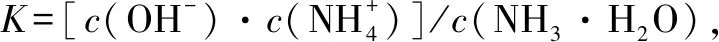
答案:C

