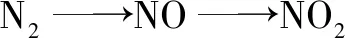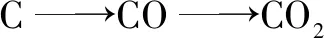元素推断题分类突破
穆玉鹏
(山东省博兴第一中学 256500)
一、根据原子结构与物质组成推断
1.元素推断中常用的两条规律
(1)最外层电子规律

最外层电子数(N)3≤N<8N=1或2N>次外层电子数元素在周期表中的位置主族(ⅢA~ⅦA族)ⅠA族、ⅡA族、第Ⅷ族、副族、0族元素氦第二周期(Li、Be除外)
(2)“阴上阳下”规律
电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期——“阴上阳下”规律.如O2-、F-、Na+、Mg2+、Al3+电子层结构相同,则Na、Mg、Al位于O、F的下一周期.
2.物质的特殊组成
(1)O与H可形成H2O、H2O2.
(2)O与Na可形成Na2O、Na2O2.
(3)C与H可形成多种烃类物质(如CH4、C2H4、C2H2等).
(4)N与H可形成NH3、N2H4、NH4H.
(5)O与S可形成SO2、SO3.
(6)N的含氧酸有HNO2、HNO3.
(7)S的含氧酸有H2SO4、H2SO3.
(8)Cl的含氧酸有HClO、HClO2、HClO3、HClO4.
(9)Si的含氧酸有H2SiO3、H4SiO4.
(10)N与O可形成N2O、NO、N2O3、NO2、N2O4、N2O5.
例1a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+的电子层结构相同,d与b同族.下列叙述错误的是( )
A.a与其他三种元素分别形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d与a形成的化合物的溶液呈弱酸性
解析
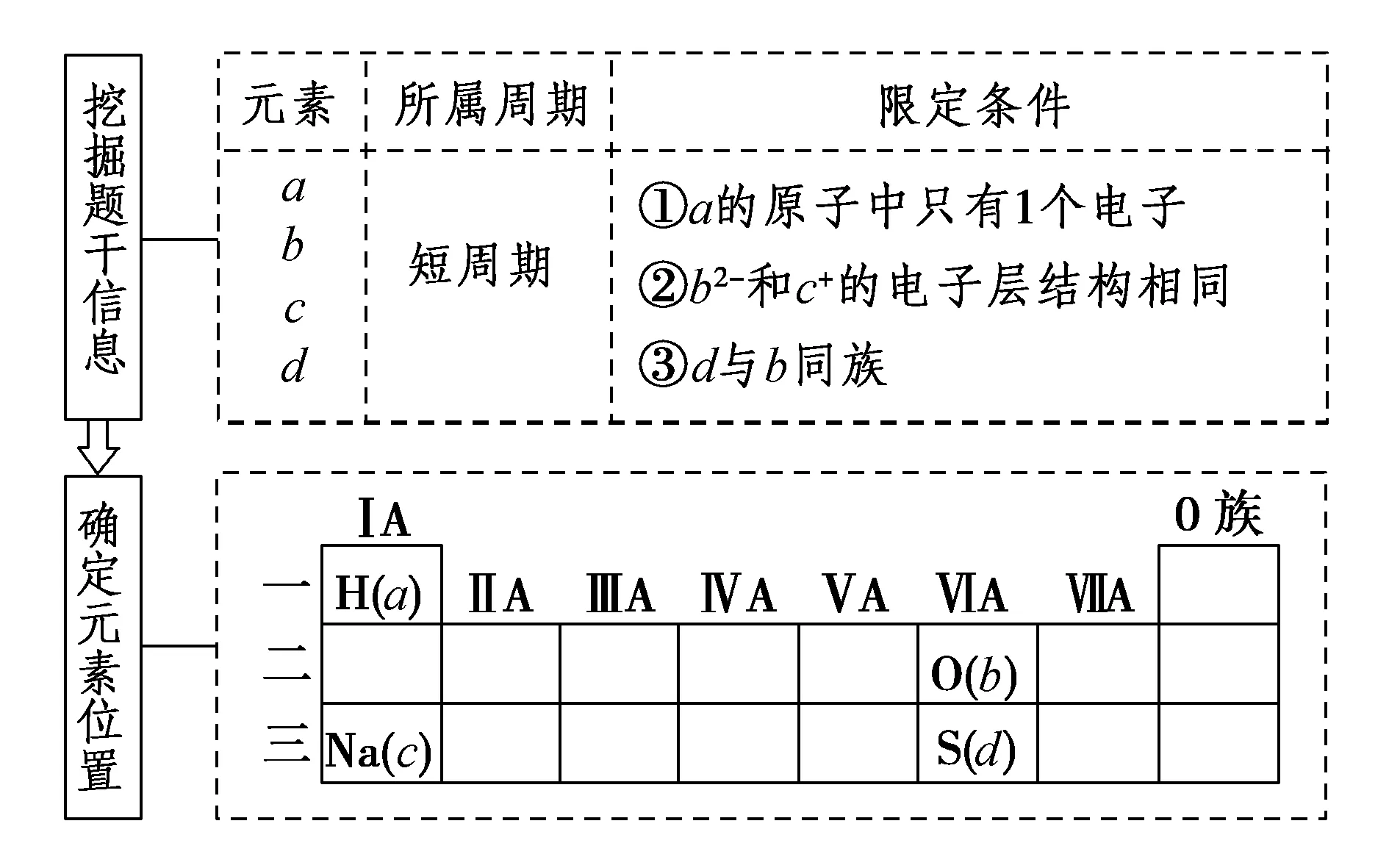
答案:A
二、依据元素周期表的“片段结构”推断元素
1.同主族上下相邻周期元素的原子序数关系
(1)若在ⅠA族或ⅡA族,原子序数之差为上周期所包含的元素种数.
(2)若在ⅢA~ⅦA族,原子序数之差为下周期所包含的元素种数.
如第三周期和第四周期的同族相邻元素,若在ⅠA或ⅡA族,原子序数之差为8;若在ⅢA~ⅦA族,原子序数之差为18.
2.第一到第四周期主族元素在周期表中的特殊位置
(1)族序数等于周期数的元素:H、Be、Al、Ge.
(2)族序数等于周期数2倍的元素:C、S.
(3)族序数等于周期数3倍的元素:O.
(4)周期数是族序数2倍的元素:Li、Ca.
(5)周期数是族序数3倍的元素:Na.
(6)最高正价与最低负价代数和为零的元素:H、C、Si、Ge.
(7)最高正价是最低负价绝对值3倍的短周期元素:S、Se.
(8)除H外,原子半径最小的元素:F.
例2短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21.下列关系正确的是( ).

WXYZ
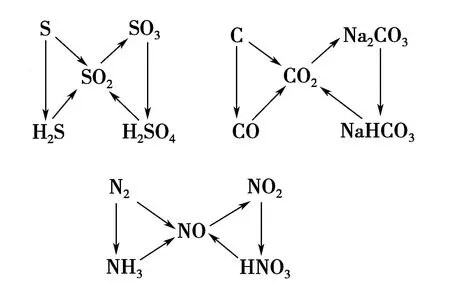
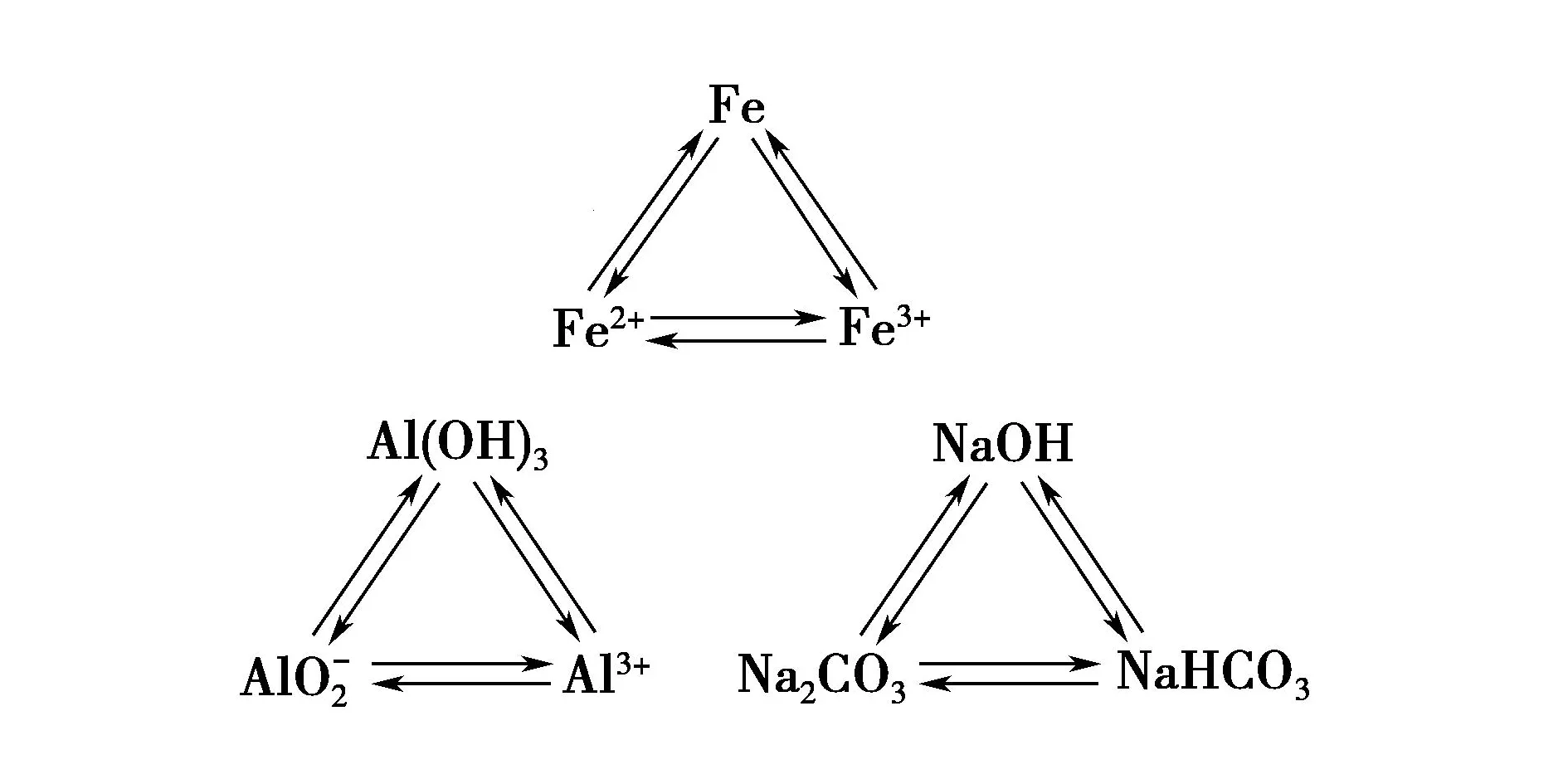
A.氢化物沸点:W B.氧化物对应水化物的酸性:Y>W C.化合物熔点:Y2X3 D.简单离子的半径:Y 设W的最外层电子数为x,则得x-2+x+x+1+x+2=21,故x=5,故W、X、Y、Z分别为N、O、Al、Cl. 答案:D 1.以常见元素及其化合物特性为突破口 (1)形成化合物种类最多、单质是自然界中硬度最大、气态氢化物中氢元素的质量分数最大的元素:C. (2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N. (3)地壳中含量最多的元素或气态氢化物的沸点最高的元素或氢化物在通常情况下呈液态的元素:O. (4)地壳中含量最多的金属元素:Al. (5)最活泼的非金属元素或无正价的元素或无含氧酸的非金属元素或无氧酸(气态氢化物)可腐蚀玻璃的元素或气态氢化物最稳定的元素或阴离子的还原性最弱的元素:F. (6)焰色反应呈黄色的元素:Na. (7)单质密度最小的元素:H;密度最小的金属元素:Li. (8)常温下单质呈液态的非金属元素:Br,金属元素:Hg. (9)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al. (10)元素的气态氢化物和它的最高价氧化物对应水化物发生化合反应的元素:N;能发生氧化还原反应的元素:S. (11)元素的气态氢化物能和它的氧化物在常温下反应生成该元素单质的元素:S. (12)元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F. (13)短周期元素构成的化合物:①0.01 mol·L-1的溶液pH=12(常温)为NaOH溶液;②0.01 mol·L-1的溶液pH<2(常温)可能为H2SO4溶液;③0.01 mol·L-1的溶液pH=2(常温)可能为HNO3、HCl、HClO4溶液. 2.单质及其化合物的常见转化 (1)直线型转化关系 ①X为O2 ②X为CO2 ③X为强酸,如HCl ④X为强碱,如NaOH (2)交叉型转化关系 (3)三角型转化关系 例3W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族.盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液.下列说法正确的是( ). A.原子半径大小为W B.X的氢化物水溶液酸性强于Z的 C.Y2W2与ZW2均含有非极性共价键 D.标准状况下W的单质状态与X的相同 根据元素周期律,可知原子半径:Na>Cl>O>F,A项错误;HF是弱酸,HCl为强酸,酸性:HF 答案:D

三、元素推断与物质推断的融合