肾衰营养胶囊对肾性骨病大鼠骨代谢及股骨组织BMP-2表达的影响
伍晓辉,尤海岩,胡蓉,刘玲玉,王明清,魏连波,2△
慢性肾脏病(chronic kidney disease,CKD)是一类威胁人类健康的重大疾病,发病率高、危害大且医疗费用昂贵。荟萃分析发现,中国成人CKD患病率为13.4%[1]。肾性骨病(renal osteodystrophy,ROD)又称肾性骨营养不良,是慢性肾脏病的主要并发症之一[2]。研究发现,伴随着 CKD 的进程,ROD 的发病率亦呈增高趋势,当进展至终末期肾病(end-stage renal disease,ESRD)时,几乎所有的患者均出现肾性骨病[3]。ROD临床表现以钙、磷代谢障碍,酸碱平衡失调、维生素D 代谢异常以及继发性甲状旁腺机能亢进等为特征,骨骼损害主要表现为骨质疏松、纤维囊性骨炎、骨软化或硬化、骨畸形和转移性钙化等[4],这些症状严重影响了患者的生活质量和生存时间。目前,临床上治疗ROD的主要手段是控制血清磷酸盐、钙和甲状旁腺激素的水平,但疗效有限,患者死亡率仍很高[5]。近年有研究显示,中医药在治疗ROD 上取得了可观的进展[6-7]。肾衰营养胶囊是魏连波教授治疗慢性肾衰竭导致的营养不良的经验方,既往的临床观察和动物实验已证明肾衰营养胶囊确实能改善慢性肾衰竭引起的营养不良。本研究拟观察肾衰营养胶囊对ROD 模型大鼠骨代谢以及股骨组织骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)表达的影响,探讨其可能的作用机制,为中医药治疗肾性骨病提供参考。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠40 只,6~7周龄,体质量(200±20)g,由南方医科大学实验动物中心提供(实验动物中心许可证号:SCXK 2017 - 0167),合格证号:NO.4400210005310。
1.2 主要试剂与仪器 肾衰营养胶囊处方:党参(25 g)、白术(10 g)、茯苓(15 g)、甘草(5 g)、杜仲(15 g)、黄芪(25 g)、当归(10 g)、大黄(10 g)、春砂仁(10 g),购自广东省药材公司,经南方医科大学中药制剂室鉴定,并由中药新药实验室按处方比例提取制成胶囊,每克成药含生药5.67 g,将成药制成质量浓度为0.12 g/mL 的悬浊液。骨化三醇(规格:0.25µg/片)购自海尔药业,用蒸馏水配制成质量浓度为1 mg/L 的悬浊液。兔抗BMP-2多克隆一抗(美国Santa Cruz 公司),辣根过氧化物酶标记的羊抗兔二抗(CST 公司),兔抗GAPDH(英国Abcam 公司)。总蛋白提取试剂盒、微型离心机、电泳仪、转膜仪、血iPTH 免疫检测试剂盒(上海泽叶生物科技有限公司)。Cobase111自动生化仪(瑞士Roche公司),GE DPX-NT型双能X射线骨密度床机(美国通用电气公司)。
1.3 方法
1.3.1 动物造模和分组 大鼠适应性饲养1周后随机分为造模组(n=30)和对照组(Control 组,n=10)。造模组大鼠以3%戊巴比妥钠腹腔注射麻醉,俯卧位打开腹腔,暴露左侧肾脏,剥离肾包膜,切除左肾上下极各1/3组织,可吸收明胶海绵止血,观察无出血后关闭腹腔;1周后再次打开腹腔,用缝合线结扎右侧肾蒂,摘除右肾,观察无出血后关闭腹腔。Control组大鼠同样进行两期手术,但仅剥离肾包膜,不作肾切除。造模组随机分为模型组(Model 组,n=10)、肾衰营养胶囊组(SSYYJN 组,n=10)和骨化三醇组(VD 组,n=10)。Model 组、SSYYJN 组和VD 组给予正常饮食和高磷饮水饲养(NaH2PO40.5 g/d)。术后1 个月开始药物灌胃,大鼠灌胃容量1 mL/(100 g·d)。SSYYJN 组按大鼠等效剂量(成药1.2 g/kg)灌胃给药,VD 组按 0.01 mg/kg 灌胃给药,Control 组和 Model 组等量生理盐水灌胃,灌胃持续12周。实验过程中Model组死亡2只,SSYYJN组死亡1只,VD组死亡2只。
1.3.2 造模成功的标准 高磷饮水饲养4周后取血,检测大鼠血生化指标,造模大鼠血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)、血清磷(P3-)、甲状旁腺激素(parathyroid hormone,PTH)明显高于对照组,而钙(Ca2+)明显低于对照组说明肾性骨病模型造模成功。
1.3.3 观察指标 (1)一般情况:每天观察动物的一般状况,包括外形、精神状态、饮食等,并于给药前及给药后每4周测量一次体质量。(2)标本采集与检测:分别在大鼠给药干预前与干预后于眼眶静脉取血,自动生化仪检测血清Scr、BUN、ALP、Ca2+、P3-浓度,免疫化学发光法检测血清全段甲状旁腺激素(iPTH)浓度。给药结束后处死大鼠,取完整左侧股骨,剥离肌肉,干燥后GE DPX-NT 型双能X 射线骨密度床机检测股骨骨密度(BMD)。(3)Western blot 检测股骨组织BMP-2的表达:提取大鼠股骨组织总蛋白,用BCA法检测蛋白含量。加上样缓冲液,PCR 电泳仪99 ℃变性10 min,制备10%的分离胶和5%的浓缩胶,上样电泳,每孔上样体积为25µL,进行SDS-PAGE分离,电泳2 h后取胶,在转膜仪上将蛋白质转移到PVDF 膜上。转完后用TBST 清洗3 次,每次10 min,然后转入5%脱脂奶粉中封闭1 h,用TBST洗涤3次,每次10 min,孵育兔抗BMP-2 多克隆一抗(1∶1 000)、兔抗GAPDH 一抗(1∶1 000),4 ℃冰箱过夜,取出后TBST 洗涤3 次,每次10 min,二抗(1∶10 000)室温孵育1 h,TBST 洗涤3 次,每次 10 min,ECL化学发光检测,Kodak Image Station 2000 MM成像系统曝光,获取目的条带图像。
1.4 统计学方法 采用SPSS 22.0 统计软件进行统计学处理。符合正态分布的计量资料数据均以表示,多组间比较采用单因素方差分析,重复测量数据多组间比较采用重复测量的多因素方差分析,组间两两比较,方差齐时采用LSD-t法,方差不齐时采用Dunnetts’s T3 法,治疗前后各项参数比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 肾衰营养胶囊对大鼠一般状态的影响 造模后,Model组、VD组大鼠精神状态萎靡,眼神无力,饮食状况不佳;SSYYJN 组大鼠精神状态较Model 组、VD组明显改善,行动较敏捷,进食良好;Control组饮食、精神状态正常。
2.2 肾衰营养胶囊对大鼠体质量的影响 时间效应和干预措施对各组大鼠体质量均有影响,且存在交互作用(P<0.05)。(1)组间比较:0周时,各组大鼠体质量差异无统计学意义(P>0.05);4、8、12 周时,Model 组、VD 组、SSYYJN 组与 Control 组比较体质量明显下降(P<0.05),SSYYJN 组较Model 组及VD 组体质量显著增加(P<0.05),VD组与Model组比较差异无统计学意义(P>0.05)。(2)组内比较:Control组和SSYYJN 组大鼠体质量随时间而增加(P<0.05),Model 组和VD 组在8 周以前体质量随时间而增加(P<0.05),8 周到12 周体质量差异无统计学意义(P>0.05)。见表1。
2.3 肾衰营养胶囊对大鼠BUN、Scr的影响 (1)组间比较:给药前,Model 组、VD 组、SSYYJN 组与Control 组比较血 BUN、Scr 明显升高(P<0.05),Model 组、VD 组和 SSYYJN 组间差异无统计学意义(P>0.05);给药后,Model 组、VD 组、SSYYJN 组与Control 组比较血 BUN、Scr 仍升高(P<0.05),但SSYYJN 组与 Model 组、VD 组比较血 BUN、Scr 降低(P<0.05),Model组与VD组比较差异无统计学意义(P>0.05)。(2)组内比较:给药前和给药后血BUN、Scr相比较,Control组差异无统计学意义(P>0.05),Model 组和 VD 组升高(P<0.05),SSYYJN 组降低(P<0.05)。见表2。
2.4 肾衰营养胶囊对大鼠骨代谢指标血清ALP、iPTH、Ca2+、P3-含量的影响 (1)组间比较:给药前,Model 组、VD 组、SSYYJN 组与 Control 组比较,血清ALP、iPTH、P3-升高,Ca2+降低(P<0.05),Model 组、VD组和SSYYJN组间差异无统计学意义(P>0.05);给药后,Model 组与Control 组比较,血清ALP、iPTH、P3-仍升高,Ca2+降低(P<0.05),而SSYYJN 组及VD组与Model 组比较血清ALP、iPTH、P3-降低,Ca2+升高(P<0.05),SSYYJN组与VD组比较差异无统计学意义(P>0.05)。(2)组内比较:给药前和给药后Control 组血清ALP、iPTH、Ca2+、P3-含量变化差异无统计学意义(P>0.05),Model 组ALP、iPTH、P3-升高,Ca2+降低(P<0.05),SSYYJN 组和 VD 组 ALP、iPTH、P3-降低,Ca2+升高(P<0.05)。见表3。
2.5 肾衰营养胶囊对BMD和BMP-2表达水平的影响 Model 组 BMD、BMP-2 蛋白明显低于 Control 组(P<0.05);与 Model 组比较,SSYYJN 组和 VD 组BMD、BMP-2 蛋白水平均明显增高(P<0.05);SSYYJN 组和 VD 组 BMD 差异无统计学意义(P>0.05),而BMP-2蛋白表达水平升高(P<0.05),见表4、图1。
Tab.1 Changes of body weights in four groups of rats表1 各组大鼠的体质量变化 (g,)

Tab.1 Changes of body weights in four groups of rats表1 各组大鼠的体质量变化 (g,)
**P<0.01;F组间=744.921,F时间=2 422.113,F交互=191.432,均P<0.01;组间比较:a与Control组比较,b与Model组比较,c与VD组比较,均P<0.05;组内比较:A与0周时比较,B与4周时比较,均P<0.05
组别Control组Model组VD组SSYYJN组n 10 8 8 9 0周204.23±7.80 200.43±9.21 197.59±5.89 202.76±8.34 4周303.34±6.45A 260.65±7.32aA 262.13±6.23aA 280.97±7.38abcA 8周400.56±9.20AB 290.42±6.87aAB 295.78±7.89aAB 330.46±7.96abcAB 12周480.78±11.21 292.35±6.43a 301.32±9.21a 370.67±8.45abc
Tab.2 Results of BUN and Scr levels before and after treatment in four groups of rats表2 各组大鼠给药前后肾功能指标BUN、Scr检测结果 ()
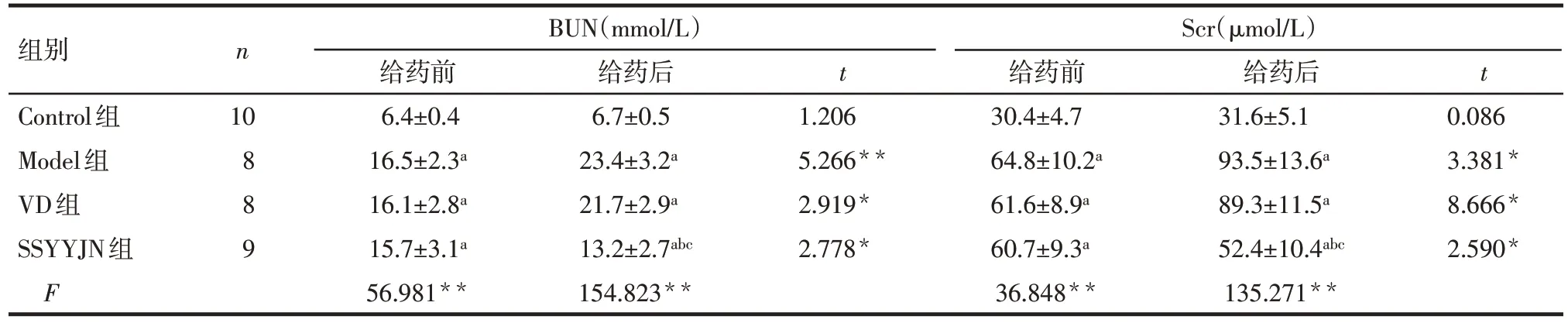
Tab.2 Results of BUN and Scr levels before and after treatment in four groups of rats表2 各组大鼠给药前后肾功能指标BUN、Scr检测结果 ()
*P<0.05,**P<0.01;a与Control组比较,b与Model组比较,c与VD组比较,均P<0.05
组别Control组Model组VD组SSYYJN组F n BUN(mmol/L)Scr(µmol/L)给药前6.4±0.4 16.5±2.3a 16.1±2.8a 15.7±3.1a 56.981**给药后6.7±0.5 23.4±3.2a 21.7±2.9a 13.2±2.7abc 154.823**t t 10 8 8 9 1.206 5.266**2.919*2.778*给药前30.4±4.7 64.8±10.2a 61.6±8.9a 60.7±9.3a 36.848**给药后31.6±5.1 93.5±13.6a 89.3±11.5a 52.4±10.4abc 135.271**0.086 3.381*8.666*2.590*
Tab.3 Comparison of serum levels of ALP,iPTH,Ca2+and P3-before and after treatment between four groups of rats表3 各组大鼠给药前后血清ALP、iPTH、Ca2+及P3-水平比较 ()
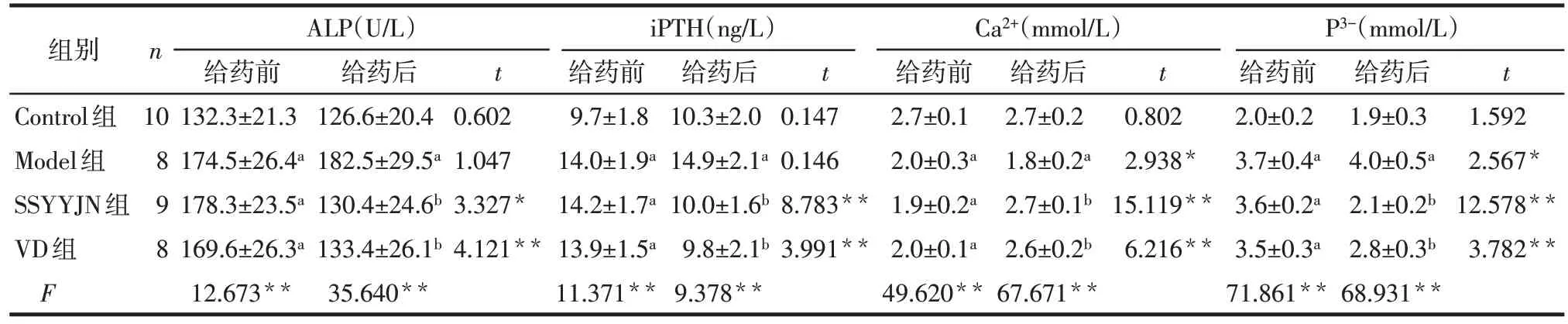
Tab.3 Comparison of serum levels of ALP,iPTH,Ca2+and P3-before and after treatment between four groups of rats表3 各组大鼠给药前后血清ALP、iPTH、Ca2+及P3-水平比较 ()
*P<0.05,**P<0.01,a与Control组比较,b与Model组比较,均P<0.05
组别Control组Model组SSYYJN组VD组F n 给药后126.6±20.4 182.5±29.5a 130.4±24.6b 133.4±26.1b 35.640**iPTH(ng/L)给药前9.7±1.8 14.0±1.9a 14.2±1.7a 13.9±1.5a 11.371**给药后10.3±2.0 14.9±2.1a 10.0±1.6b 9.8±2.1b 9.378**t t t Ca2+(mmol/L)给药前2.7±0.1 2.0±0.3a 1.9±0.2a 2.0±0.1a 49.620**10 8 9 8 ALP(U/L)给药前132.3±21.3 174.5±26.4a 178.3±23.5a 169.6±26.3a 12.673**给药后2.7±0.2 1.8±0.2a 2.7±0.1b 2.6±0.2b 67.671**t 0.602 1.047 3.327*4.121**0.147 0.146 8.783**3.991**0.802 2.938*15.119**6.216**P3-(mmol/L)给药前2.0±0.2 3.7±0.4a 3.6±0.2a 3.5±0.3a 71.861**给药后1.9±0.3 4.0±0.5a 2.1±0.2b 2.8±0.3b 68.931**1.592 2.567*12.578**3.782**
Tab.4 Comparison of BMD and BMP-2 expression levels in the 12th week between four groups of rats表4 各组大鼠第12周BMD和BMP-2表达水平比较 ()
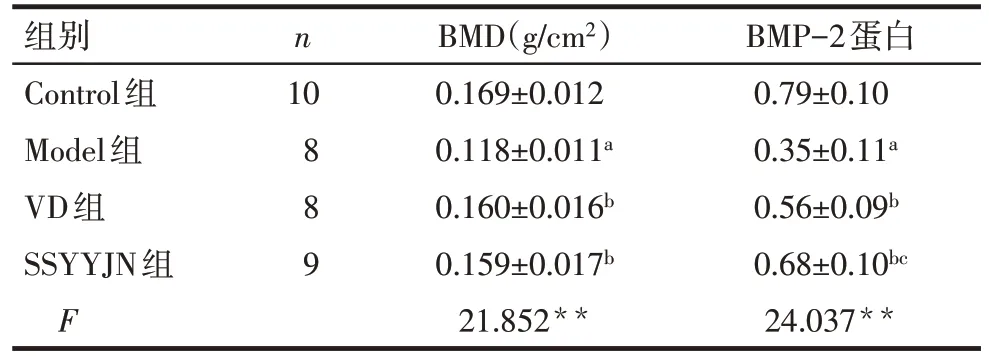
Tab.4 Comparison of BMD and BMP-2 expression levels in the 12th week between four groups of rats表4 各组大鼠第12周BMD和BMP-2表达水平比较 ()
**P<0.01;a与Control 组比较,b与Model 组比较,c与 VD 组比较,均P<0.05
组别Control组Model组VD组SSYYJN组F n 10 8 8 9 BMD(g/cm2)0.169±0.012 0.118±0.011a 0.160±0.016b 0.159±0.017b 21.852**BMP-2蛋白0.79±0.10 0.35±0.11a 0.56±0.09b 0.68±0.10bc 24.037**
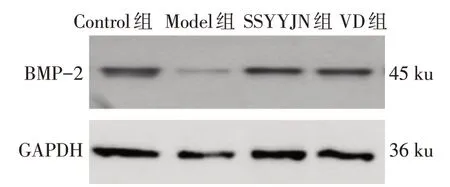
Fig.1 The expression levels of BMP-2 in femur of each group图1 各组大鼠股骨组织BMP-2表达
3 讨论
肾性骨病骨骼的主要病理变化包括骨转换、骨矿化、骨容积、骨线性生长或骨强度异常[8]。在CKD进展过程中,由于饮食中维生素D 摄入不足以及肾脏1-α羟化酶分泌减少,造成1,25-(OH)2-Vit D3生成障碍,从而导致肠道钙吸收减少,血钙水平降低,维生素D和钙的减少使得其对甲状旁腺细胞的抑制作用减弱,最终引起PTH分泌增多[9]。另一方面,随着肾小球滤过率(glomerular filtration rate,GFR)的降低,肾脏对磷的排泄减少,造成血磷增多,也会刺激PTH的分泌。PTH的大量分泌使骨骼的代谢呈高转换状态,血清ALP 浓度增高,且骨吸收大于骨形成,造成骨质的丢失[10],而低钙和高磷血症又引起骨矿化障碍,以上多种因素共同加速了ROD 的进程。ROD 发病机制复杂,目前临床上尚缺乏疗效确切、不良反应少的治疗手段。有研究显示,中药复方提取液能改善ROD 大鼠肾功能,提高其骨密度[11],但机制不十分清楚。近年来随着对TGF-β 超家族蛋白研究的深入,发现BMP-2是TGF-β超家族中诱导成骨细胞分化最强的蛋白,BMP-2在成骨部位高表达并通过增加骨钙素及Ⅰ型胶原合成,使细胞外基质矿化,促进间充质细胞向软骨细胞和成骨细胞分化,加速新生骨的生成来修复软骨缺损及进行骨重建[12-14]。近期有研究显示,对循环中BMP-2的干预能减少肾纤维化,延缓 CKD 进展[15],提示 BMP-2 在CKD及由其发展而来的ROD中发挥重要作用。
本研究结果显示,各造模组大鼠给药前肾功能指标血BUN、Scr 水平较对照组明显升高,骨代谢指标血Ca2+降低,血P3-、iPTH、ALP 上升,说明随大鼠肾功能下降,其钙磷代谢紊乱,甲状旁腺功能亢进,骨重塑与形成减少。给予肾衰营养胶囊干预后,大鼠血 BUN、Scr 水平明显降低,血 Ca2+升高,血 P3-、iPTH、ALP 降低,表明肾衰营养胶囊能有效改善ROD 大鼠肾功能以及骨代谢。蛋白印迹结果显示,模型组大鼠股骨BMP-2的表达较对照组减少,给予骨化三醇和肾衰营养胶囊干预后BMP-2 在骨组织中的表达增加,且肾衰营养胶囊对BMP-2的表达增加作用更为明显,同时,跟BMP-2 表达的增加保持一致,大鼠股骨密度亦升高,表明BMP-2 可能是肾衰营养胶囊的作用靶点。
中医理论认为:“肾充则髓实”,肾精充沛,则骨骼坚实。若肾精亏虚,则骨髓化生乏源,骨骼脆弱无力,易骨折,肾虚及脾,最终导致脾肾阴阳衰惫,湿浊毒邪内蕴。所以,针对ROD 病机,治法当以补肾健脾泄浊为核心。肾衰营养胶囊中四君子汤加黄芪补气健脾,杜仲补肾壮阳,大黄、砂仁通腑泻浊。有研究显示,黄芪多糖可以延缓肾小球硬化,增加肾小球滤过率和肾脏血流灌注量[16];杜仲总黄酮具有诱导骨髓间充质干细胞分化为成骨细胞的作用,可通过促进骨髓基质细胞增殖来促进骨的形成[17];大黄能祛浊排毒,从多方面延缓慢性肾功能衰竭(chronic renal failure,CRF),如抑制肾脏高代谢,抑制系膜细胞增生等[18]。既往的研究表明肾衰营养胶囊可以抑制血管炎症相关因子的水平,改善CRF 微炎症状态下血管损伤,同时也能延缓肾小球、肾小管纤维化[19]。
综上所述,肾衰营养胶囊不但能延缓ROD模型大鼠肾功能的恶化,同时还能改善钙磷代谢,降低碱性磷酸酶活性,调节PTH 水平,改善骨代谢,增加股骨BMD 等。推测其改善骨代谢途径可能与上调BMP-2的表达有关,但具体调节机制还有待进一步研究。BMP-2 是肾衰营养胶囊改善ROD 的可能靶点,可为中医药干预CKD 及其并发症的治疗提供参考。

