基于NLRP3-IL-1β-NF-κB信号轴研究野菊花总黄酮对脂多糖诱导HK-2细胞炎性反应及自噬的影响
杨彬,黄俊卿△,孟庆良,袁威起,梁新
痛风为临床常见代谢疾病,单钠尿酸盐晶体沉积过多为痛风发生的重要物质基础,人体中大部分尿酸盐均经过肾脏排出,当肾小管重吸收异常后,会造成尿酸盐累积,引发痛风、高尿酸血症等[1]。既往研究发现核苷酸结合域样受体蛋白3(NACHT,LRR and PYD domains-containing protein 3,NALP3)在受到尿酸盐作用下分泌大量白细胞介素1β(Interleukin-1β,IL-1β)促炎性因子等扩大炎症反应参与痛风关节炎的发生、发展[2]。近期有研究发现核因子κB(Nuclear factor-κB,NF-κB)也可活化NLRP3炎性体,进一步激活caspase-1、IL-1β后又作用于NF-κB,促进炎症反应,推测NLRP3-IL-1β-NF-κB信号轴可能参与痛风关节炎的发生[3]。野菊花属于菊科植物提取物,具有提高冠脉血流、降血压、增强免疫力的作用,现代药理学显示其具有抗氧化、抗炎、抗肿瘤等功效[4]。临床研究发现野菊花提取物可通过抑制黄嘌呤氧化酶(XOD)活性进而抑制尿酸的形成来发挥抗痛风的作用,然而具体分子机制目前尚不明确[5]。本研究旨在探究野菊花总黄酮对LPS诱导后人肾小管上皮HK-2细胞炎性的抑制、自噬诱导作用,并初步探究可能的作用机制。
1 材料与方法
1.1 实验细胞 人肾小管上皮HK-2 细胞购于上海斯信生物科技有限公司,用含10%胎牛血清(Fetal bovine serum,FBS)的DMEM培养基在37 ℃、5%CO2条件下培养,隔日传代1次,传代3次后取对数生长期细胞进行实验。
1.2 试剂与仪器 野菊花总黄酮(Total flavonoids of chrysanthemum indicum,TFC)(货号:170217,总黄酮含量>70%)购于西安昌岳生物科技有限公司;NLRP3 激活剂(4'-O-Methylresveratrol)购于美国 MCE 公司(货号:33626-08-3);FBS(A3160802)、DMEM培养基(C11995500BT)购于美国Gibco公司;CCK-8细胞增殖测定试剂盒(货号:KTC011001)购于美国Sigma 公司;脂多糖(Lipopolysaccharide,LPS)试剂(货号:L8880)购于索莱宝科技有限公司;Hoechst33342染色剂(货号:C1018)购于上海碧云天生物技术有限公司;兔抗人NLRP3(15101)、caspase-1(24232)、Beclin-1(3495)购于美国CST公司;兔抗人Asc(ab175449)、β-actin(ab179467)、LC3Ⅱ(ab48394)、LC3Ⅰ(ab52628)购于英国Abcam公司;兔抗人p-IκB(MAB7226)、IκB(AF5078)购于美国R&D公司。800TS酶标仪购于美国Biotek公司;BX51荧光显微镜购自日本奥林巴斯公司;F20 透射电镜购于美国 FEI 公司;PROTEAN Tetra 垂直电泳仪购于美国伯乐公司;Gelstudio touch 凝胶成像仪购于德国AnalytikJena AG公司。
1.3 细胞分组 取对数期细胞分为阴性对照组(Control组)、LPS 处理组(LPS 组)、野菊花总黄酮预处理组(TFC 组)、NLRP3 激活剂预处理组(4-MET 组)、TFC 联合4-MET 预处理组(TFC+4-MET组),每组均设定6个重复。Control组细胞不进行任何处理;LPS组:正常培养基基础上添加100µmol/L LPS[6];TFC 组:正常培养基基础上添加 50 mg/L TFC[7],预处理2 h后加入100µmol/L LPS进行诱导;4-MET组:正常培养基基础上添加10µmol/L 4-MET[8],预处理2 h后加入100µmol/L LPS 进行诱导;TFC+4-MET 组正常培养基基础上添加TFC(50 mg/L)与4-MET(10µmol/L)预处理2 h后加入LPS诱导。
1.4 检测指标与方法
1.4.1 CCK-8 法检测细胞增殖率 以上各组细胞继续培养24 h后收集细胞,密度调节为1.0×106个/孔接种至96孔板,每组设定6个重复孔,各组细胞分别继续培养24、48、72、96 h后添加10%(体积分数)的CCK-8检测试剂,在细胞培养箱内继续孵育4 h,采用酶标仪检测450 nm处吸光度值,细胞增殖率=实验组吸光度值/Control组吸光度值×100%,实验重复3次。
1.4.2 Hoechst 33342 染色观察细胞形态变化 取以上各组对数期细胞,制备单细胞悬液,细胞数量调整为1.0×106个/mL,添加4%甲醛固定10 min,在培养液中添加2µL Hoechst 33342 细胞染液,在细胞培养箱内孵育1 h 后,吸除含染料的培养液,用培养液或PBS洗涤3次,置于荧光显微镜下观察细胞形态变化情况。
1.4.3 免疫印迹法检测各组细胞NLRP3/NF-κB 信号通路、自噬蛋白表达 以上各组细胞培养48 h后,除去上层培养液后添加含PMSF 的RIPA 细胞裂解液,冰上放置1 h 后,采用BCA 法检测蛋白总含量,添加上样缓冲液煮沸后,统一定量20µg 行SDS-PAGE,半干法转膜反应后添加BSA 封闭液封闭,依据抗体说明书,稀释 NLRP3、Asc、caspase-1、p-IκB、IκB、LC3Ⅱ、LC3Ⅰ、Beclin-1一抗,工作浓度为1∶500,在4 ℃下用一抗对膜孵育过夜,经PBST 缓冲液清洗后添加含HRP标记的二抗室温下孵育1~2 h,经PBST 缓冲液清洗后,用ECL 化学发光液进行曝光显影后,在凝胶成像仪内采集图像,利用Image-J软件定量分析各蛋白相对表达量。
1.4.4 酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)检测细胞IL-1β、IL-18 含量 以上各组细胞培养48 h 后,收集上清,采用 ELISA 法检测上清中 IL-1β、IL-18 含量,具体参考试剂盒说明书进行操作。
1.4.5 透射电镜观察细胞超微结构 收集各组细胞,用胰蛋白酶消化后采用PBS 清洗细胞3 次,添加2%戊二醛预固定48 h,用1%锇酸再固定,采用梯度乙醇脱水、环氧树脂包埋,制备100 nm超薄切片,经醋酸铀-柠檬酸铅双染后,置于透射电镜下观察细胞自噬情况。
1.5 统计学方法 采用统计学软件SPSS 21.0 进行数据分析。计量资料采用表示,2 组间均数比较采用独立样本t检验,多组间比较采用析因设计的方差分析,进一步两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 野菊花总黄酮对LPS诱导HK-2细胞增殖率的影响 与Control组相比,培养24~96 h内LPS组细胞增殖率显著降低(P<0.05)。与LPS 组相比,TFC 组细胞增殖率显著升高,4-MET 组细胞增殖率显著降低(P<0.05)。TFC+4-MET 组细胞增殖率显著高于4-MET组(P<0.05),见表1。
2.2 各组细胞Hoechst 33342 染色情况 Control 组细胞形态无明显变化;LPS 组部分细胞染色质凝聚和核碎裂,呈现凋亡状,荧光染色增强,细胞凋亡率升高;与LPS 组相比,TFC 组细胞和破碎程度降低,荧光强度降低,细胞凋亡率降低;4-MET 组荧光强度增强,凋亡状细胞增多,细胞凋亡率升高;TFC+4-MET 组细胞核破碎程度低于4-MET组,荧光强度降低,细胞凋亡率降低。见图1、表2。
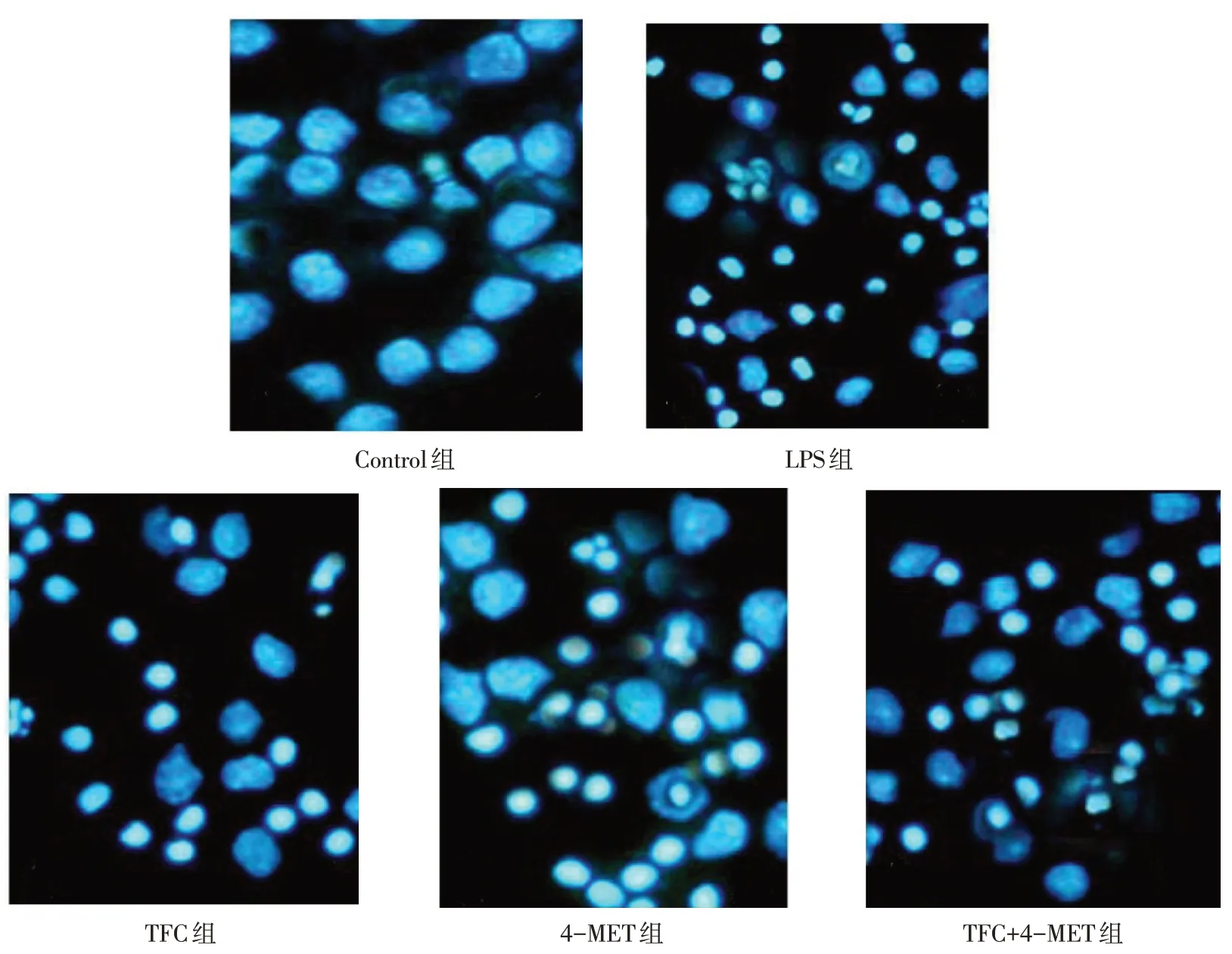
Fig.1 Hoechst staining showing morphological changes of cells(×100)图1 Hoechst染色观察细胞形态变化(×100)
2.3 野菊花总黄酮对LPS诱导HK-2细胞NLRP3信号通路蛋白的影响 与Control 组相比,LPS 组细胞NLRP3、Asc、caspase-1 蛋白表达显著升高(P<0.05)。与 LPS 组相比,TFC 组细胞 NLRP3、Asc、caspase-1 蛋白表达显著降低,4-MET 组细胞NLRP3、Asc、caspase-1 蛋白表达显著升高(P<0.05)。TFC+4-MET 组 NLRP3、Asc、caspase-1 蛋白表达显著低于4-MET 组(P<0.05)。见图2、表2。
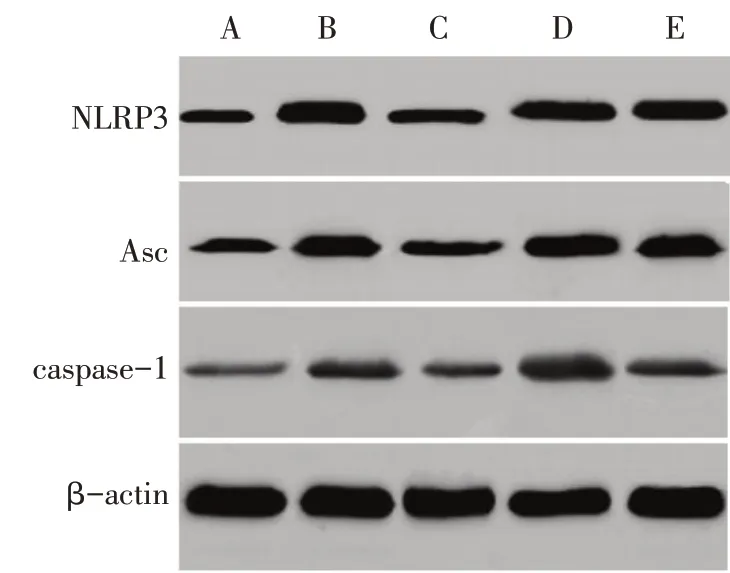
Fig.2 Immunoblotting results of expressions of NLRP3,Asc and caspase-1 in cells图2 免疫印迹法检测细胞NLRP3、Asc、caspase-1蛋白表达
2.4 野菊花总黄酮对LPS诱导HK-2细胞NF-κB信号通路蛋白的影响 与Control 组相比,LPS 组细胞IκB蛋白磷酸化水平显著升高(P<0.05)。与LPS组相比,TFC组细胞IκB蛋白磷酸化水平显著降低,4-MET 组细胞 IκB 蛋白磷酸化水平显著升高(P<0.05)。TFC+4-MET 组 IκB 蛋白磷酸化水平显著低于4-MET组(P<0.05),见图3、表4。
2.5 野菊花总黄酮对LPS诱导HK-2细胞炎性因子表达的影响 与Control 组相比,LPS 组细胞IL-1β、IL-18水平显著升高(P<0.05)。与LPS组相比,TFC组细胞IL-1β、IL-18 水平显著降低,4-MET 组细胞IL-1β、IL-18 水平显著升高(P<0.05)。TFC+4-MET 组IL-1β、IL-18 水平显著低于4-MET 组(P<0.05),见表5。
Tab.1 Comparison of cell proliferation rates between five groups表1 各组细胞增殖率比较 (n=6,%,)

Tab.1 Comparison of cell proliferation rates between five groups表1 各组细胞增殖率比较 (n=6,%,)
*P<0.05;t 值为Control 组与LPS 组比较结果;FTFC=74.139,F4-MET=177.902*,F时间=51.271*,FTFC+4-MET=7.809*,FTFC+时间=2.842,F4-MET+时间=6.721,FTFC+4-MET+时间=18.046*;a与Control组比较,b与LPS组比较,c与4-MET组比较,P<0.05
组别Control组LPS组TFC组4-MET组TFC+4-MET组t 24 h 100.01±0.32 82.63±4.55a 88.07±4.47abc 72.62±2.75ab 80.62±4.65ac 9.333*48 h 100.12±0.15 74.64±3.78ac 81.24±4.05abc 66.41±3.41ab 73.15±3.53ac 16.498*72 h 100.22±0.14 66.52±4.54ac 74.07±4.23abc 63.68±2.57ab 64.76±4.69ac 18.174*96 h 100.29±0.11 51.32±4.36ac 67.16±4.75abc 59.71±3.16ab 47.92±4.23ac 27.503*
Tab.2 Comparison of expressions of NLRP3,Asc and caspase-1 and the apoptosis rates between five groups表2 各组细胞细胞凋亡率及NLRP3、Asc、caspase-1蛋白表达比较 (n=6,)
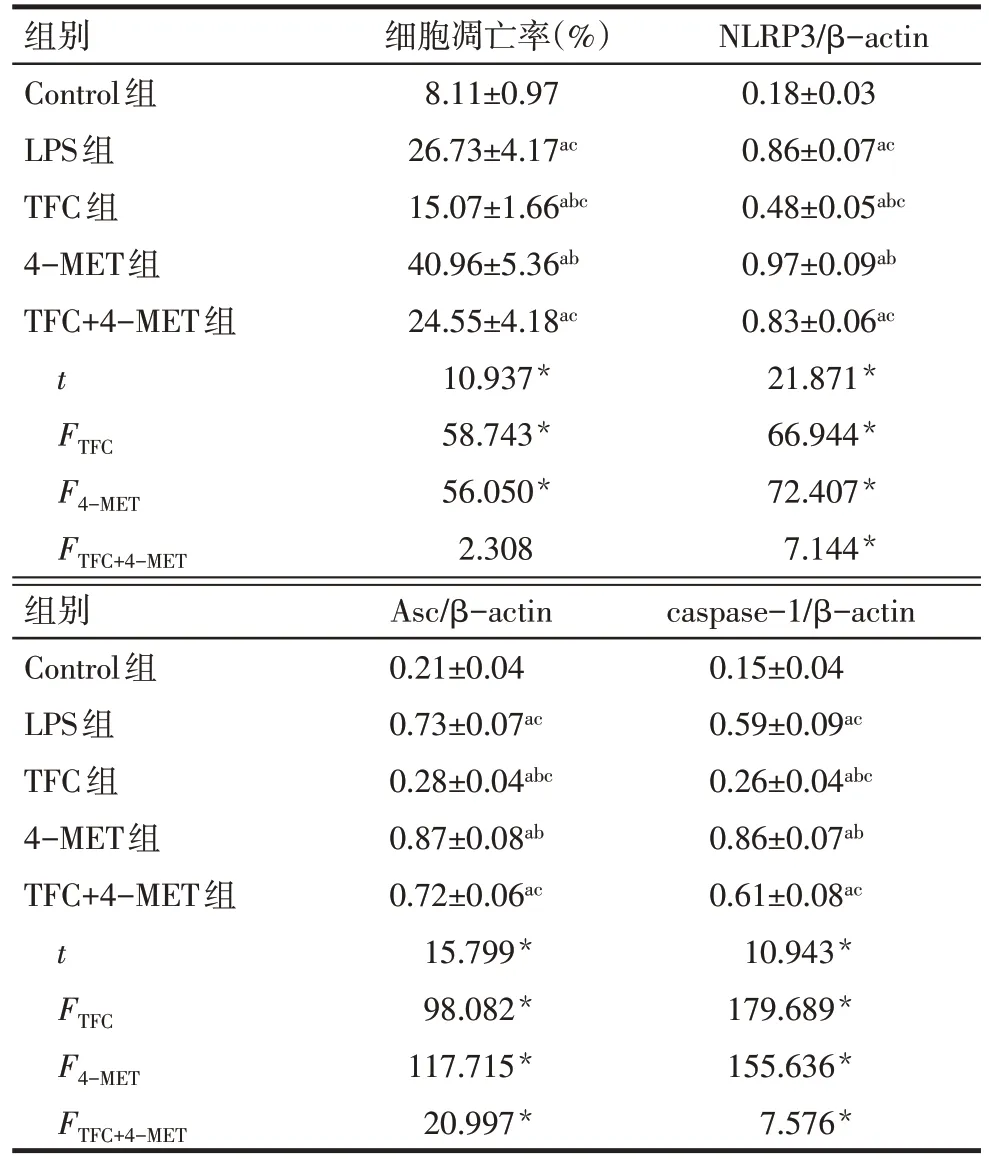
Tab.2 Comparison of expressions of NLRP3,Asc and caspase-1 and the apoptosis rates between five groups表2 各组细胞细胞凋亡率及NLRP3、Asc、caspase-1蛋白表达比较 (n=6,)
*P<0.05;t 值为 Control 组与 LPS 组比较结果;a 与 Control 组比较,b与LPS组比较,c与4-MET组比较,P<0.05
组别Control组LPS组TFC组4-MET组TFC+4-MET组t FTFC F4-MET FTFC+4-MET细胞凋亡率(%)8.11±0.97 26.73±4.17ac 15.07±1.66abc 40.96±5.36ab 24.55±4.18ac 10.937*58.743*56.050*2.308 NLRP3/β-actin 0.18±0.03 0.86±0.07ac 0.48±0.05abc 0.97±0.09ab 0.83±0.06ac 21.871*66.944*72.407*7.144*组别Control组LPS组TFC组4-MET组TFC+4-MET组t FTFC F4-MET FTFC+4-MET Asc/β-actin 0.21±0.04 0.73±0.07ac 0.28±0.04abc 0.87±0.08ab 0.72±0.06ac 15.799*98.082*117.715*20.997*caspase-1/β-actin 0.15±0.04 0.59±0.09ac 0.26±0.04abc 0.86±0.07ab 0.61±0.08ac 10.943*179.689*155.636*7.576*
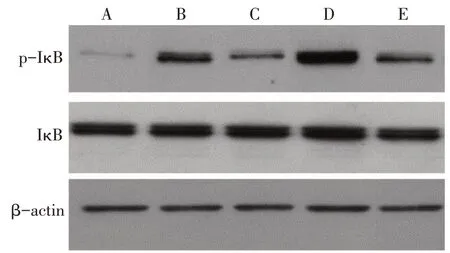
Fig.3 Immunoblotting results of the expressions of p-IκB and IκB in cells图3 免疫印迹法检测细胞p-IκB、IκB蛋白表达
2.6 电镜观察各组HK-2细胞自噬情况 电镜结果显示,Control 组细胞结构、形态基本正常,未发生明显自噬;LPS 组出现少量自噬小体;与LPS 组相比,TFC 自噬小体数量增多;4-MET 组自噬程度降低;TFC+4-MET组自噬小体、自噬溶酶体数多于4-MET组,见图4。
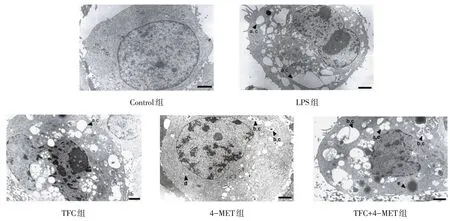
Fig.4 Electron microscopic observation of autophagy of HK-2 cells(×5 000)图4 电镜观察HK-2细胞自噬情况(×5 000)
Tab.4 Comparison of expressions of p-IκB and IκB between five groups表4 各组细胞p-IκB、IκB蛋白表达比较 (n=6,)
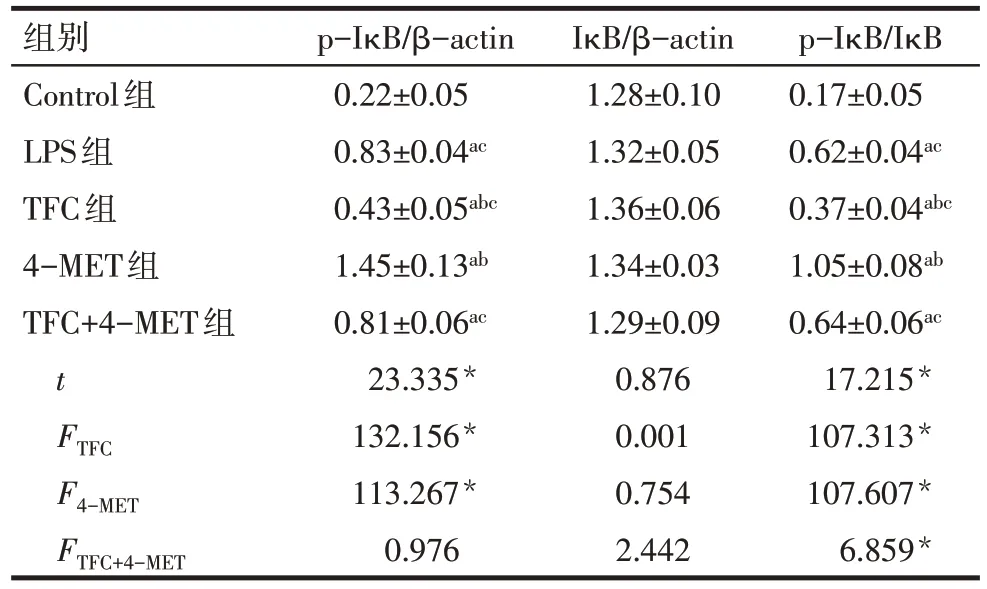
Tab.4 Comparison of expressions of p-IκB and IκB between five groups表4 各组细胞p-IκB、IκB蛋白表达比较 (n=6,)
*P<0.05;a与Control 组比较,b与LPS 组比较,c与 4-MET 组比较,P<0.05
组别Control组LPS组TFC组4-MET组TFC+4-MET组t FTFC F4-MET FTFC+4-MET p-IκB/β-actin 0.22±0.05 0.83±0.04ac 0.43±0.05abc 1.45±0.13ab 0.81±0.06ac 23.335*132.156*113.267*0.976 IκB/β-actin 1.28±0.10 1.32±0.05 1.36±0.06 1.34±0.03 1.29±0.09 0.876 0.001 0.754 2.442 p-IκB/IκB 0.17±0.05 0.62±0.04ac 0.37±0.04abc 1.05±0.08ab 0.64±0.06ac 17.215*107.313*107.607*6.859*
Tab.5 Comparison of IL-1β and IL-18 levels between five groups表5 各组细胞IL-1β、IL-18水平比较 (n=6,)
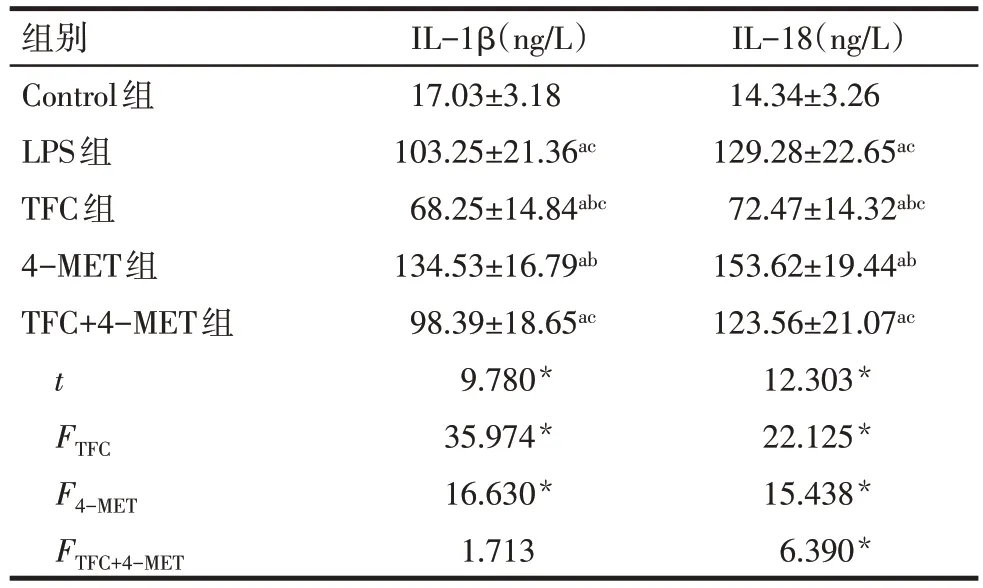
Tab.5 Comparison of IL-1β and IL-18 levels between five groups表5 各组细胞IL-1β、IL-18水平比较 (n=6,)
*P<0.05;t值为Control组与LPS组比较结果;a与Control组比较,b与LPS组比较,c与4-MET组比较,P<0.05
组别Control组LPS组TFC组4-MET组TFC+4-MET组t FTFC F4-MET FTFC+4-MET IL-1β(ng/L)17.03±3.18 103.25±21.36ac 68.25±14.84abc 134.53±16.79ab 98.39±18.65ac 9.780*35.974*16.630*1.713 IL-18(ng/L)14.34±3.26 129.28±22.65ac 72.47±14.32abc 153.62±19.44ab 123.56±21.07ac 12.303*22.125*15.438*6.390*
2.7 野菊花总黄酮对LPS诱导HK-2细胞自噬蛋白表达的影响 与Control 组相比,LPS 组细胞LC3Ⅱ/Ⅰ、Beclin-1 蛋白表达降低(P<0.05)。与LPS 组相比,TFC 组细胞 LC3Ⅱ/Ⅰ、Beclin-1 蛋白表达升高,4-MET 组细胞 LC3Ⅱ/Ⅰ、Beclin-1 蛋白表达降低(P<0.05)。TFC+4-MET 组LC3Ⅱ/Ⅰ水平、Beclin-1蛋白表达高于4-MET 组(P<0.05)。见图5、表6。
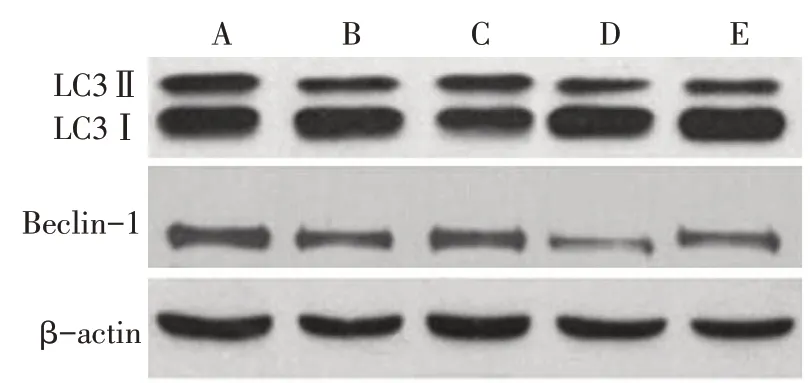
Fig.5 Immunoblotting detection of the expressions of LC3Ⅱ,LC3Ⅰand Beclin-1 protein in cells图5 免疫印迹法检测细胞LC3Ⅱ、LC3Ⅰ、Beclin-1蛋白表达
Tab.6 Comparison of expressions of LC3Ⅱ,LC3Ⅰ and Beclin-1 between five groups表6 各组细胞LC3Ⅱ、LC3Ⅰ、Beclin-1蛋白表达比较 (n=6,)
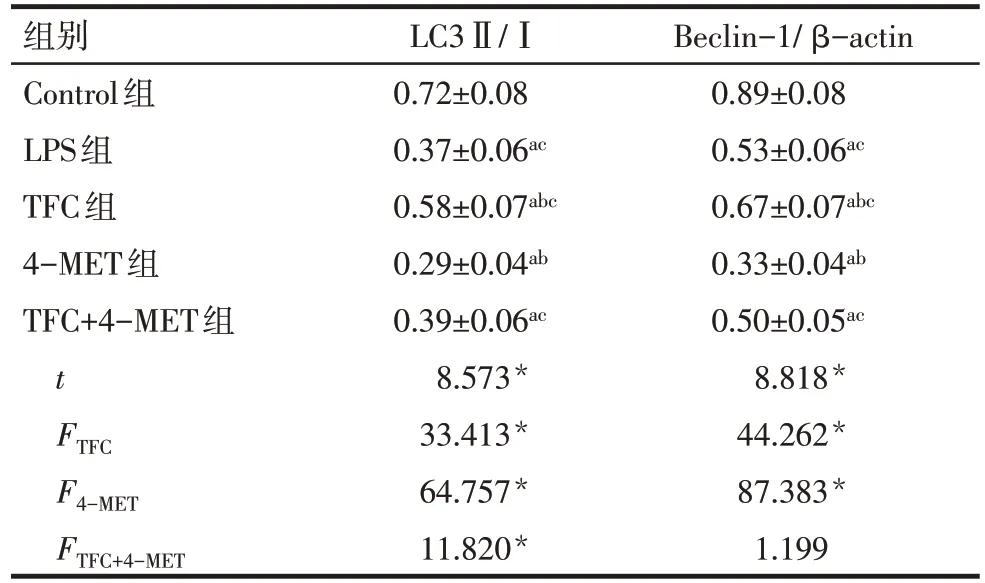
Tab.6 Comparison of expressions of LC3Ⅱ,LC3Ⅰ and Beclin-1 between five groups表6 各组细胞LC3Ⅱ、LC3Ⅰ、Beclin-1蛋白表达比较 (n=6,)
*P<0.05;t 值为 Control 组与 LPS 组比较结果;a 与 Control 组比较,b与LPS组比较,c与4-MET组比较,P<0.05
Beclin-1/β-actin 0.89±0.08 0.53±0.06ac 0.67±0.07abc 0.33±0.04ab 0.50±0.05ac 8.818*44.262*87.383*1.199组别Control组LPS组TFC组4-MET组TFC+4-MET组t FTFC F4-MET FTFC+4-MET LC3Ⅱ/Ⅰ0.72±0.08 0.37±0.06ac 0.58±0.07abc 0.29±0.04ab 0.39±0.06ac 8.573*33.413*64.757*11.820*
3 讨论
高浓度的尿酸是造成痛风关节炎发作的重要物质,患者一般伴有关节红肿、剧烈疼痛,且持续反复发作,严重影响患者生活质量,因此深入探究痛风的发生机制,对于寻找疾病的治疗靶点具有十分重要意义。机体内尿酸大多经肾脏排泄,临床发现多数痛风患者均伴有肾损伤,其主要发病机制与肾小管细胞尿酸盐排泄异常有关[9]。人肾小管上皮细胞HK-2是研究炎症反应模型常用的细胞,LPS又称内毒素,对细胞均有一定的毒性,在细胞炎症反应造模中应用较多[10]。本研究通过采用 LPS 刺激HK-2 细胞诱导建立炎症反应模型,结果发现与Control 组相比,LPS诱导后细胞增殖率明显降低,且细胞培养上清液中炎症因子IL-1β、IL-18水平显著升高,表明一定浓度LPS可抑制肾小管细胞生长,上调炎症因子释放,提示LPS诱导HK-2细胞炎症反应模型建立成功。
黄酮是野菊花中重要的活性成分之一,在野菊花中含量较高,可改善心脏、肾脏等重要器官供血情况,且不良反应较小。黄酮类化合物在降尿酸方面具有较好的效果,缪明星等[11]研究发现芹菜素中的黄酮类化合物能够明显降低高尿酸血症小鼠的尿酸水平,发挥对肾脏的保护作用。濮尊琴等[12]研究显示高良姜素中的黄酮类化合物能够明显降低高尿酸小鼠血尿酸水平,此外还可降低肝脏中XOD 活性。然而野菊花总黄酮在痛风中的作用目前尚不明确。本研究首先采用野菊花总黄酮预处理HK-2 细胞,随后进行LPS诱导,结果发现与LPS组相比,野菊花总黄酮预处理后细胞增殖率升高,且细胞培养液中炎性因子IL-1β、IL-18 水平降低,提示野菊花总黄酮可抑制LPS诱导细胞产生的炎症反应。
NLRP3 属于胞浆蛋白家族成员之一,与TLR4具有类似的作用,广泛参与宿主免疫及炎症反应过程。NLRP3 与LRR 结合后发生活化,使其构象改变,暴露NACHT 结构域,经ATP 聚合后生成NLRP3炎性复合体,与PYD 效应结构域结合后招募Asc、caspase-1 前体形成炎性复合体,进一步激活caspase-1 前体形成caspase-1,分泌至胞外促进IL-1β 和IL-18 的成熟及释放,进一步扩大炎症反应。已有研究证实NLRP3可经LRR识别尿酸盐,促使无活性的NLRP3 活化,进一步诱导炎性因子IL-1β 和IL-18 的分泌[13]。Dinesh 等[14]研究发现抑制 NLRP3信号通路可明显降低尿酸盐晶体诱导的大鼠炎症反应。Lee等[15]研究发现抑制NLRP3炎症激活和线粒体DNA 合成可预防急性痛风的发生。本研究发现与Control组相比,LPS处理组NLRP3、Asc、caspase-1蛋白表达进一步升高,经野菊花总黄酮干预后NLRP3、Asc、caspase-1 蛋白表达降低,提示野菊花总黄酮可能通过抑制NLRP3信号通路进而抑制LPS诱导HK-2细胞的炎性反应。NLRP3除参与炎症反应调节外还参与NF-κB 通路调节,caspase-1 及IL-1β 均可激活 NF-κB,而 NF-κB 激活后又可促进NLRP3 炎性体通路的激活,放大炎症反应。Molagoda等[16]和Sun等[17]研究发现抑制细胞NF-κB信号通路表达后,可抑制IL-1β因子释放,进而降低NLRP3/Asc/caspase-1 信号通路的活化。本研究发现与 Control 组相比,LPS 处理组细胞 IκB 蛋白磷酸化水平升高,经野菊花总黄酮预干预后IκB 蛋白磷酸化水平降低,提示野菊花总黄酮可能是通过抑制NLRP3 信号通路活化,进而抑制NF-κB 信号通路,降低细胞炎性反应。为证实这一推测,本研究采用NLRP3 激活剂 4-MET 处理 HK-2 细胞,结果发现LPS 诱导后细胞增殖进一步受到抑制,细胞炎性水平升高,且NLRP3、Asc、caspase-1、IκB 蛋白磷酸化水平升高,提示激活NLRP3后可进一步激活NF-κB信号通路,加重细胞炎性反应。而采用野菊花总黄酮联合NLRP3 激活剂处理后,可提高细胞增殖活性,降低炎性水平,降低NLRP3/NF-κB 通路蛋白表达,提示野菊花总黄酮可通过抑制NLRP3/NF-κB通路活化,降低LPS诱导HK-2细胞炎性反应。
自噬在真核细胞中普遍存在,炎症疾病的发生与细胞自噬活性缺陷密切有关。近期研究发现尿酸盐刺激炎性体活化过程中伴随着自噬的发生,且自噬可通过负调节炎性小体进而抑制炎性因子IL-1β释放,推测自噬在痛风发生过程中发挥重要作用[18]。研究证实NF-κB作用于NLRP3启动子促进其转录,进而调控自噬蛋白,而干扰NLRP3表达后能够降低自噬活性[19]。另有研究发现自噬可通过降解炎性体进而负调控炎性体活性,降低炎性因子IL-1β、IL-18 水平[20]。本研究经透射电镜检测发现,LPS 诱导后细胞中出现一定的自噬小体,而经野菊花总黄酮处理后细胞自噬活性增强;NLRP3激活剂4-MET处理后细胞自噬活性降低,4-MET 联合野菊花总黄酮处理后自噬活性进一步增强,表明野菊花总黄酮可通过抑制NLRP3/NF-κB 通路活化诱导HK-2 细胞自噬。LC3 蛋白是自噬活性检测的重要标志物,定位自噬体膜上,LC3 经Agt4 催化后形成LC3-Ⅰ,与PE 偶联转变为LC3-Ⅱ,稳定存于内膜上,因此LC3Ⅱ/Ⅰ水平可反映细胞自噬程度。Beclin-1是哺乳动物参与自噬的特异基因之一,当细胞发生自噬后,其水平迅速升高,可反映细胞自噬程度[21]。本研究发现野菊花总黄酮干预后细胞中LC3 Ⅱ/LC3 Ⅰ、Beclin-1 蛋白表达明显升高,经4-MET 干预后两者蛋白表达进一步降低,野菊花总黄酮联合4-MET处理后LC3Ⅱ/Ⅰ、Beclin-1蛋白表达高于4-MET组,提示野菊花总黄酮可通过抑制NLRP3/NF-κB 通路降低LPS诱导HK-2炎性细胞中自噬蛋白表达水平。
综上所述,野菊花总黄酮能够抑制LPS 诱导的HK-2细胞炎性反应,诱导细胞自噬,其机制可能与抑制NLRP3-IL-1β-NF-κB通路有关。然而本研究也存在一定的不足,仅在体外证实野菊花总黄酮对肾小管上皮细胞的炎症抑制作用,未在体内进行验证,这还有待后续完善实验方案进一步深入探究。

