股骨近端防旋髓内钉不同进钉点治疗外侧壁破裂型股骨转子间骨折的有限元分析
蔡群斌,姜自伟△,林梓凌,陈心敏,董航,黄培镇
股骨转子间骨折是老年人常见的骨折类型[1]。目前股骨转子间骨折特别是不稳定型股骨转子间骨折的治疗方案主要是手术治疗,保守治疗效果不佳[2-3]。股骨转子间骨折手术方式主要有髓外的侧方钢板系统和髓内钉系统,研究表明,髓内固定比髓外固定稳定性更强[4]。因此,股骨近端防旋髓内钉(proximal femoral nail anti-rotation,PFNA)是治疗股骨转子间骨折的有效术式[5-6],但PFNA术后退钉、切割、断钉等并发症仍时有发生[7-8],而外侧壁的完整与否被认为是影响PFNA 术后疗效的重要原因之一[9-10]。对于PFNA 治疗外侧壁破裂型股骨转子间骨折,螺旋刀片不理想的进钉点是否是造成术后并发症的原因之一?不同进钉点的生物力学又是怎样?国内外对此研究甚少。本研究基于有限元法,模拟PFNA不同进钉点治疗外侧壁破裂型股骨转子间骨折,探讨不同进钉点的生物力学效果,为临床PFNA 治疗外侧壁破裂型股骨转子间骨折提供实验基础。
1 资料与方法
1.1 一般资料
1.1.1 病例资料 选取1 位健康志愿者,25 岁,男,身高175 cm,体质量70 kg,无手术史,无代谢性骨病和先天骨骼变异,无肿瘤史,近年未服用影响骨代谢药物,经广州中医药大学第一附属医院伦理委员会批准(医院伦理批件号:NO.Y[2019]164,审批时间:2019-03-14)并与患者签署知情同意书后,志愿者取仰卧位,采用GE 64排螺旋CT 对髋部螺旋扫描并以Dicom 格式保存扫描的CT数据。参照郑利钦等[11]方法设置扫描条件:扫描电压120 kV,扫描电流250 mA,层厚2 mm,层距5 mm,每个扫描层的像素矩阵密度大小为512×512。
1.1.2 试验软件 Mimics 19.0 软件(Materialise 公司,比利时),由广州中医药大学国家重点学科中医骨伤科学数字骨科与生物力学实验室提供;Geomagic studio 2017 软件(Geomagic 公司,美国)、Hypermesh 2017 软件(Altair 公司,美国),由广州有道计算机有限公司提供;有限元运算软件Abaqus6.13软件(LSTC 公司,美国),由广州中医药大学国家重点学科中医骨伤科学数字骨科与生物力学实验室提供。
1.2 方法
1.2.1 重建股骨三维模型 将保存为Dicom 格式的CT 影像资料导入Mimics 19.0软件中,进行阈值选择、区域增长、腔隙填充、三维重建等处理,建立右侧股骨三维模型,导出为stl格式文件。
1.2.2 网格划分和初步处理 将stl 格式的右侧股骨三维模型导入Geomagic studio 2017 软件中,进行去除特征、划分网格、优化平滑、拟合曲面等步骤后得到优化后右侧股骨三维模型,并导出生成STEP文件,见图1。
1.2.3 模型装配与截骨 运用Solidworks 2017 软件对优化后的右侧股骨三维模型行进一步处理,确定坐标系,并参照顾海伦等[12]关于外侧壁的分型(Ⅰ型为单纯外侧壁粉碎,粉碎骨折处累及螺旋刀片固定处,复位后内侧支撑基本存在;Ⅱ型为外侧壁劈裂,复位后螺旋刀片固定位置骨质条件尚可,能基本稳定螺旋刀片,内侧缺乏支撑;Ⅲ型为外侧壁及股骨转子下粉碎骨折,复位骨折片后,外侧壁螺旋刀片固定处和内侧股骨距均粉碎),对右侧股骨三维模型进行截骨模拟骨折线;画出内固定草图,通过拉伸、旋转、切割、放样等步骤得到PFNA内固定模型,PFNA内固定模型参数为主钉长170 mm,螺旋刀片直径10 mm,长度105 mm,其他具体数据参照大博股骨近端防旋髓内钉;对内固定和右侧股骨三维模型进行装配,分别从外侧壁上、中、下三个不同位置置入螺旋刀片,得到基于顾海伦外侧壁Ⅰ型的A1、A2、A3三个模型,见图2;基于外侧壁Ⅲ型得到B1、B2、B3三个模型,见图3。
Fig.1 Models after initial processing图1 初步处理模型

Fig.2 Models of crushed lateral femoral wall and completed medial femoral wall图2 A模型为股骨外侧壁粉碎,内侧支撑存在

Fig.3 Models of crushed lateral femoral wall and medial femoral wall图3 B模型为股骨外侧壁粉碎,内侧支撑缺乏
1.2.4 材料属性、边界条件与分析 分别将各个模型导入Abaqus 6.13软件中,材料属性与边界条件参照任德新等[13]研究,假设各材料均为均质、各向同性,赋予皮质骨、松质骨、内固定材料属性,见表1;对部件进行装配组合,设置相互作用,骨折端设置为摩擦系数为0.3的有限滑移,PFNA模型设置螺旋刀片与主钉、远端钉与主钉、螺旋刀片与股骨均为绑定,边界条件为约束股骨远端,模拟单足站立,患者体质量为70 kg,股骨头上方垂直加载压力700 N,划分网格后行提交运算得出静力分析结果。
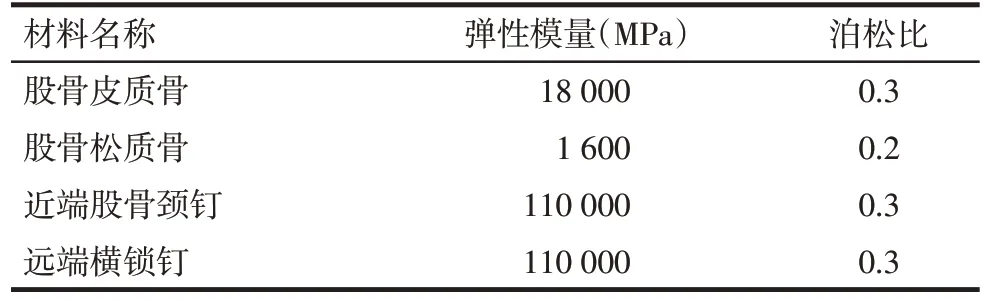
Tab.1 Material properties of models表1 模型材料属性
1.2.5 评价标准 在Abaqus 软件可视化模块分别对比A1、A2、A3 三个模型和B1、B2、B3 三个模型:①股骨近端整体应力;②骨折端应力;③股骨头顶部位移;④模型应变率。
1.2.6 模型有效性验证 导入正常右侧股骨三维模型,设置材料参数、属性、边界条件,给股骨头中心一个垂直向下大小为700 N的力,模拟正常股骨受力情况进行分析,得出右侧正常股骨的应力分布图,见图4。其所示应力分布和应力大小与张雪鹏等[14-15]生物力学研究获得的结果较吻合,证明本实验建立的有限元模型是可行的,该模型可用于下一步运算。
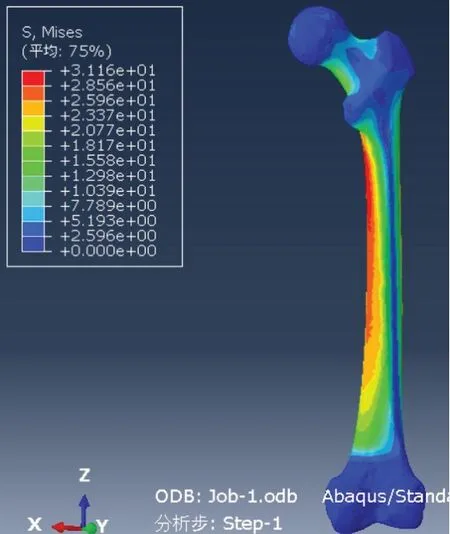
Fig.4 Validation of the right normal femoral model图4 右侧正常股骨模型有效性验证
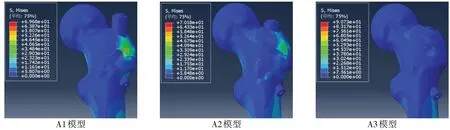
Fig.5 General stress cloud pictures of proximal femur in model A图5 A模型股骨近端整体应力云图
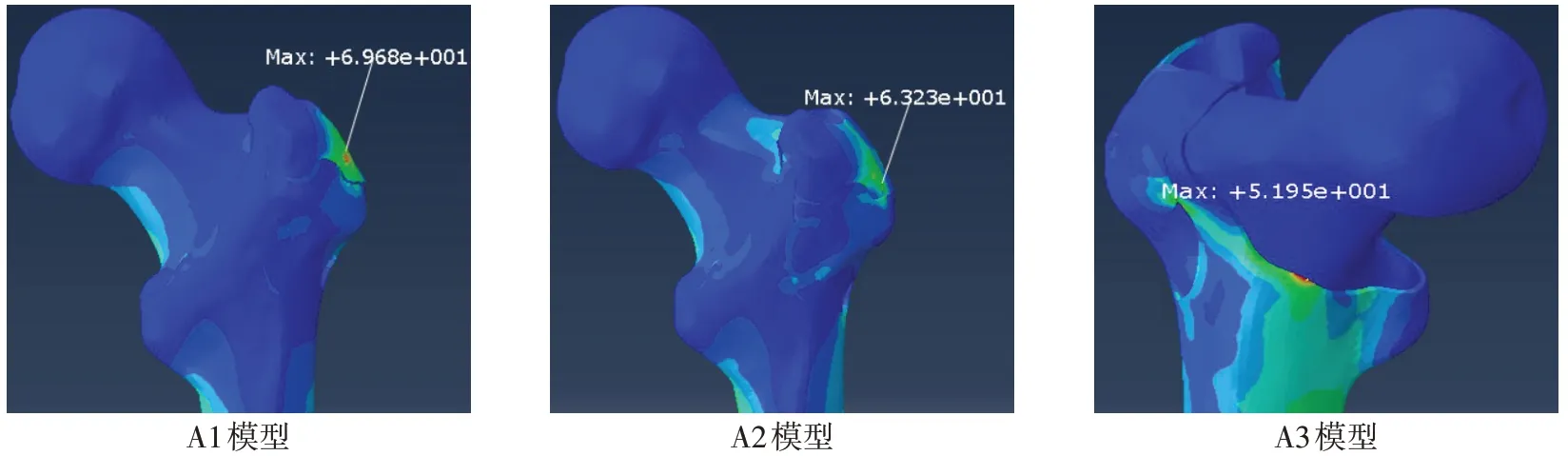
Fig.6 Stress cloud pictures of fracture site in model A图6 A模型骨折端应力云图

Fig.7 Displacement cloud pictures of femoral head in model A图7 A模型股骨头顶部位移云图

Fig.8 Strain rate cloud pictures of model A图8 A模型应变率云图

Fig.9 General stress cloud pictures of proximal femur in model B图9 B模型股骨近端整体应力云图

Fig.10 Stress cloud pictures of fracture site in model B图10 B模型骨折端应力云图

Fig.11 Displacement cloud pictures of femoral head in model B图11 B模型股骨头顶部位移云图

Fig.12 Strain rate cloud pictures of model B图12 B模型应变率云图
2 结果
2.1 A模型 股骨外侧壁粉碎,内侧支撑存在。
2.1.1 股骨近端整体应力 A1、A2、A3 模型股骨近端最大应力分别为69.7、70.2 及90.7 MPa,骨折线下方进钉整体应力最大,但应力分布均匀;骨折线上方进钉整体应力虽最小,但出现明显的应力集中;骨折线处进钉应力大小与应力分布均居中,见图5。
2.1.2 骨折端应力 A1、A2、A3 模型骨折端最大应力分别为69.7、63.2及51.6 MPa,A1模型骨折端应力最大,应力最大处位于大转子骨折线处;A2 模型骨折端应力居中,应力最大处亦位于大转子骨折线处;A3模型骨折端应力最小,应力最大处亦位于骨折端后内侧皮质,见图6。
2.1.3 股骨头顶部位移 A1、A2、A3 模型股骨头顶部最大位移分别为5.22、5.78 及5.24 mm,A2 模型股骨头顶部位移最大,A1 模型股骨头顶部位移最小,见图7。
2.1.4 模型应变率 A1、A2、A3 模型总应变率分别约为1.61%、1.79%及0.84%,A3 模型总体应变率明显小于A1、A2模型,见图8。
2.2 B模型 股骨外侧壁粉碎,内侧支撑缺乏。
2.2.1 股骨近端整体应力 B1、B2、B3 模型股骨近端最大应力分别为134.1、628.3 及137.0 MPa,骨折线处进钉应力最大,且出现应力集中;骨折线下方进钉应力大小居中,但应力分布最为均匀;骨折线上方进钉应力最小,应力分布较为均匀,见图9。
2.2.2 骨折端应力 B1、B2、B3 模型骨折端最大应力分别为70.4、628.3及137.0 MPa,B1模型骨折端应力最小,应力最大处位于外侧壁进钉处,应力分布分散;B2 模型骨折端应力最大,且应力集中于外侧壁进钉处;B3 模型骨折端应力居中,应力分布较为均匀,见图10。
2.2.3 股骨头顶部位移 B1、B2、B3 模型股骨头顶部最大位移分别为6.28、5.70 及5.72 mm,B1 模型股骨头顶部位移最大,B2 模型股骨头顶部位移最小,B3模型股骨头顶部位移较B2稍大,见图11。
2.2.4 模型应变率 B1、B2、B3 模型总应变率分别约为1.52%、2.11%及1.12%,B3 模型总体应变率明显小于B1、B2模型,见图12。
3 讨论
股骨转子间外侧壁的概念最早于2004 年由Goffried[16]提出,是向股骨头置入拉力螺钉等内固定物的区域。现越来越多的学者发现,股骨外侧壁破裂是股骨转子间骨折手术失败的重要影响因素,股骨外侧壁的完整性与股骨转子间骨折手术预后密切相关[17]。对于外侧壁破裂型股骨转子间骨折,已有研究表明PFNA较其他内固定方式具有更好的临床疗效[18-19],但仍有部分病例出现退钉、切割等并发症[7-8],考虑可能与复位状态、骨密度、内固定位置等密切有关[20-21],而内固定位置被认为是股骨转子间骨折术后内固定切割的主要原因之一[22]。PFNA 的螺旋刀片是术中直接打入股骨头颈骨折块,这提高了抗旋转和抗内翻能力,同时减少了松质骨丢失,并压缩螺旋刀片周围松质骨,增强了把持力,尤其对于骨质疏松患者临床疗效更佳,而对于螺旋刀片的位置,现主要是在股骨颈中部置入以获得较小的TAD值[23]。
王冬冬等[24]研究表明,在稳定型股骨转子间骨折中,头颈拉力螺钉置入股骨颈中下1/3处时,生物力学性能更好,结构相对更稳定,受力更合理,但对于内固定失败风险更高的不稳定型股骨转子间骨折螺旋刀片最佳位置是否和稳定型股骨转子间骨折一致?特别是外侧壁破裂,内侧支撑缺乏的不稳定型股骨转子间骨折,不同螺旋刀片位置生物力学有何不同均未明确。本研究结果显示:(1)在A 模型中,外侧壁下部进钉整体应力最大,但应力分布均匀,且骨折端所受应力较小,不容易造成骨折端骨块压缩,具有更合理的受力结构;股骨头颈骨块位移和应变率均较小,提示骨折端更为稳定,抗旋转能力更强,不容易切割,有利于骨折端的愈合。而外侧壁上方和中部进钉则有明显的应力集中,较大的股骨头颈骨块位移与应变率,生物力学效果较外侧壁下部进钉差。(2)在B 模型中,外侧壁下部进钉整体应力稍大,但分布均匀,且具有较小的股骨头颈骨块位移与应变率,具有最佳的生物力学效果。而外侧壁上方和中部进钉陡然增大的应力和较大的股骨头颈骨块位移与应变率不利于骨折端愈合。
上述结果表明,PFNA治疗外侧壁破裂型股骨转子间骨折在外侧壁下方进钉具有最佳的生物力学效果,这与稳定型股骨转子间骨折相似,其原因可能是:(1)完整的外侧壁在对抗内固定内翻和旋转具有重要作用,是杠杆力臂的“配重”[25];股骨外侧壁可支撑近端的股骨头颈骨折块,并对抗其旋转和内翻倾向,是螺旋刀片三点受力的外侧作用点[26];而官煜超等[27]认为股骨矩与小转子共同组成股骨转子间后内侧壁,是股骨转子间内侧骨皮质最主要传导压力部分,其是否完整直接关系到股骨转子间骨折是否稳定。(2)在A模型中,此模型外侧壁粉碎,但复位后内侧支撑基本存在,当股骨头受力下压时,较为完整的股骨内侧结构可以对股骨头颈骨折块提供有效支撑,防止股骨头颈骨块内翻,虽然破裂的外侧壁并不能充分有效地作为螺旋刀片3 点受力的外侧作用点,但对比外侧壁破裂,内侧支撑缺乏的B 模型,A模型整体的位移和应变率明显更小;螺旋刀片远端对其上方的外侧壁破裂骨块产生向后向上的作用力,但PFNA主钉本身具有一部分外侧壁功能,可在一定程度上防止大转子和外侧壁骨块翻转,而螺旋刀片置入位置越往上,主钉作为外侧壁的作用范围就越小,更无法为股骨头颈块提供有效地抗旋转能力,螺旋刀片置入位置越往下,主钉作为外侧壁的作用范围就越大,且靠近股骨矩可增强内侧支撑作用,所以在A 模型中,外侧壁下方进钉具有最佳的生物力学效果。(3)在外侧壁破裂,内侧支撑缺乏的B 模型中,破裂的外侧壁和内侧结构均无法为股骨头颈骨折块提供有效稳定的支撑,抗旋转能力弱,当股骨头受力下压时,股骨头颈骨折块向远端滑移,并发生旋转,进而内翻,最后可能导致PFNA螺旋刀片的切割,所以在B 模型中,外侧壁下方进钉,靠近股骨矩和小转子,可部分代替内侧结构,提供一定的稳定支撑,具有最小的应变率,模型最为稳定,有利于骨折愈合。(4)无论稳定型股骨转子间骨折还是不稳定型股骨转子间骨折,螺旋刀片位于下方均具有最佳的生物力学效果。在稳定型股骨转子间骨折中,外侧壁和内侧结构完整能提供有效支撑和抗旋转能力,而靠近下方置钉能增强内侧支撑作用,具有更好的生物力学效果;在不稳定型股骨转子间骨折中,外侧壁和内侧结构均破裂,无法提供有效支撑和抗旋转能力,螺旋刀片置于下方代替部分内侧支撑作用,一定程度上防止股骨头颈骨折块旋转、内翻,同样具有最佳的生物力学效果。
综上所述,PFNA在治疗外侧壁破裂型股骨转子间骨折时,螺旋刀片在外侧壁下方进钉应力分布均匀,骨折端稳定,具有最佳的生物力学效果。但外侧壁破裂型股骨转子间骨折PFNA内固定手术的成功和骨折的愈合不仅关乎生物力学,还与骨密度、软组织条件等密切相关,且螺旋刀片于外侧壁下方进钉治疗外侧壁破裂型股骨转子间骨折的临床疗效还需更多的临床病例来支撑和验证。

