虫草素抑制PI3K通路的活化诱导口腔鳞状细胞癌SCC9细胞自噬性死亡
朱兰省,王艳玲,刘爱群,许小婷
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是最常见的恶性肿瘤之一,其发病总量约占到口腔癌的90%[1]。在全世界范围内,OSCC发病率为2%~4%,在南亚发病率则上升至10%~40%;这一现象的主要原因可能与南亚地区人民大量食用槟榔果有极大关系[2]。虽然患者大多属于50岁以上人群,但是患病人群越来越趋向于年轻化[3]。虫草素(cordycepin,CP)是一种3′-脱氧腺苷(3′-deoxyadenosine),由Cunningham et al[4]首次在蛹虫草(Cordysepsmilitaris)中培育分离得到。近些年来,经过大量国内外科学家证实,CP作为一种核苷酸,具有诸多生物学功能,如抑菌抗病毒、调节免疫功能、对抗炎症反应以及抗肿瘤作用等[5]。Wong et al[6]研究证实CP可以通过缩短mRNA的polyA进而抑制肿瘤细胞黏附能力。磷脂肌醇3-激酶(phosphoinositide-3 kinase,PI3K)-蛋白激酶B(protein kinase B,PKB,亦称Akt)-雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路是生物体细胞内一经典信号通路,自发现以来在肿瘤发生发展中的作用即被广泛研究,已经在多数肿瘤里呈不同程度高表达或异常活化[7-8]。有研究[9]显示,Muc-1可以通过PI3K-Akt途径来促进OSCC转移和侵袭。截止目前,OSCC发病机制也不甚清楚,因此如何明确OSCC发生发展机制,寻找其中潜在的分子标志物,对进一步提高OSCC患者的治疗和预后效果具有重要研究意义。现根据前期研究成果,探讨CP在OSCC细胞中所发挥的功能机制,期望为OSCC治疗提供新思路。
1 材料与方法
1.1 主要试剂DMEM细胞培养液、胎牛血清和胰酶均购自美国Gibco公司;Hoechst 33342染色试剂盒(货号:ab228551)购自英国abcam公司;虫草素(货号:C9137-1MG,纯度≥95%)、EdU 染液试剂盒(货号:900584)购自美国sigma公司;Ki67(货号:ab16667)、PCNA(货号:ab29)、Caspase-3(货号:ab13847)、Caspase-9(货号:ab32539)、Beclin 1(货号:ab207612)、p62(货号:ab56416)、LC3A/B(货号:ab128025)、PI3K(货号:ab32089)、p-PI3K(货号:ab182651)、AKT(货号:ab8805)、p-AKT(货号:ab131443)、mTOR(货号:ab2732)、p-mTOR(货号:ab109268)、GAPDH一抗(货号:ab181062)购自美国abcam公司;HRP标记的山羊抗小鼠二抗购自美国Santa Cruz公司;LY294002(货号:S1737)购自上海亚培生物科技有限公司。
1.2 主要仪器半干转膜仪、电泳仪以及PCR仪均购于美国伯乐公司; Multiskan GO酶标仪购自美国Thermo;Gel View 6000化学发光凝胶成像仪购于广州云星仪器有限公司;分析天平ME204购自梅特勒托利多国际贸易(上海)有限公司;生物安全柜HR30-IIA2、-86 ℃超低温冰箱DW-86L578J、-25 ℃低温保存箱DW-25L262h和2~8 ℃医用冷藏箱HYC-310购自河南郑州海尔公司;Eppendorf台式冷冻离心机5702R购自德国艾本德股份公司。
1.3 实验方法
1.3.1EdU染色 将对数生长期细胞8×103个/孔 接种于96孔板,过夜培养;经过24 h CP处理后,用完全培养基按照1 000 ∶1比例稀释EdU溶液(试剂A),制备适量50 μmol/L EdU培养基;每孔加入100 μl的50 μmol/L的EdU培养基进行2 h孵育。弃去培养基,PBS缓冲液清洗细胞2次,每次5 min。各孔加入100 μl的细胞固定液在室温下孵育30 min,加2 mg/ml的甘氨酸,脱色摇床进行孵育5 min;各孔加100 μl PBS缓冲液,脱色摇床进行孵育5 min。各孔加入100 μl 1×Apollo染色反应液后,室温避光下脱色摇床孵育30 min。去除染色反应液,加100 μl渗透剂在脱色摇床清洗2次,每次10 min。准备后续Hoechst染色。
1.3.2Hoechst染色 对药物处理的细胞培养48 h后进行染色处理:吸尽培养液后加入0.5 ml固定液固定10 min;去除固定液用PBS洗两遍,每次3 min;加入0.5 ml Hoechst染色液染色5 min;用PBS洗2遍,每次3 min;滴加抗荧光淬灭封片液盖上盖玻片荧光显微镜下观察。
1.3.3免疫荧光染色 操作步骤按照说明书进行,细胞接种于预先用0.01%多聚赖氨酸包被的盖玻片,经药物处理后,进入4%多聚甲醛固定30 min。PBS漂洗,用含Triton X-100封闭液在冰上通透5 min;吸掉通透液,加入预温的封闭液,室温下封闭1 h; 孵育一抗4 ℃过夜。次日,PBS漂洗,孵育荧光标记的二抗(浓度为1 ∶200),室温避光孵育1 h,PBS漂洗,50%甘油-指甲油封片,立即避光共聚焦显微镜观察。
1.3.4Western blot检测细胞中蛋白表达 收集四组细胞,PBS清洗3次,用添加有终浓度为1 mmol/L的蛋白酶抑制剂苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的细胞裂解液进行裂解,提取各组细胞总蛋白。用BCA试剂盒检测总蛋白浓度(具体检测按照试剂说明书进行),10% SDS-PAGE胶分离蛋白后用半干转膜仪转移蛋白质至PVDF膜。用5% 脱脂牛奶室温封闭蛋白2 h,随后加入一抗于4 ℃封闭过夜,第2天加入对应二抗室温封闭1 h,最后滴加ECL曝光显影。SDS-PAGE凝胶电泳分离并转至PVDF膜,经5% BSA封闭后依次孵育相应一抗和二抗。显色并统计灰度值计算相对表达量。
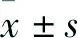
2 结果
2.1 CP抑制SCC9细胞增殖、促进细胞凋亡EdU染色实验结果表明:与正常SCC9 blank组相比,CP各组EdU阳性细胞所占比率均有不同程度的降低(t=6.445,P<0.01,n=10;t=18.064,P<0.01,n=10;t=36.200,P<0.01,n=10),见图1;随着CP使用浓度逐渐升高,EdU阳性细胞所占比率逐渐下降。
Hoechst染色实验显示:正常SCC9 blank组细胞形态均匀一致,几乎没有皱缩等形态;与正常SCC9 blank组比较,随着CP给药浓度逐渐增大,各用药组SCC9细胞核逐渐凝聚,细胞皱缩,Hoechst染色逐渐加深。与正常SCC9 blank组相比,CP各组细胞凋亡率均有不同程度的升高(t=7.192,P<0.01,n=10;t=18.064,P<0.01,n=10;t=26.964,P<0.01,n=10),见图2;随着CP使用浓度逐渐升高,细胞凋亡率逐渐升高。
Western blot检测显示:与正常SCC9 blank组细胞相比,随着CP给药浓度逐渐增大,细胞内增殖相关因子Ki67(t=5.542,P<0.01,n=10;t=36.948,P<0.01,n=10;t=56.374,P<0.01,n=10)和PCNA(t=10.172,P<0.01,n=10;t=38.105,P<0.01,n=10;t=49.760,P<0.01,n=10)表达水平逐渐降低,而凋亡相关因子Caspase-3(t=0.456,P<0.01,n=10;t=21.073,P<0.01,n=10;t=41.678,P<0.01,n=10)和Caspase-9(t=0.992,P<0.01,n=10;t=28.987,P<0.01,n=10;t=58.024,P<0.01,n=10)则逐渐上调(P<0.01),见图3。
2.2 CP促进SCC9细胞自噬Western blot实验显示,与正常SCC9 blank组细胞比较,随着CP给药浓度逐渐增大,各用药组SCC9细胞中自噬抑制相关因子Beclin 1(t=14.697,P<0.01,n=10;t=5.146,P<0.01,n=10;t=12.281,P<0.01,n=10)和LC3-II(t=3.386,P<0.01,n=10;t=42.449,P<0.01,n=10;t=7.382,P<0.01,n=10)表达量逐渐上调;而促进自噬相关蛋白p62(t=11.024,P<0.01,n=10;t=12.639,P<0.01,n=10;t=16.246,P<0.01,n=10)表达量则逐渐下降(P<0.01),见图4。
2.3 CP促进SCC9细胞LC3+自噬细胞比例免疫荧光染色鉴定LC3+细胞量,正常SCC9 blank组细胞质中很少含有聚集的染色亮点;与正常SCC9 blank组细胞比较,随着CP给药浓度逐渐增大,各用药组SCC9细胞质中荧光亮点数目逐渐增加,同时伴有荧光亮点面积逐渐增加(t=14.037,P<0.01,n=10;t=39.413,P<0.01,n=10;t=46.135,P<0.01,n=10)。见图5。
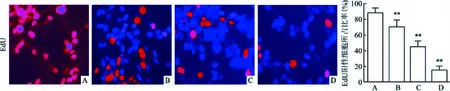
图1 不同处理组EdU染色鉴定细胞增殖×200A:SCC9 blank组;B:CP(5 μg/ml)组;C:CP(10 μg/ml)组;D: CP(20 μg/ml)组;与SCC9 blank组比较:**P<0.01

图2 Hoechst染色检测SCC9细胞凋亡×200A:SCC9 blank组;B:CP(5 μg/ml)组;C:CP(10 μg/ml)组;D: CP(20 μg/ml)组;与SCC9 blank组比较:**P<0.01
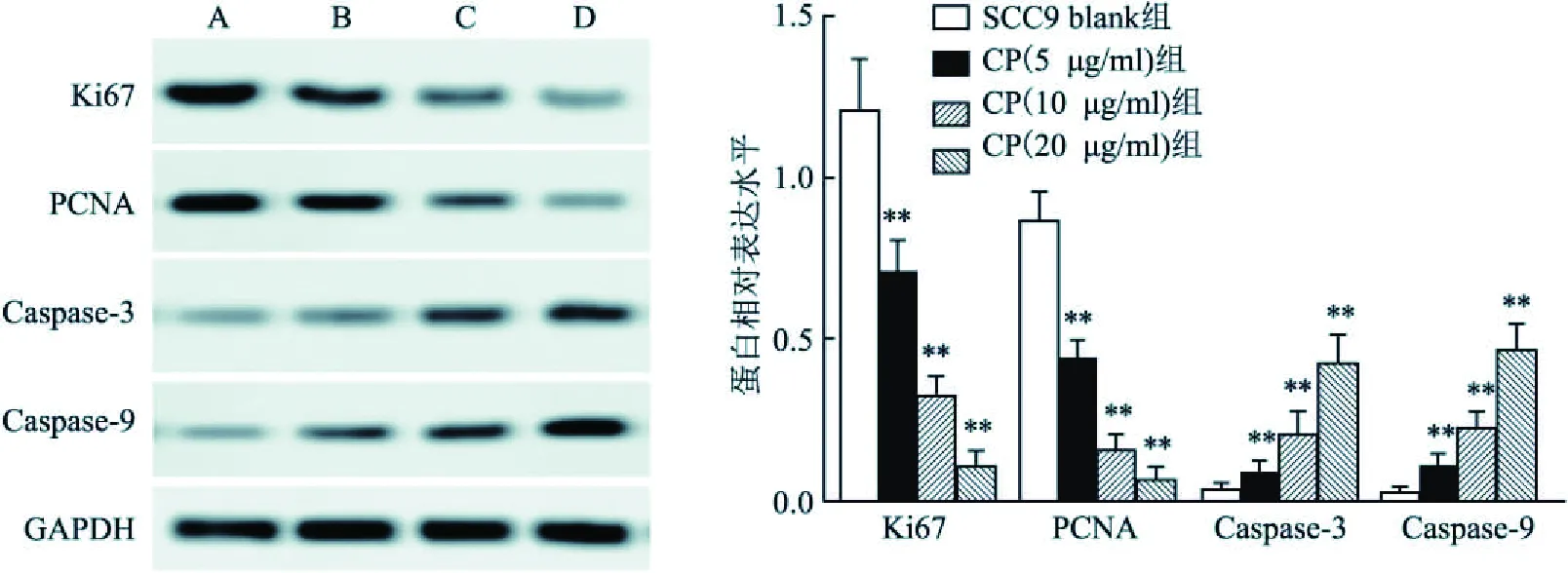
图3 Western blot检测细胞增殖和凋亡蛋白表达A:SCC9 blank组;B:CP(5 μg/ml)组;C:CP(10 μg/ml)组;D: CP(20 μg/ml)组;与SCC9 blank组比较:**P<0.01
2.4 CP抑制SCC9细胞中PI3K通路活性为了进一步探究CP对SCC9细胞的作用机制,通过Western blot检测不同处理组细胞中PI3K通路相关分子活性情况。与SCC9 blank组细胞比较,随着CP给药浓度逐渐增大,各用药组SCC9细胞中自噬通路相关基因PI3K、AKT及mTOR分子表达激活水平逐渐受到抑制(t=7.257,P<0.01,n=10;t=18.064,P<0.01,n=10;t=21.411,P<0.01,n=10;t=6.521,P<0.01,n=10;t=14.589,P<0.01,n=10;t=22.759,P<0.01,n=10;t=6.653,P<0.01,n=10;t=15.726,P<0.01,n=10;t=23.508,P<0.01,n=10),见图6,在20 μg/ml组时达到最强。
2.5 CP通过抑制PI3K通路抑制SCC9细胞增殖、促进细胞凋亡、自噬添加PI3K通路抑制剂LY294002后,EdU染色实验结果表明:与正常SCC9 blank组相比,LY294002组和CP(20 μg/ml)组EdU阳性细胞所占比率均有明显降低(t=14.589,P<0.01,n=10;t=18.064,P<0.01,n=10),与CP(20 μg/ml)组相比,LY294002+CP(20 μg/ml)组EdU阳性细胞所占比率明显降低(t=3.386,P<0.01,n=10),见图7。
添加PI3K通路抑制剂LY294002后,Hoechst染色实验结果表明:与正常SCC9 blank组相比,LY294002组和CP(20 μg/ml)组Hoechst阳性细胞所占比率均有明显升高(t=11.265,P<0.01,n=10;t=7.156,P<0.01,n=10),与CP(20 μg/ml)组相比,LY294002+CP(20 μg/ml)组Hoechst阳性细胞所占比率明显升高(t=3.413,P<0.01,n=10),见图8。
添加PI3K通路抑制剂LY294002后,免疫荧光染色鉴定LC3+细胞量实验结果表明:与正常SCC9 blank组相比,LY294002组和CP(20 μg/ml)组荧光亮点数目明显升高(t=24.798,P<0.01,n=10;t=31.654,P<0.01,n=10),与CP(20 μg/ml)组相比,LY294002+CP(20 μg/ml)组荧光亮点数目明显升高(t=5.122,P<0.01,n=10),见图9。
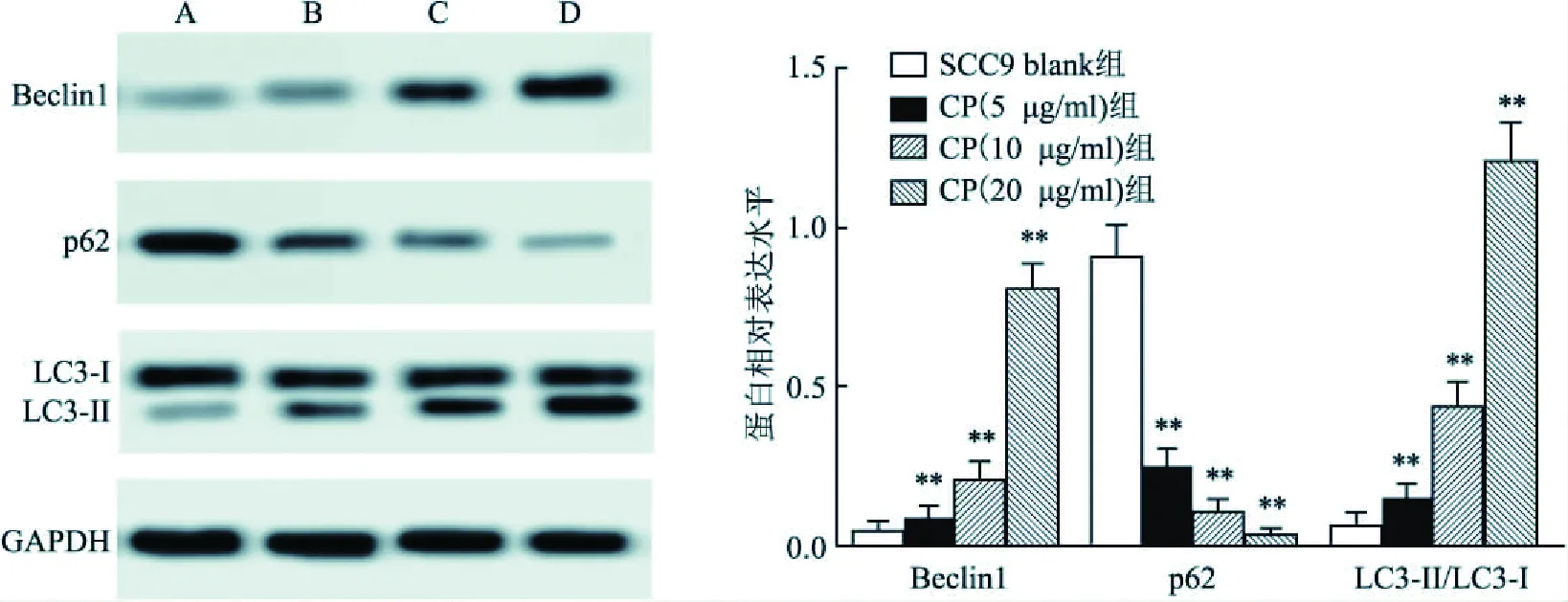
图4 Western blot检测细胞自噬相关蛋白表达水平A:SCC9 blank组;B:CP(5 μg/ml)组;C:CP(10 μg/ml)组;D: CP(20 μg/ml)组;与SCC9 blank组比较:**P<0.01

图5 免疫荧光检测LC3+细胞表达分布×200A:SCC9 blank组;B:CP(5 μg/ml)组;C:CP(10 μg/ml)组;D: CP(20 μg/ml)组;与SCC9 blank组比较:**P<0.01
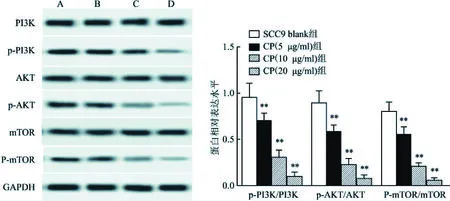
图6 Western blot检测各处理组自噬通路相关分子活性A:SCC9 blank组;B:CP(5 μg/ml)组;C:CP(10 μg/ml)组;D: CP(20 μg/ml)组;与SCC9 blank组比较:**P<0.01
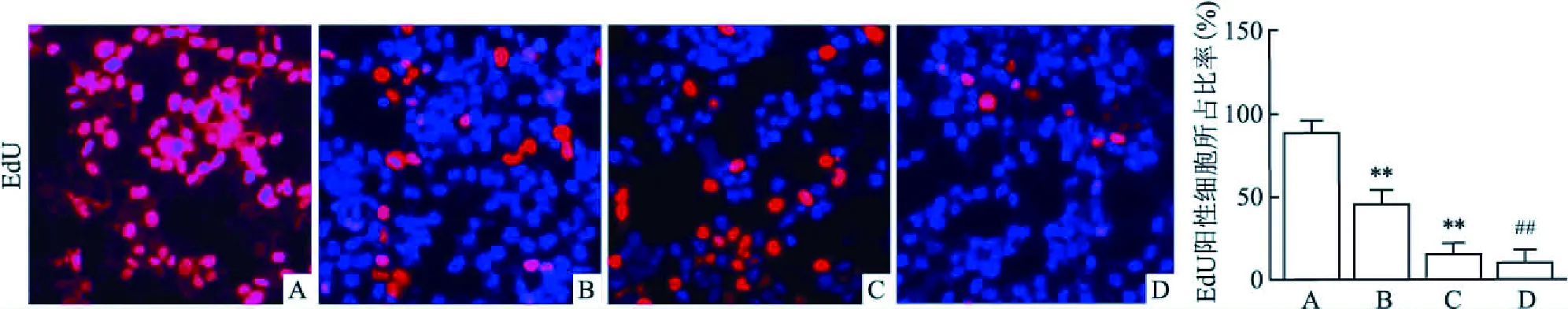
图7 不同处理组EdU染色鉴定细胞增殖 ×200A:SCC9 blank组;B:LY294002组;C: CP(20 μg/ml)组;D: LY294002+CP(20 μg/ml)组;与SCC9 blank组比较:**P<0.01;与CP(20 μg/ml)组比较:##P<0.01
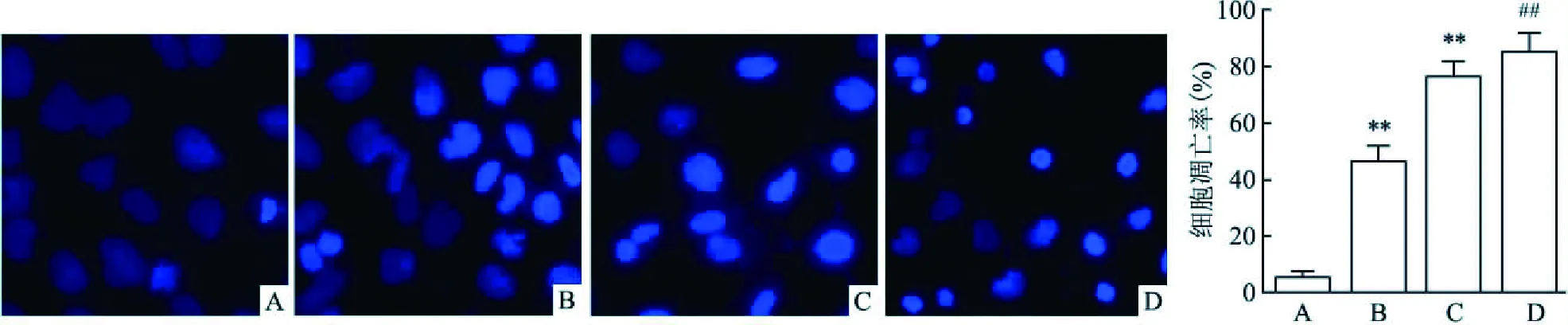
图8 Hoechst染色检测SCC9细胞凋亡 ×200A:SCC9 blank组;B:LY294002组;C: CP(20 μg/ml)组;D: LY294002+CP(20 μg/ml)组;与SCC9 blank组比较:**P<0.01;与CP(20 μg/ml)组比较:##P<0.01
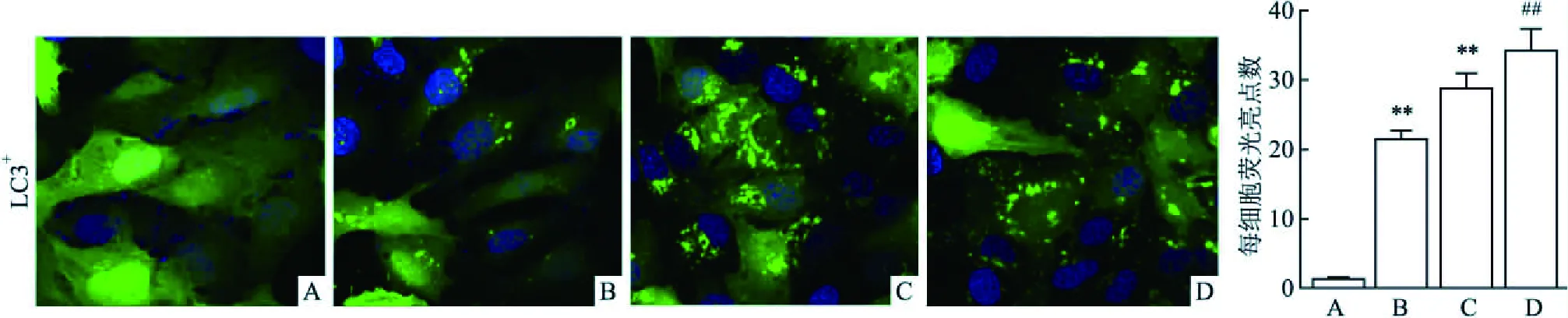
图9 免疫荧光检测LC3+细胞表达分布 ×200A:SCC9 blank组;B:LY294002组;C: CP(20 μg/ml)组;D: LY294002+CP(20 μg/ml)组;与SCC9 blank组比较:**P<0.01;与CP(20 μg/ml)组比较:##P<0.01
3 讨论
鳞状细胞癌一般发生于口腔黏膜和颌面部皮肤部位的鳞状上皮中,病理学表现主要为:增生性鳞状上皮在侵犯周围结缔组织后形成原位癌。鳞状细胞不是角化形态时,有可能会同时具有多形性细胞,这种细胞具有恶性程度较高,称为无角化的鳞状细胞癌。不良的生活习惯会导致OSCC发生,如吸烟、饮酒、嚼槟榔等[10]。随着治疗OSCC的不断发展,相关治疗手段已不仅局限在手术治疗,还可以结合化疗、放疗等其他治疗方式。但仍有60%以上的患者病情不能得到有效的控制,术后生存率低于50%[11]。
植物药中具有抗肿瘤功效的药品因良好效用和相对微小毒副作用逐渐受到人们关注。近些年来,经过大量国内外科学家证实,CP作为一种核苷酸,具有诸多生物学功能,如抑菌抗病毒、调节免疫功能、对抗炎症反应以及抗肿瘤作用等[5]。CP的抗肿瘤机制复杂,诸多学者证实因同腺苷结构类似,CP可以参与DNA或RNA的生物合成中,但体内多数酶无法将腺苷与CP进行区别,从而终止碱基合成[12]。Zheng et al[13]研究者证实CP可以在舌癌中抑制AMPK-mTOR通路来抑制肿瘤细胞增殖和诱导细胞自噬。该研究利用Western blot和免疫荧光等技术对Beclin 1、p62及LC3 Ⅱ和上游信号分子进行验证,发现CP可以有效影响自噬相关标记分子和上游信号分子的活性,促进自噬发生。同时还检测到增殖相关蛋白Ki67和PCNA表达在经过CP处理后发生明显下调,说明OSCC的增殖能力也受到影响。
PI3K-蛋白激酶B-雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路是生物体细胞内一经典信号通路,自发现以来在肿瘤发生发展中的作用即被广泛研究,已经在多数肿瘤里呈不同程度高表达或异常活化[7-8]。丹参酮IIA可以通过诱导Beclin 1-Atg5通路和抑制PI3K-Akt- mTOR通路来促进肿瘤自噬发生[14]。也有研究[15]证明CP可以下调p38 AMPK和PI3K-Akt通路活性来诱导小鼠睾丸癌发生凋亡。本研究显示,在正常OSCC中,PI3K-Akt-mTOR通路活性均呈高度异常激活,当使用CP处理后,三者活性水平均有所下调,并且随着CP使用浓度升高三者活性降低水平越低。这一结果充分说明较高浓度CP可以有效降低OSCC细胞中PI3K-Akt- mTOR通路的活性水平。另外,利用免疫荧光技术鉴定不同处理组OSCC中LC3+的比例发现,在细胞进行CP处理后,有较多的细胞呈现LC3+表达,并且在不同浓度组细胞中呈现出高比例的LC3+细胞;同时利用Western blot对自噬相关蛋白Beclin 1、p62和LC3 Ⅱ的表达水平也进行了验证,发现不同浓度组CP处理可以有效对相应分子发生逆转;以上结果充分证明有较多的细胞启动自噬程序。说明不同浓度CP可能通过降低PI3K-Akt- mTOR来启动OSCC自噬发生。
综上,CP对OSCC细胞具有很好的促自噬和生长抑制效果。主要体现在CP处理OSCC后,可以有效降低细胞内PI3K-Akt-mTOR通路分子活性,并激活下游相应自噬相关的标志分子表达。同时CP处理还有效降低癌细胞内增殖相关蛋白Ki67和PCNA的表达,进一步抑制癌细胞的增殖能力。本研究通过CP处理OSCC后显著激活细胞自噬,并可以抑制癌细胞增殖能力的结果显示,CP对阐明OSCC发生发展机制,寻找其中潜在的分子标志物,对进一步提高OSCC患者的治疗和预后效果具有重要的研究意义。

