飞蝗转录因子LmE74A的表达和调控
孙亚文,张学尧,张敏,刘晓健*
(1.山西大学 应用生物学研究所,山西 太原 030006;2.山西大学 生命科学学院,山西 太原 030006)
0 引言
飞蝗(Locustamigratoria)是一种破坏性极强的世界性农业害虫。频繁大剂量地利用化学杀虫剂防治飞蝗造成一系列的后果,如农药残留危害非靶标生物及昆虫自身产生抗药性[1-3]等。蜕皮是昆虫发育变态中非常关键的生命过程,亦是害虫控制的理想靶标。
昆虫蜕皮受保幼激素(juvenile hormone,JH)和蜕皮激素(20-hydroxyecdysone, 20E)的协同调控[4-5]。20E通过与20E受体EcR和超气门蛋白USP结合形成的异源二聚体,激活一系列初级转录因子(如E74,E75,Broad等)的表达,这些基因再调控下游效应基因表达,最终使昆虫顺利完成蜕皮[6-9]。E74已在黑腹果蝇(Drosophilamelanogaster)[10-13]、家蚕(Bombyxmori)[14]、烟草天蛾(Manducasexta)[15]、马铃薯甲虫(Leptinotarsadecemlineata)[16]、埃及伊蚊(Aedesaegypti)[17]等完全变态昆虫有较深入的研究。E74可分为转录激活域(Trans-activation domain)、铰链域(Linker region)、核定位域(Nulear localization motif)、ETS域(ETS domain)、F域5个区域,其中ETS结构域被认为是位置特异性的DNA结合域。由于转录激活域结构的不同,E74可分为A和B两种同型异构体。
飞蝗是典型的不完全变态昆虫,本文克隆获得了LmE74A基因的cDNA序列,并对其mRNA表达特性、调控及功能进行了分析,在生物学特性差异较大的昆虫中开展E74A基因分子特性及功能的研究,对于全面了解激素调控昆虫蜕皮的信号传导途径具有重要的生物学意义。
1 材料与方法
1.1 实验材料
本实验材料飞蝗虫卵购买于蝗虫养殖公司(河北沧州),在温度为(30±2)℃,湿度为(40±10)%,光照14 h:黑暗10 h的人工气候箱中进行孵化。将孵化出的1龄若虫转移至缝制的纱笼中,饲喂新鲜的小麦幼苗,在3龄若虫期之后添加麦麸。
1.2 供试药品

1.3 实验方法
1.3.1LmE74A基因全长cDNA序列获得
在飞蝗的转录组数据库中进行搜索,得到E74基因的全长cDNA序列。在NCBI里进行Blast分析,将其命名为LmE74A并确定其结构域。使用Primer 5.0软件设计E74A基因的全长引物,引物信息见表1。以飞蝗总cDNA为模板,通过PCR法验证获得的E74A的全长序列。之后利用ExPASy(http:∥www.expasy.org/)网站确定LmE74A开放阅读框并预测等电点及分子量。
1.3.2LmE74A基因的mRNA表达特性
通过Primer 5.0软件设计LmE74A和β-Actin内参基因的特异性表达引物(表1),通过RT-qPCR技术分析LmE74A基因在五龄第6天(N5D6)的体壁、前肠、中肠、后肠、胃盲囊、马氏管、脂肪体、翅8个组织和五龄若虫不同发育天数的体壁中mRNA表达特性。由于在上述实验条件下飞蝗五龄发育期共8天,因此我们从第一天开始到第八天结束进行体壁的取材,即N5D1-N5D8。总RNA提取使用RNAisoPlus试剂,之后在NANODROP 2000上定量,根据反转录酶说明书将1.0 μg 的总RNA 合成cDNA。RT-qPCR反应体系为20 μL:10 μL SYBRGreen real-time PCR Master Mix;2 μL cDNA (10×);0.4 μmol/L F/R引物; 6.4 μL ddH2O。反应条件为95℃预变性15 s,变性95℃ 15 s,退火60℃ 31 s,40个循环。设置3个生物学重复,每个生物学重复3头试虫,每个样品2个技术学重复。利用2-ΔCT的方法计算LmE74的mRNA相对表达量。数据用SPSS Tukey’s HSD进行数据分析,P<0.05 为差异显著。
1.3.3 20E诱导
为了检测飞蝗LmE74A是否受20E的调控,用10%的乙醇将20E稀释成终浓度5 μmol/L备用,在五龄第1 d若虫体腔内注射10 μg 20E,同时以相同体积的10%的乙醇作为对照,分别在30 min, 1 h, 3 h, 6 h, 12 h之后取飞蝗第2-3体节的体壁冻存于液氮中用于提取RNA,通过RT-qPCR技术检测LmE74A在对照组和20E注射组的表达量,6头试虫组成一个生物学重复,对照组和20E注射组分别设4个重复,共计48头试虫,RNA提取,cDNA反转录、RT-qPCR的具体操作同上。

表1 LmE74A研究中使用的引物
1.3.4LmE74A基因的功能分析
在E-RNAi网站设计LmE74A基因的dsRNA引物,通过PCR扩增获得体外合成LmE74A基因dsRNA的模板。按照T7 RiboMAXTMExpress RNAi System说明书合成dsRNA。用质量分数为1%的琼脂糖凝胶电泳检测dsRNA是否单一并定量至终浓度为3 μg/μL,保存至-80℃备用。注射LmE74A基因的dsRNA于五龄第1天(N5D1)的飞蝗若虫体腔内,并在五龄第3天(N5D3)进行dsLmE74A的补注实验,每头每次15 μg,并设置对照组。设置3个生物学重复,每个重复对照和实验组各15头若虫,一共45头试虫。在补注dsLmE74A后的48 h即五龄第5天(N5D5)收集实验组和对照组的飞蝗体壁各9头,3头一个重复,采用RT-qPCR检测LmE74A的表达量。其余的试虫置于烧杯中进行饲养用于观察其生长状态,记录异常的表型和死亡率。
2 结果与分析
2.1 LmE74A基因的cDNA序列分析
在飞蝗转录组数据库搜索得到E74A基因的cDNA序列,通过NCBI中Blast比对分析表明LmE74A为全长序列,命名为LmE74A,GenBank登录号为:MK568625。开放阅读框为1 539 bp,编码512个氨基酸,预测LmE74A蛋白的分子量为54.9 KDa,等电点为6.25。如图1所示LmE74A的ETS域与赤拟谷盗、家蚕、烟草天蛾和马铃薯甲虫的ETS域一致度几乎100%。

注:下划线标注ETS域图1 飞蝗LmE74A与其他昆虫E74A的氨基酸比对图Lm:Locusta migratoria 飞蝗; Ld:马铃薯甲虫Leptinotarsa decemlineata;Bm:Bombyx mori 家蚕;Tc: Tribolium castaneum赤拟谷盗;Ms:Manduca sexta烟草天娥Fig.1 Alignment E74A among L. migratoria and other insects(the ETS domain was underlined).
2.2 LmE74A基因在五龄若虫期不同组织部位的表达
RT-qPCR的结果表明:LmE74A在体壁中的表达量显著高于前肠和后肠,胃盲囊、中肠、脂肪体、马氏管和翅的表达量最低(图2)
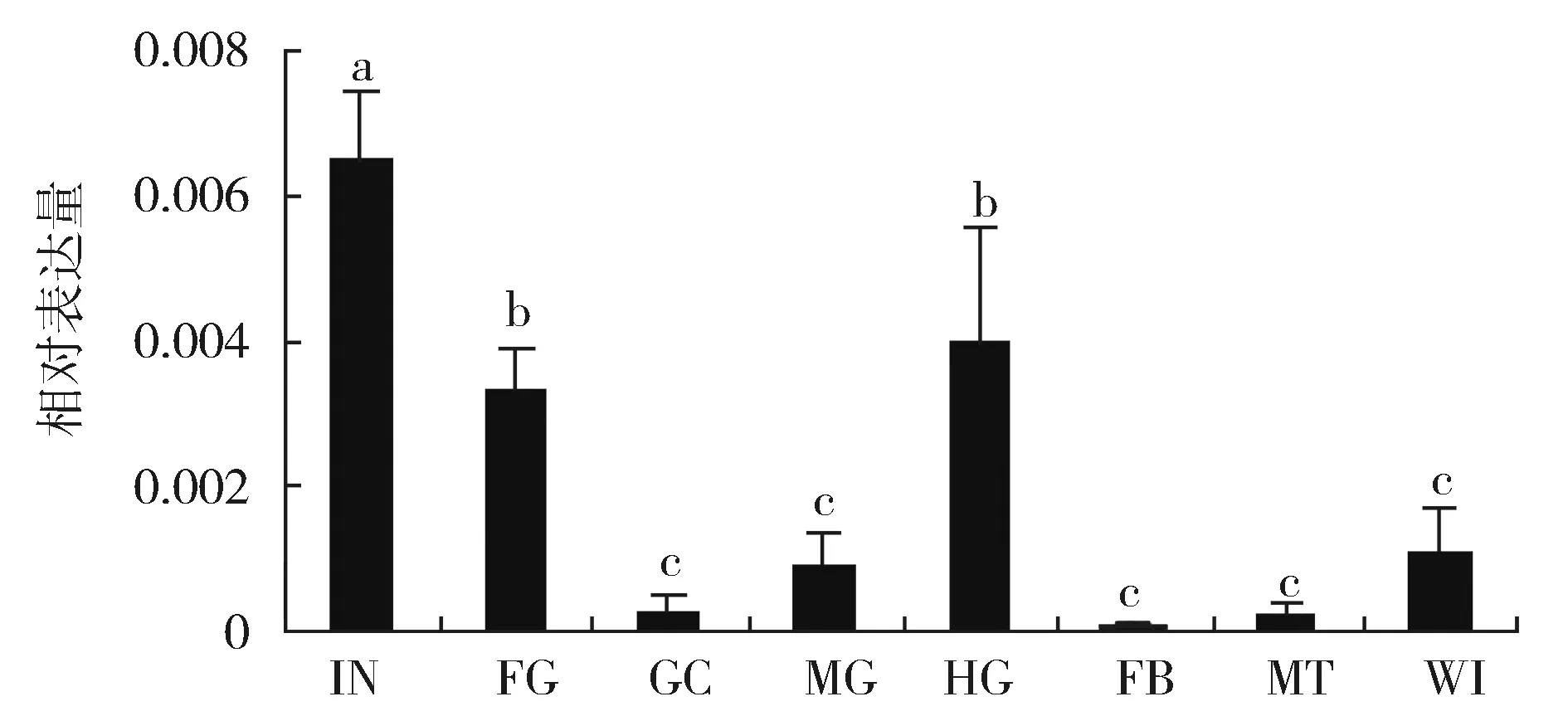
柱形图上不同的字母代表基因表达差异显著(P<0.05,Tukey’s HSD;n=3)。注:IN (Integument):体壁;FG (Foregut):前肠;MG (Midgut):中肠;GC (Gastric caeca):胃盲囊;HG (Hindgut):后肠;FB (Fat body):脂肪体;MT (Malpighian tubules):马氏管; WI (Wing):翅。图2 飞蝗五龄若虫期不同组织部位LmE74A基因的表达Different letters on the bars of the histogram indicated statistically significant difference (P<0.05, Tukey’s HSD; n=3)。the same for the following figures.Fig.2 Expression of LmE74A gene in differenttissues of the 5th instar nymphs of L. migratoria
2.3 LmE74A基因在五龄若虫期不同发育天数的表达
RT-qPCR的结果表明:LmE74A在第五天中表达量最高,蜕皮前后表达量较低(图3)。
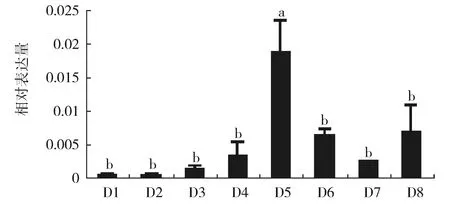
图3 飞蝗五龄不同发育天数LmE74A基因的表达Fig.3 Expression of LmE74A gene in different days of the 5th instar nymphs of L. migratoria
2.4 20E诱导
为了检测飞蝗LmE74A是否受20E的调控,对5 龄第1天若虫进行20E注射,通过RT-qPCR检测注射20E之后不同时间点LmE74A表达量。结果显示(图4),与对照组比较,LmE74A在注射20E 1 h、3 h、12 h后表达量显著升高。
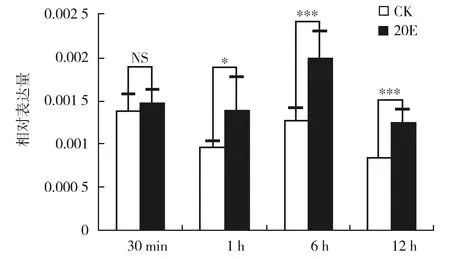
注:无显著差异P>0.05;*:差异显著P<0.05;***:差异极显著P<0.001,Student’s t test。图4 体内注射20E不同时间后LmE74A的相对表达量NS:No significant difference P>0.05;*:significant difference P<0.05;***:greatly significant difference P<0.001。the same for the following figuresFig.4 Relative expression of LmE74A after 20E injection in vivo at different times
2.5 LmE74A基因的功能分析
为进一步探索LmE74A在飞蝗蜕皮过程中的功能,在第二次注射LmE74A的双链RNA 48 h后,取飞蝗体壁样品提取RNA,通过RT-qPCR技术检测LmE74A基因的表达量,结果发现,与对照组相比,注射dsLmE74A组的飞蝗LmE74A的表达能够被显著抑制(图5)。但注射dsLmE74A后并不影响昆虫的蜕皮,实验组试虫均能够正常羽化为成虫。
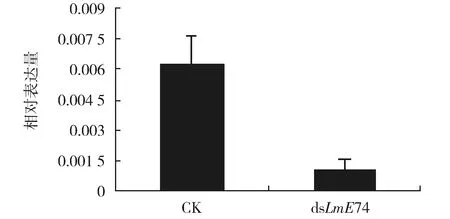
图5 飞蝗五龄若虫期注射dsLmE74A后对LmE74A基因表达量的影响Fig.5 Effect on the LmE74A gene expression after the injection of dsLmE74A into the 5thinstar nymphs of L. migratoria
3 讨论
蜕皮是线虫和节肢动物等蜕皮类生物特有的生命现象,是昆虫发育变态的重要程序之一。从分子生理学的角度看,昆虫蜕皮是由一个激素网络所协同调控的复杂生命过程[4-5]。由于昆虫在蜕皮时不吃少动,对作物没有危害,因此,昆虫蜕皮一直是害虫控制的研究靶标。本文克隆获得了飞蝗转录因子LmE74A的全长cDNA序列,其开放阅读框为1 539 bp,编码512个氨基酸。与其他已知物种的基因结构域一致,LmE74A自N端起分为A/B域转录激活域由308个氨基酸组成、C域铰链域由98个氨基酸组成、D域核定位域由8个氨基酸组成、E域ETS域由85个氨基酸组成和F域由13个氨基酸组成。并且LmE74A的氨基酸序列与其他物种的相似度极高,其中与马铃薯甲虫(L.decemlineata)的氨基酸一致度高达57.8%,与烟草天娥(M.sexta)的氨基酸一致度也达到了54.8%。其中ETS域和核定位域(KR/KXR/K被认为是核定位的信号)分别与果蝇、家蚕和烟草天蛾的ETS域和核定位域表现出几乎100%的一致度。
已有研究表明:飞蝗五龄期只有蜕皮激素,没有保幼激素,因此我们选择五龄期进一步分析了LmE74A基因的mRNA时空表达特性、20E诱导及生物学功能。结果显示:LmE74A基因具有多组织分布特性,在五龄发育时期体壁表达量最高,随后是前肠和后肠,其余组织部位表达量均较低。E74基因组织分布特性在其他物种中也有相关的报道,如果蝇DmE74A在脑和脂肪体等组织高表达[10],马铃薯甲虫LdE74A在中肠组织高表达[15],表明这些组织的发育可能受蜕皮激素的调控。而LmE74A在五龄第5天中表达量最高,蜕皮前后表达量较低。这与20E在五龄期滴度变化趋势一致,推测LmE74A可能受20E的调控[18]。事实上,我们通过体内注射20E后可诱导LmE74A的表达上调,进一步证实LmE74A受20E的调控。之后我们通过RNAi实验发现LmE74A在注射dsLmE74A组可以显著沉默,但注射dsLmE74的试虫仍能成功羽化为成虫,说明LmE74A在飞蝗五龄发育过程中不是必需的。这与完全变态昆虫中对E74功能的研究不同,如在果蝇中发现,DmE74B突变个体出现蛹壳缺陷、头部翻转困难等现象,而DmE74A虽然正常蛹化,但最终在预蛹期或蛹期死亡[11,14],马铃薯甲虫中,注射dsLdE74的个体出现化蛹率低,附肢短小等表型[15]。
目前对于20E的信号传导途径在完全变态昆虫里研究的较多,蜕皮激素如何顺序启动初级转录因子的表达并最终导致昆虫蜕皮,迄今为止仍然是昆虫学领域的重要科学问题。本文首次在渐变态昆虫飞蝗中研究了LmE74A基因的分子特性、调控及功能,对于全面了解激素调控的信号通路具有重要的生物学意义,并为基于激素调控的害虫防治提供了基础数据。

