抗疟药氯喹:抗病毒的重磅武器?
陈晨,朱泽宇,彭伟嘉,杨扬,鲁俊锋,刘宇洁,皮荣标
(1.中山大学药学院,广东 广州 510006;2.吉林医药学院临床医学部,吉林 长春 132013;3.中山大学医学院,广东 广州 510006;4.广东省<中山大学-香港理工大学>抗失智创新药物联合实验室,广东 广州 510006)
病毒是一个由遗传物质与蛋白质构成的非细胞形态,靠寄生生活的介于生命体及非生命体之间的有机物种。病毒由两到三个成分组成:遗传物质(RNA或DNA),用来包裹和保护遗传物质的蛋白质衣壳,及部分病毒在到达细胞表面时能够形成环绕在外的脂质包膜。病毒可以感染几乎所有具有细胞结构的生命体,利用宿主细胞中的物质和能量不断进行自我复制,最终裂解宿主细胞并大量释放开始下一轮感染。病毒从核酸结构及翻译方式上分为:正性单链RNA病毒、负性单链RNA病毒、双链RNA病毒、双链DNA病毒和单链DNA病毒[1]。登革热、流感病毒、SARS冠状病毒和尼帕病毒等新兴病毒已对人类健康构成重大威胁。迄今为止,还没有有效的治疗策略可用于预防和治疗这些致病性感染的爆发。
氯喹(Chloroquine)从1944年开始应用于临床,最初用来治疗疟疾,随后用途逐渐扩大,广泛用于治疗肝阿米巴病、华支睾吸虫病、肺吸虫病、结缔组织病等。近期研究显示出氯喹有一定的抗病毒作用,对多种病毒有效,其机制可能是通过改变细胞溶酶体内pH值,干扰内吞小体介导的病毒进入,并抑制病毒的复制[2-4]。令人振奋的是,最新的体外研究结果显示,氯喹能够有效地抑制2019新型冠状病毒(2019 novel coronavirus,COVID-19)[5]。因此,基于PubMed数据库,我们对近年氯喹抗病毒作用做一总结,并探讨基于氯喹抗COVID-19的可行性及其策略,以期为当前抗COVID-19药物的研发或临床治疗COVID-19肺炎的策略提供有益的帮助。我们根据文献报道及病毒的核酸分类,将氯喹对病毒的作用总结如下(详见表1)。
1 正性单链RNA病毒
1.1 严重急性呼吸系统综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)为具有包膜的正性单链RNA病毒。2003年全球感染人数约8 000人,其中近10%患者死亡。SARS-CoV感染靶细胞是通过病毒的穗蛋白(1 255个氨基酸)与其细胞受体血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)相互作用介导的[6]。研究发现,氯喹对SARS-CoV感染具有很强的抗病毒作用,并抑制其体外传播。其作用机制可能是干扰了细胞受体ACE2末端的糖基化,从而抑制病毒与受体的结合[7-8]。氯喹体外抑制SARS-CoV的IC50为(8.8±1.2)μmol·L-1,明显低于其细胞抑制浓度[7]。Vincent等[8]在Vero-E6细胞株病毒暴露前后用氯喹处理细胞都观察到了抑制作用,表明了氯喹在预防和治疗SARS-CoV感染方面具有优势。De Wilde等[9]从348种FDA批准的药物库中筛选具有抗MERS-CoV活性的药物,发现氯喹不仅抑制中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)(EC50为3.0±1.1 μmol·L-1),还能抑制SARS病毒(EC50为4.1±1.0 μmol·L-1)和人冠状病毒229E的复制。氯喹可能用于预防和治疗SARS-CoV感染,但仍需在动物模型中进行评估。
1.2 MERS-CoV是一种具有包膜的正性单链RNA 病毒。MERS-CoV棘突穗蛋白以二肽基肽酶-4 (dipeptidyl peptidase 4,DPP4)为功能性受体介导感染。DPP4也称为CD26,是一种110 kDa 的细胞表面糖蛋白,广泛表达于T淋巴细胞、支气管黏膜和近端小管刷状缘等多种细胞[10]。
Dyall等[11]在Vero E6细胞株上感染MERS-CoV,发现氯喹具有很好的抗病毒活性(EC50=6.275 μmol·L-1),且毒性低。但最近的研究中,氯喹在MERS-CoV 感染的原代单核细胞源性巨噬细胞(monocyte-derived macrophages,MDMs)和未成熟树突状细胞(immature dendritic cells,IDDCs)中抗病毒活性很低,但是没有观察到明显的细胞毒性[12]。氯喹在体内水平抗MERS-CoV的活性有待进一步研究。
1.3 尼帕病毒(Nipah virus)是一种正性单链RNA病毒,能引起广泛的血管炎,感染者有发热、严重头痛、脑膜炎等症状,给人及动物带来严重危害。狐蝠科的果蝠是其天然宿主。尼帕病毒是继英国疯牛病、台湾地区猪口蹄疫、香港地区禽流感后,又一引起世界各国广泛关注和恐慌的人畜共患病。在体外,氯喹对尼帕病毒有着良好的抑制作用,但是体内作用尚不明确。
Pallister等[13]在体内水平证实了0.4、0.2和0.1 μmol·L-1剂量的氯喹在一定程度上可以抑制尼帕病毒的复制;但是在体外动物实验中,尼帕病毒感染的12~18个月大的雪貂给予氯喹25 mg·(kg·d)-1治疗,未能阻止尼帕病毒的复制和病情的发展。Freiberg等[14]在感染尼帕病毒的Hela细胞系中,给予20 μmol·L-1剂量的氯喹后,可减少尼帕病毒的增殖与传播;但在体外试验中给予50 mg·kg-1的氯喹,不能延长染病仓鼠的存活时间。因此,氯喹对尼帕病毒的作用有待进一步研究。
1.4 黄热病病毒(yellow fever virus)是一种主要通过蚊虫叮咬传播的正性单链RNA病毒。黄热病死亡率高、传染性强,主要在非洲、中美洲和南美洲的热带地区进行传播。然而,疫苗短缺和普及范围局限等因素导致黄热病仍然不断出现和流行。目前针对黄热病尚无特异性的治疗方法,主要以对症治疗和支持治疗为主[15]。实验数据表明,氯喹不影响抗体介导的病毒生长增强,但无论是否在抗体存在下进行感染,氯喹均能抑制病毒复制,不过尚缺少体内水平研究[15]。黄热病疫苗和氯喹联用的前瞻性实验中表明,常规的抗疟剂量氯喹不影响黄热病疫苗的抗体应答[16]。
1.5 登革病毒(dengue virus)是一种正性单链RNA病毒,属于黄病毒科黄病毒属,感染后可导致隐性感染、登革热、登革出血热。登革热是世界上分布最广的虫媒病毒疾病,典型临床表现为起病急骤,高热,头痛,肌肉、骨关节剧烈酸痛、部分患者出现皮疹、出血倾向、淋巴结肿大、白细胞计数减少、血小板减少等。氯喹可能通过将溶酶体pH增加到诱导病毒包膜和溶酶体膜融合所需的临界值以上,防止病毒脱壳。这在抑制登革热感染中尤为重要,因为登革热病毒需要在内吞小体中体酸化才能在细胞质中释放病毒RNA,进而启动病毒的复制的步骤。
Farias等[17-18]的研究表明,氯喹在体内和体外都能够抑制登革热病毒的复制。在U937细胞中,50 μg·mL-1的氯喹可使受感染的U937细胞产生的病毒明显减少,IL-12、IFN-γ、IL-6、TNF-α、IFN-β和IFN-α的mRNA合成水平降低并减少促炎因子产生。而在体外试验中,非人灵长类AOTUS猴在感染登革热后,第1~4天口服氯喹(25 mg·kg-1);在第5~8天剂量为10 mg·kg-1;在第9天和第10天剂量为5 mg·kg-1。给药结束后,实验组病毒血症减轻,病毒复制减少,炎症相关因子TNF-α和IFN-γ的产生减少。Borges等[19]的研究表明,登革热患者每日口服600 mg氯喹,持续3 d,可改善生活质量与状态,恢复其日常活动,但对于疾病的进程与发烧症状无明显改善。
1.6 丙型肝炎病毒(hepatitis C virus,HCV)是一种具有包膜的正性单链RNA病毒,属于黄病毒科,全长9.6 Kb。据世界卫生组织统计,全球HCV的感染率约为3%,估计约1.8亿人感染了HCV,每年新发HCV病例约3.5万例。丙型肝炎呈全球性流行,可导致肝脏慢性炎症坏死和纤维化,部分患者可发展为肝硬化甚至肝细胞癌。在体内试验中,Peymani等[20]通过对丙肝诊断标准无明显反应的患者运用氯喹治疗(氯喹150 mg 每天一次共计8周,安慰剂每天1次共计8周),发现氯喹组维生素D的水平从15 ng·mL-1上升到了34 ng·mL-1,与安慰剂组相比明显升高,以此表明氯喹的治疗可能对诊断标准没有反应的丙肝患者有非常好的疗效。与此同时,Peymani等[21]给予丙肝患者氯喹150 mg·d-1,对照组给予安慰剂,连续8周,发现丙肝病毒的RNA在氯喹8周的治疗后显著降低,表明氯喹可能是对HCV安全有效的治疗药物。另一方面,在体外实验中,Mizui等[22]通过在Huh-7细胞上暴露氯喹10 μmol·L-1和IFN-α(100 U·mL-1) 培养7 d,之后在没有药物干预的情况下继续孵育21 d,观察到氯喹抑制胞内HCV复制的效果与氯喹的作用时间呈正相关;联合氯喹与IFN-α的治疗表明,氯喹会明显增加IFN-α的抗HCV病毒活性,减少延长细胞周期,降低蛋白亮氨酸的降解,表明氯喹对丙肝有明显的治疗效果。
1.7 寨卡病毒(Zika virus,ZIKV)是一种经由蚊子传播的正性单链RNA包膜病毒。先前的报道表明,ZIKV以跨膜受体酪氨酸激酶蛋白AXL为功能性受体感染哺乳动物细胞[23]。Delvecchio等[24]用不同浓度的氯喹处理ZIKV感染的Vero细胞、人脑微血管内皮细胞、人神经干细胞和小鼠神经球,氯喹均表现出抗ZIKV病毒活性。12.5~50 μmol·L-1氯喹显著减少ZIKV感染细胞的数量,并抑制ZIKV病毒产生和细胞死亡,而无细胞毒性。
在体内水平,Shiryaev等[25]在妊娠中后期SJL 孕鼠给予氯喹使ZIKV垂直传播明显减弱,胎鼠脑ZIKV负荷减少20倍以上。Li等[26]给予妊娠中期ICR小鼠氯喹 [100 mg·(kg·d)-1],连续6 d,能保护小鼠免受 ZIKV 感染引起的小头畸形。寨卡病毒在孕鼠体内的垂直传播可能与自噬有关。Cao等[27]在自噬基因Atg16l1敲除孕鼠感染ZIKV后,给予羟氯喹处理,不仅降低母体组织病毒载量,还使胎盘和胎儿组织中的感染率降低。
1.8 奇昆古尼亚病毒(Chikungunya virus,CHIKV)是一种可经蚊虫传播的具有包膜的正性单链RNA病毒,属于披膜病毒科甲病毒属。基孔肯雅热临床上以发热、皮疹、出血和关节剧痛等为特征,少数患者遗留持续性关节僵硬,严重患者可并发出血、循环衰竭。
在Roques等[28]的研究中,用1~50 μmol·L-1氯喹处理被CHIKV感染的原代食蟹猴成纤维/巨噬细胞,结果显示能够抑制单核细胞衍生巨噬细胞和成纤维细胞中CHIKV复制;而在奇昆古尼亚病毒感染的非人灵长类食蟹猴,皮下注射(14 mg·kg-1)氯喹5 d后,加剧了食蟹猴的急性基孔肯雅热。推测可能是氯喹的免疫抑制作用可能超过了抗病毒活性,引发了食蟹猴的病毒血症,加重了病情的发展。Khan等[29]研究发现氯喹以剂量依赖性方式减少Vero细胞感染,有效浓度范围为5~20 μmol·L-1,并感染后的1~3 h内观察到了氯喹的最大抑制作用。Chopra等[30]报道了一项在印度进行的关于氯喹治疗基孔肯雅热后关节炎的临床试验:氯喹组接受磷酸氯喹口服(250 mg·d-1),阳性对照组为(7.5 mg·d-1)美洛昔康治疗,并为每位患者提供口服对乙酰氨基酚(500 mg),以根据需要用作急救镇痛药。调查显示氯喹的镇痛作用并不优于美洛昔康,且多种炎性细胞因子(IL-1、IL-4、IL-10)仍保持上调并持续存在。De Lamballerie等[31]在开展了一项双盲安慰剂对照随机试验,其中27例患者接受了氯喹治疗(第1~3天600 mg,第4~5天300 mg),而27例患者接受了安慰剂治疗。在1~3 d,对于高热性关节炎的持续时间与病毒血症,两组之间没有明显差异;但在第200天,接受氯喹治疗的患者比接受安慰剂的患者抱怨关节痛的频率更高。但其高于常规的氯喹用量(>250 mg·d-1)也可能对试验结果产生影响[32]。综上,氯喹体内抗奇昆古尼亚病毒的作用有待探究。
1.9 辛德毕斯病毒(Sindbis virus)是一种具有包膜的正性单链RNA病毒,广泛分布于欧亚大陆、非洲、大洋洲和澳大利亚。其主要通过蚊子在鸟类宿主之间传播。据报道,由该病毒感染引起的人类疾病主要发生在南非和北欧。症状包括发烧、全身乏力、皮疹和肌肉骨骼疼痛。在相当一部分患者中,肌肉骨骼症状会持续数年。该病毒感染后的慢性疾病与自身免疫性疾病有许多共同特征[33]。当前对辛德毕斯病毒感染没有确切的治疗方法。
1.10 水疱性口炎病毒(vesicular stomatitis virus,VSV)为正性单链RNA病毒,属于弹状病毒科水疱病毒属,主要感染牛、马等牲畜及昆虫,也可使人致病。它引起的临床症状较轻,主要表现为流感样症状和水疱性口腔炎。VSV是广谱溶瘤病毒和强效疫苗载体两个领域已成为有力候选者。G蛋白在存在氯喹的情况下被合成并被糖基化,但是该药物在G蛋白组装的最后阶段阻止了糖蛋白在细胞表面的表达[33-34]。
1.11 西门利克森林病毒(Semliki forest virus)是一类具有包膜的正性单链RNA病毒。病毒粒呈球形,直径多为40~70 nm,核心为直径25~35 nm的二十面体核壳,内含连续线型正链RNA。核壳包裹在紧贴的脂质包膜内,包膜上有糖蛋白刺突。Maheshwari等[35]在小鼠上给予氯喹200 μg·d-1,用药24 h后进行病毒的感染,给予氯喹不感染病毒组作为对照,结果表明氯喹可以明显地增加该病毒的复制,进而产生小鼠自然杀伤细胞活性的降低,从而损伤免疫功能。
1.12 脑心肌炎病毒(encephalomyocarditis virus,EMCV)是一种无包膜的正性单链RNA病毒。EMCV是一种重要的人畜共患病病原体,会引起猪和某些哺乳动物、啮齿动物乃至灵长类动物的一种以脑炎、心肌炎或心肌周围炎为主要特征的急性传染病。Maheshwari等[35]在小鼠上注入一个半数致死量的EMCV病毒后,给予氯喹(10、50、100、200 μg)处理,观察14 d以及对小鼠静脉注射10个半数致死量的EMCV感染后加入200 μg的氯喹,观察2 d,发现氯喹明显抑制内源性干扰素的产生;与此同时,氯喹会明显的破坏干扰素的保护作用推测可能与增加病毒的复制有关。
2 负性单链RNA病毒
流行性感冒病毒简称流感病毒,是一种负性单链RNA,属于正粘病毒科。它分为甲(A)、乙(B)、丙(C)三型,人流感主要是甲型流感病毒和乙型流感病毒引起的。甲型流感病毒经常发生抗原变异,可以进一步分为H1N1、H3N2、H5N1和H7N9等亚型(其中的H和N分别代表流感病毒两种表面糖蛋白),这些疫病典型的临床症状是急性高热、全身疼痛、显著乏力和呼吸道症状等[36]。
大量实验表明氯喹在体外有着良好的抗流感病毒作用,在体内几乎无效。Vigerust等[37]的研究表明,20 μg·mL-1氯喹可以在体外感染甲流(H1N1和H3N2)的Madin-Darby犬肾(Madin-Darby canine kidney,MDCK)细胞中,减少病毒的复制;而在体内试验中,使用年龄和体重匹配的8至24周龄雌性BALB/c小鼠建立的感染小鼠模型中测试氯喹,氯喹用量为37.5 mg·(kg·d)-1,对预防或改善小鼠的流感无效。Shibata等[38]的研究发现,100 μg·mL-1氯喹可抑制感染乙型流感的MDCK细胞中病毒的复制。而在Wu等[39]的研究中,浓度为50/100 μmol·L-1的氯喹增强了人肺上皮细胞A549中甲型流感(H1N1)的复制,作者对氯喹作为抗流感药物的有效性提出质疑,并建议谨慎使用。Paton等[40]报道了一项氯喹预防流感的随机双盲试验,在试验中,随机分配(1∶1)健康成年人成氯喹组与安慰剂组。氯喹组接受磷酸氯喹(500 mg·d-1,持续1周,然后每周一次,11周,共12周)的治疗。12周之后进行甲、乙型流感病毒检测,结果显示738名中有29名(4%)在安慰剂组中有实验室确诊的流感感染(有症状或无症状),氯喹组有724名中38名(5%)有流感感染(P=0.261);而在不良反应的报告中,安慰剂组的759名参与者中有249名(33%)报告了不良事件(大部分为轻度),氯喹组中的757名参与者发生了341名(45%)不良事件(P<0.000 1)。在氯喹组中,视力模糊和视力模糊非常常见,但很少导致治疗中断,严重的不良事件肝炎的发生与氯喹有高度相关性。因此氯喹在体外是否能预防流感感染,仍需要进一步的确证。
3 双链RNA病毒
获得性免疫缺陷综合征病毒(human immunodeficiency virus,HIV),即艾滋病毒,它是一种感染人类免疫系统细胞的慢病毒,有两条相同的正链RNA,每条RNA长约9.2~9.8 kb。在体外,氯喹和其类似物羟氯喹在0~12.5 μmol·L-1浓度即具有广谱的抗HIV-1/2活性[41]。氯喹可单独以剂量依赖的方式抑制 HIV 复制和糖基化[42]。氯喹与其他抗反转录病毒药物如齐多夫定,二羟肌苷和羟基脲结合使用还可产生协同抗HIV-1作用,且不会产生细胞毒性[43]。研究发现,氯喹减少HIV-1在CD4+T细胞中的复制和传播,还可以降低HIV-1诱导的CD8+T细胞活化[44]。氯喹还通过阻断TLR刺激和IFN- α产生途径,发挥预防作用。氯喹通过降低下游信号分子IRAK-4和IRF-7的水平以及抑制IFN-α的合成来阻断TLR介导的pDC和MyD88信号的激活[45]。
猕猴HIV模型是临床前评估HIV疗法的重要工具。马建平等[46]在3只感染HIV同源物 SIVmac251的中华猕猴给予氯喹(25 mg·d-1,1个月)。尽管激活的pDC细胞有所减少,但对病毒载量和CD4+和CD8+T细胞激活(以CD38表达测量)没有影响。在一项临床研究中,20名HIV感染者接受了6个月的氯喹(400 mg·d-1,6个月)。结果显示氯喹对免疫激活具有显着影响,血浆脂多糖减少;活化的CD4细胞百分比降低,IL-6和TNF-α的产生减少等。氯喹减少脂多糖/TLR介导的免疫激活,可能对HIV感染的患者有用[47]。
4 双链DNA病毒
4.1 慢性乙型病毒性肝炎(简称慢性乙肝)是一种由乙型肝炎病毒(hepatitis B virus,HBV)感染引起的病毒性肝炎。HBV属于双链环形DNA逆转录病毒。在体外实验中,Accapezzato等[48]在DCs或EBV-B细胞上添加可溶性的抗体物质以及10 μg·mL-1的氯喹,可以显著加快乙肝抗体进入细胞以及提高T细胞的反应性;氯喹可以显著增加细胞对乙肝病毒的清除,并与药物的作用时间呈正相关[49]。体外实验表明,氯喹可能对乙肝患者有一定的治疗作用并可促进乙肝病毒治疗药物的疗效。Zanati等[50]通过在肝纤维患者并发的乙肝患者上,使用氯喹250 mg·d-1,配合泼尼松(40、50、60 mg ·d-1)持续2周,发现氯喹可能通过干扰肝脏中病毒抗原的正常细胞加工来减少受感染肝细胞的溶解,同时与泼尼松配合使用可以增加肝脏细胞中乙肝病毒抗体,从而增加机体对乙肝病毒的清除。另一方面,邢晓燕等[51]将氯喹运用到类风湿性关节炎并发乙肝的患者当中,结果表明沙利度胺联合柳氮磺吡啶、硫酸羟氯喹治疗合并慢性乙型肝炎的类风湿关节炎是一种有效、安全的治疗方案,尤其是轻度慢性乙型肝炎合并类风湿关节炎时,不需要加用抗乙型肝炎病毒药物和保肝药物,患者的肝功能显示出不同程度的改善,但会出现白细胞减少1例,转氨酶升高大于正常3倍及HBV-DNA定量大于1.0×104copies·mL-1各1例等副作用。
4.2 EB病毒(Epstein-Barr virus,EBV)为双链DNA病毒,属于人疱疹病毒γ亚科,可侵袭宿主的B淋巴细胞以及T细胞和NK细胞。EBV感染可导致各种淋巴细胞增殖性疾病,包括非肿瘤性增殖性疾病和肿瘤性疾病。目前,在恶性疟原虫已恢复对氯喹敏感性的非洲地区,氯喹的重新应用试验正在进行中[52]。然而,对于氯喹是否会增加EBV的裂解复制,从而促进Burkitt淋巴瘤的发生,长期以来一直受到关注[53]。有报道称氯喹确实通过连接DNA修复机制和染色质重塑介导的转录抑制来驱动EBV复制[54]。

表1 氯喹抗病毒研究总结
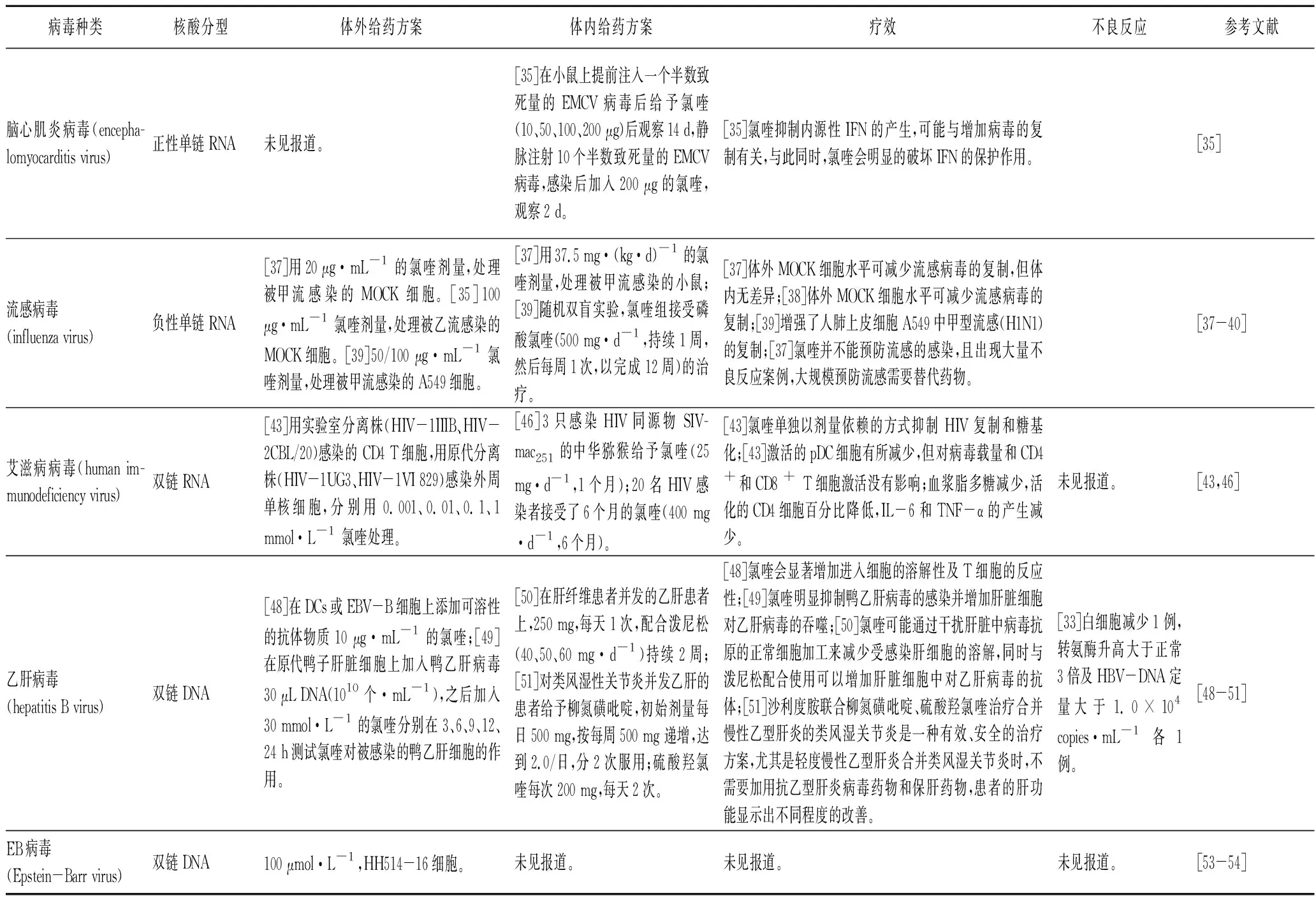
表1(续)
5 讨论
冠状病毒为不分节段的单股正链RNA病毒,长度在26 000到32 000个碱基不等。冠状病毒亚科进一步分为α、β、γ、δ 4种类型。SARS-CoV,MERS-CoV和NCP都属于β型冠状病毒,只感染哺乳动物。目前,冠状病毒已在骆驼、蝙蝠、果子狸、小鼠、狗和猫等宿主中发现。2019年12月下旬,在中国湖北省武汉市的华南海鲜市场发现了几名患有病毒性肺炎的患者,研究者利用下一代测序技术鉴定出一种新的感染人类的新型冠状病毒,已被WHO命名为2019新型冠状病毒(2019 novel coronavirus,COVID-19)[55]。通过对中国武汉地区病毒性肺炎患者的临床样本进行基因组学监测,从9个患者的样本中测序,发现该病毒属于Sarbecovirus亚属。COVID-19与 bat-SL-CoVZC45和 bat-SL-CoVZXC21这两种蝙蝠源冠状病毒毒株相似,同时也与已知的感染人类的冠状病毒相似,与SARS-CoV具有88% 的核苷酸相似[56-57]。体外分离培养时,NPC 96 h左右即可以在人呼吸道上皮细胞内发现。基于SARS-CoV和MERS-CoV,病毒对紫外线和热敏感,56 ℃以及75%的酒精均能有效灭活病毒[58]。
先前的研究发现了几种冠状病毒的结合受体,包括SARS-CoV的ACE2和MERS-CoV的CD26。自2002年SARS-CoV爆发以来,广泛的结构分析揭示了SARS-CoV的S蛋白受体结合域与其宿主受体ACE2之间的相互作用,这种相互作用决定了SARS-CoV的跨物种传播以及人与人之间的传播能力。根据公开的2019-nCoV序列发现其中包含直接接触ACE2的受体结合序列。在Gln493中的几个关键残基与人类ACE2具有良好的相互结合作用,同时Asn501中的几个关键残基也能与ACE2相互结合但效果并不理想。这些分析结果表明NCP和SARS-CoV一样具有跨物种传播以及人际传播能力[59]。因此,尽管NCP受体结合域中存在氨基酸突变,但推测COVID-19依然可能以ACE2作为受体[60]。
目前,尚无对新型冠状病毒的特异性疫苗或特异性治疗药物。根据国家卫建委医政医管局发布的新型冠状病毒感染的肺炎诊疗方案(试行第七版)的相关内容,现阶段主要的治疗方法包括:①一般治疗:对症支持治疗,保证热量及水、电解质平衡,维持内环境稳定,密切监测生命体征及胸部影像学等改变,及时给予有效氧疗措施;②广谱抗病毒药物治疗:目前尚没有确认有效的抗病毒治疗方法,可试用α-干扰素及洛匹那韦/利托那韦、利巴韦林与干扰素或洛匹那韦/利托那韦联合应用等。这些药物的优势在于已知的药代动力学和给药方案,但并没有特异性抗NCP的效果。α-干扰素是一种广谱抗病毒药物,其具有抑制病毒,调节免疫等活性,可用于治疗乙肝病毒。洛匹那韦是一种用于治疗艾滋病毒感染的蛋白酶抑制剂,利托那韦是一种增强剂。相关的给药方案可采用α-干扰素雾化吸入(成人每次500万U或相当剂量,加入灭菌注射用水2 mL,每日2次),洛匹那韦/利托那韦(成人200 mg/50 mg/每粒,每次2粒,每日2次)或利巴韦林(建议与干扰素或洛匹那韦/利托那韦联合应用,成人500 mg/次,每日2至3次静脉输注)[58]。使用同时,要注意药物引起的副反应,如腹泻、恶心、呕吐、肝功能损害等,同时要关注与其他药物的相互作用;③重型及危重型病例的治疗:采取循环支持治疗和并发症的积极防治。根据患者缺氧情况选择合适的氧疗治疗措施,必要时给予气管插管有创呼吸机支持治疗,甚至考虑体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)支持治疗;④其他治疗措施:可根据患者发病程度及胸部影像学进展情况,酌情短期内(3~5 d)应用糖皮质激素[甲泼尼龙,剂量不超过1~2 mg·(kg ·d)-1]。较大剂量糖皮质激素由于免疫抑制作用,会延缓对冠状病毒的清除。对有高炎症反应的危重患者,有条件可以考虑使用体外血液净化技术。各地可根据病情、当地气候特点以及不同体质等情况,采用相关的中医治疗,如可静脉给予血必净、喜炎平、生脉注射液等。亦可加用肠道微生态调节剂,维持肠道微生态平衡,预防继发细菌感染。现有的治疗手段,对于重度及危重患者的疗效并不理想,患者人数越来越多,病死率有的地方超过3%。因出现广泛的人际传播,表现出烈性传染病的特征。严重影响社会的正常运转和极大冲击国民经济的发展。
当前,在加强防疫的同时,迫切需要有效的药物治疗已感染者,提高临床治愈,提高患者出院速度,降低死亡率。筛选现有上市药物显得非常重要,因为药物安全性比较明确,可以直接进入临床Ⅲ期试验,一旦研究成功,可以快速应用到临床实践。
氯喹自1944年以来在临床上广泛使用,有着良好的成药性和药代动力学性质。氯喹在中性pH下不带电荷,口服吸收快,生物利用度高,血药浓度达峰时间为1~2 h,有利于迅速达到治疗靶浓度[61];其次氯喹在人体中分布广泛,血浆结合率为55%,在肺、肝、脾、肾中的浓度高于血浆浓度达200~700倍,其中肺中浓度最高[62-63],可能有利于提高治疗COVID-19引发的呼吸系统感染的靶向性;在药物代谢方面,氯喹半衰期为50 h,代谢后的产物为乙基氯喹及二去乙基氯喹,具有较强的药物活性。其中代谢物去乙基氯喹的抗恶性疟活性强于氯喹[64-65],后遗效应持续数周或数月,药效持久。截至目前,研究人员已评估了氯喹对COVID-19的细胞毒性,病毒产量和感染率的影响。实验结果表明,氯喹在感染COVID-19的 Vero E6细胞的各个阶段均起到一定的作用。除了其抗病毒活性外,氯喹还具有免疫调节活性,可协同增强体内抗病毒作用。氯喹在口服后广泛分布于全身,在肺部的药物浓度最高。氯喹在Vero E6细胞中对COVID-19的EC90值为6.90 μmol·L-1,EC50值为1.13 μmol·L-1。在氯喹浓度高于100 μmol·L-1时仍没观察到细胞毒性,其半数细胞毒性浓度CC50大于100 μmol·L-1,选择性指数SI大于88.5 μmol·L-1[5]。在体外,氯喹在各个疾病领域,包括治疗系统性红斑狼疮和类风湿关节炎中都已证实其低毒性,但仍发现有少数视网膜病变,致命性心肌损伤等不良反应案例,针对氯喹是否能治疗COVID-19仍需要在体内进行进一步试验。
根据氯喹在各大病毒所引起的疾病中的抗病毒作用,我们将氯喹抗病毒的作用机制总结为以下几点:①氯喹会抑制病毒的侵入、复制和释放;②氯喹对包括病毒在内的几种病原体有抑制作用;③氯喹对几种促炎因子的合成具有抑制作用。和大多数病毒感染一样,COVID-19感染的患者也会出现发热、感冒、干咳和肺水肿等发炎现象。而这种现象主要是由于体内TNF-α、IL-6等细胞因子水平急剧升高导致的。研究指出,COVID-19肺炎重症患者与非重症患者相比,重症患者体内TNF-α、IL-2、IL-6、IL-10、MCP-1和MIP1A等细胞因子表达量显著增加[66]。在之前的各种抗病毒实验中发现,氯喹可以显著抑制促炎因子TNF-α、IL-6的产生和释放,这种抗炎作用也可以减少免疫病理性损伤,为患者带来更长的治疗窗口。因此,氯喹在治疗COVID-19肺炎方面具有巨大的潜力。
6 展望
2019新型冠状病毒的治疗迫在眉睫,但目前,还没有一种明确的药物可以进行预防或治疗。现阶段,虽然已知了新型冠状病毒的基因组,但要针对其研发药物耗时较长,难以用于当下的治疗。而我们熟知的广谱抗病毒药物并不能特异性的抗COVID-19。于是,筛选目前化合物库,老药新用成了治疗COVID-19肺炎最好的途径。这些老药拥有已知的药代动力学,毒性与给药方案。只要证明在体外能够有效抑制COVID-19的生长,就能很快地投入到临床Ⅲ期试验中,其风险小,受益大。氯喹是一种已安全使用了70多年的抗疟药物,其性价比高成了抗COVID-19的首要筛选药物。目前的研究已经证实氯喹能够在体外抗NCP,虽然需要更进一步的体内治疗,但它很有可能在临床上适用于对COVID-19肺炎的治疗。最新的报道称,氯喹在临床试验中初步显示对新型冠状病毒肺炎具有一定疗效[67]。我们期待,氯喹在帮助人类战胜COVID-19中发挥更大作用,尽快扑灭COVID-19肺炎,让社会回归正常秩序。

