LC-MS/MS法测定人血浆中格列吡嗪浓度及其控释制剂的生物等效性研究
刘圆圆,徐鲁源,贺美莲
(1.北京大学第一医院药剂科,北京 100034;2.国药控股山东有限公司,山东 济南 250001;3.山东省食品药品检验研究院,山东 济南 250101)
格列吡嗪是常用的第二代磺酰脲类降糖药,主要用于饮食控制效果不良的轻、中度2型糖尿病患者。其作用机制是刺激胰岛的β细胞分泌胰岛素,从而降低血糖水平。格列吡嗪与第一代磺酰脲类降糖药相比,与剂量相关的副作用如头痛,恶心,疲劳等有所减少[1-2]。格列吡嗪作为2型糖尿病治疗的一线药物,其控释制剂的作用时间延长,具有良好的降低空腹与餐后血糖的效果[3-4]。现有的测定生物基质中格列吡嗪浓度的方法有高效液相色谱-紫外检测(HPLC-UV)[5]、液相色谱-串联质谱(LC-MS/MS)[6-8]。其中LC-MS/MS法具有灵敏度高、快速、前处理简便的优势,成为生物等效性研究的常用方法。故本研究在此基础上,建立了测定人血浆中格列吡嗪浓度的LC-MS/MS方法,并采用单剂量、两周期、两序列、交叉的试验设计,对24名健康受试者分别进行空腹及高脂餐后的生物等效性预试验,考察其药代动力学过程,以期为正式的生物等效性试验提供数据参考。
1 仪器与试药
高效液相色谱质谱联用仪(AB SCIEX Triple Quad 5500);格列吡嗪标准品(99.7%,批号:100281-201604,中检院);格列吡嗪-d11(化学纯度:98%,同位素内标纯度:97.6%,批号:7-SDJ-115-1,TRC)。甲醇、乙腈、甲酸、N,N-二甲基甲酰胺(DMF)(色谱纯);超纯水。受试制剂:格列吡嗪控释片(5 mg/片),参比制剂:格列吡嗪控释片(5 mg/片,Pfizer Pharmaceuticals LLC)。
2 方法与结果
2.1 色谱条件 Phenomenex Kinetex C18色谱柱 (2.1 mm×50 mm,2.6 μm),柱温45 ℃,流动相A为0.1%甲酸水,流动相B为纯乙腈,流速0.6 mL·min-1,梯度洗脱程序见表1。
2.2 质谱条件 电离方式:电喷雾离子源(ESI),正离子模式;离子源温度:550 ℃ ;检测模式:多反应监测(MRM)模式;离子化电压:5 500 V ;入口电压(EP):10 V;碰撞室出口电压(CXP):29 V。监测离子对:格列吡嗪:446.1/321.1,喷撞能量(CE):19 V,去簇电压(DP):136 V ;格列吡嗪-d11:457.1/321.1,CE:21 V,DP:136 V。

表1 梯度洗脱程序
2.3 标准溶液的配制 准确称取格列吡嗪标准品适量,用DMF溶解成质量浓度为 1.0 mg·mL-1的对照品储备液。准确移取适量对照品储备液,用50%乙腈水溶液稀释,配制成质量浓度分别为40、80、400、1 000、2 000、3 000、5 000、6 000 ng·mL-1的标准曲线工作溶液和质量浓度分别为40、120、800、4 000 ng·mL-1的质控样品工作溶液。准确称取格列吡嗪-d11标准品适量,用DMF溶解成质量浓度为1.0 mg·mL-1的内标储备液,用乙腈将内标储备液稀释至20 ng·mL-1,作为内标工作溶液。
2.4 样品预处理 精密移取100 μL血浆样品,加入400 μL内标工作溶液(20 ng·mL-1格列吡嗪-d11)沉淀蛋白,然后涡旋混匀5 min,在4 ℃的台式高速冷冻离心机中,4 750 rpm离心10 min ,取上清液100 μL,并加入10%乙腈水100 μL稀释,涡旋混匀5 min,进样测定。
2.5 方法学验证
2.5.1 标准曲线与残留 准确移取空白血浆285 μL, 加入 15 μL格列吡嗪标准曲线工作溶液,使样品中格列吡嗪的质量浓度分别为2、4、20、50、100、150、250、300 ng·mL-1。按“2.4”项下所述进行样品处理,采用LC-MS/MS 方法测定,记录色谱图。以分析物的浓度为横坐标(X),以分析物与内标的色谱峰面积比值为纵坐标(Y),用加权(W=1/X2)最小二乘法进行线性回归,得到的标准曲线为:Y=0.010 25X-0.001 72(r2=0.999 0,n=8),结果显示格列吡嗪血药浓度在2~300 ng·mL-1范围内线性关系良好,定量下限为2 ng·mL-1。
图1中a为格列吡嗪在定量下限处的选择离子色谱图,保留时间为 0.36 min,峰形与分离度良好。在同样的保留时间处,空白血浆样品色谱图(见图1b)中没有干扰峰出现,显示该方法的残留很小,不会对分析物及内标的定量造成干扰。
2.5.2 准确度与精密度 质控样品的制备、处理及测定与标准曲线样品相同,质量浓度分别为2、6、40、200 ng·mL-1,表示为LLOQ、LQC、MQC和HQC。共测定3个分析批,每一浓度取6份样品分析。结果显示批内准确度为 95.0%~106.5%,批间准确度为99.5%~102.2%,批内精密度均小于7.0%,批间精密度均小于5.0% (见表 2)。试验结果显示该方法精密度,准确度良好。
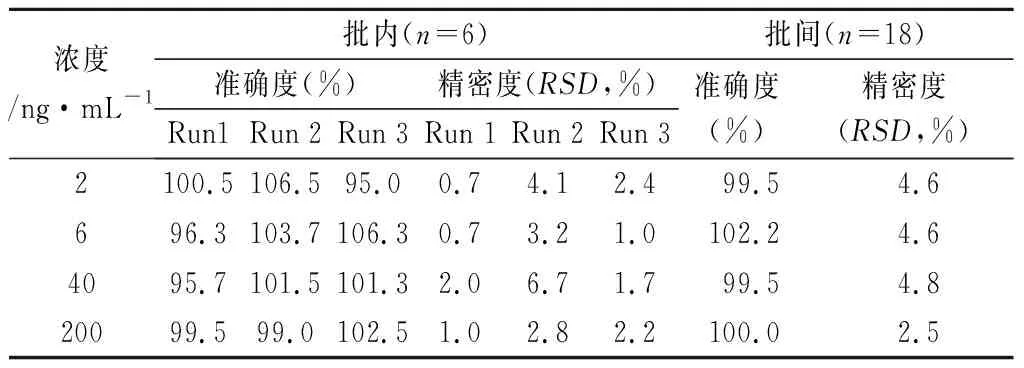
表2 准确度与精密度
2.5.3 选择性、基质效应和提取回收率 选择性需要考察6批不同来源的空白血浆,分别配制成空白样品以及定量下限浓度的样品进行比较。结果显示6批空白血浆中干扰组分的响应均为0,血浆的内源性组分未造成干扰。由这6批空白血浆预处理后得到上清液加入适当浓度的工作溶液配制成基质效应样品,与相同浓度的纯溶液样品进行比较,由二者的峰面积比值来计算,分析物的基质因子为98.5%,内标的基质因子为96.5%。提取回收率考察LQC,MQC和HQC 3 个浓度的质控样品,然后再取空白血浆预处理后加入适当浓度工作溶液配得同浓度的样品,二者峰面积的比值即为提取回收率。结果表明,分析物的回收率为107.4%,内标的回收率为113.4%。
2.5.4 稳定性 首先考察了对照品和内标的储备液和工作溶液在室温放置12 h的稳定性。然后,配制LQC和HQC样品各 3 份,分别考察其在自动进样器中的稳定性、血浆样品5次冻融循环的稳定性以及室温放置27 h的稳定性。根据新鲜制备的标准曲线分析上述条件下的样品,将测得浓度与理论浓度相比较,结果显示准确度偏差均在15%范围内,说明格列吡嗪在上述条件下均能保持良好的稳定性。
2.6 生物等效性研究 招募24名健康成年受试者,身体质量指数(BMI)在19~26 kg·m-2。受试者在试验前均通过既往史、体格检查和实验室检查(包括血生化、血常规、尿常规、传染性疾病筛查、心电图、胸片及试验相关各项检查)。所有受试者均为自愿参加本次试验,理解研究程序与风险且已签署知情同意书。
本研究采用单中心、开放、随机、单剂量、两周期、两序列、交叉的试验设计,考察空腹和餐后两种条件下(各12名受试者)的生物等效性。采用SAS9.4软件将受试者随机分为两组,每组6人。空腹试验中,保证受试者给药前禁食不禁水至少10 h。第1周期6例受试者在给药当天早晨空腹状态下口服受试制剂格列吡嗪控释片5 mg,另6例受试者则口服参比制剂格列吡嗪控释片5 mg,7 d的清洗期后交叉给药进行第2周期研究。餐后试验中,保证受试者给药前禁食不禁水至少10 h,于次日晨进食高脂餐,30 min内进食完毕,然后口服受试制剂或参比制剂。试验分别于给药前0 h和给药后1、2、3、4、6、8、9、10、12、14、16、24、28、32、36、48 h共17个采血点分别抽取静脉血4 mL,用于血药浓度测定。
使用WinNonlin 6.4软件以非房室模型处理血药浓度数据并估算药动学参数,包括:Cmax、AUC0~t、AUC0~∞、Tmax、t1/2等。主要药动学参数(Cmax,AUC)经对数转换后以多因素方差分析(ANOVA)进行显著性检验,然后用双向单侧t检验和计算90%置信区间的统计分析方法来评价和判断受试制剂和参比制剂之间的生物等效性。空腹和餐后条件下两制剂的主要药动学参数见表3,平均药时曲线见图2。
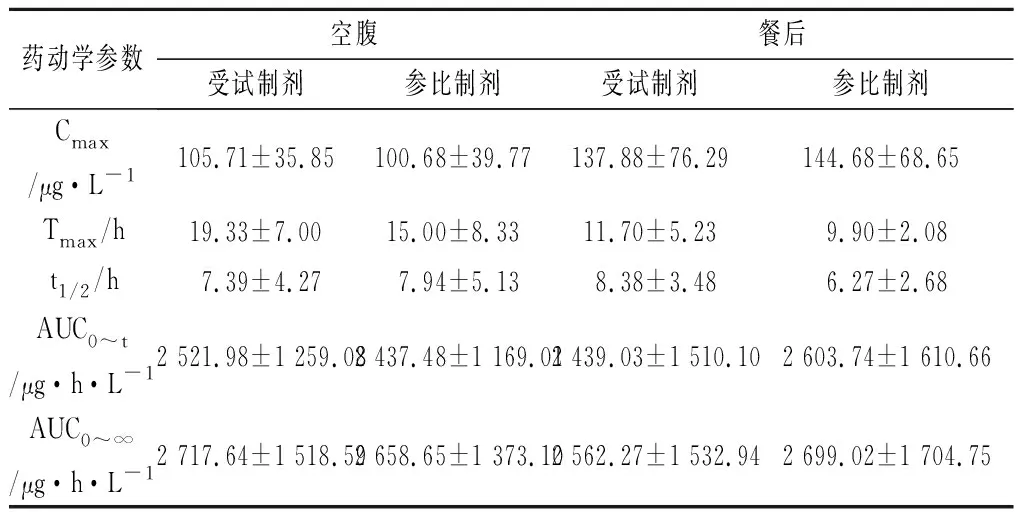
表3 受试制剂与参比制剂的主要药动学参数比较(n=12)
空腹给药试验结果显示,受试制剂Cmax、AUC0-t、AUC0~∞的90%置信区间分别为参比制剂相应参数的91.82%~111.81%、83.98%~122.10%、85.73%~124.83%,均在80.00%~125.00%以内,说明格列吡嗪控释片受试制剂与参比制剂在空腹给药时具有生物等效性。餐后给药试验结果显示,受试制剂Cmax、AUC0~t、AUC0~∞的90%置信区间分别为参比制剂相应参数的82.03%~106.76%、81.43%~117.32%、83.35%~119.07%,均在80.00%~125.00%以内,说明格列吡嗪控释片受试制剂与参比制剂在餐后给药时也具有生物等效性。综上所述,格列吡嗪这两种片剂在空腹和餐后条件下均具有生物等效性。
3 结论
本文建立了快速、灵敏的LC-MS/MS方法用于测定人血浆中的格列吡嗪浓度,并将其应用于人体生物等效性预试验。在试验过程中,受试者均未有临床意义的药物不良反应出现。在空腹和餐后给药条件下,受试制剂与参比制剂在吸收程度和代谢速度上无显著性差异,生物学等效。同时,由表3和图2可见,餐后给药与空腹给药相比,Cmax更大,而Tmax更小,说明高脂餐后给药对格列吡嗪的吸收、分布有一定影响。该结果可为格列吡嗪的临床合理用药提供参考依据。另外,依据此次生物等效性预试验的结果,发现该试验方案的采样时间、采样量、时间间隔等设计较为合理,具有较强的适用性。本试验为格列吡嗪控释剂的生物等效性研究提供了数据参考,为正式试验奠定了基础。

