茯苓多糖对复发性流产小鼠细胞免疫及妊娠结局的影响
叶彬彬 黄维洁
浙江省温州市中西医结合医院(325000)
复发性流产(RSA)是一个多因素疾病,多数致病原因未知[1]。迄今为止,关于RSA的研究方向主要集中在免疫反应和炎症介质有关的遗传和表观遗传多态性上,并在反复流产和免疫机制之间产生了重要联系[2-3]。异常的免疫学机制可能导致反复流产[4]。茯苓多糖是茯苓的主要成分之一,对免疫功能具有调节作用。茯苓是临床治疗RSA方剂的常用药物,但茯苓多糖成分对RSA的治疗作用及其机制尚不完善[5-6]。辅助性T淋巴细胞(Th细胞)和调节性T淋巴细胞(Treg细胞)在人类免疫调节中起关键作用,与是否成功受孕相关[7]。本研究通过建立RSA小鼠模型,分析茯苓多糖对RSA小鼠妊娠结局及Th细胞/Treg细胞免疫平衡调节的影响,初步探究茯苓多糖对RSA的治疗机制。
1 材料与方法
1.1 主要材料
1.1.1实验动物雌性CBA/J小鼠,未产;雄性DBA/2小鼠,雄性BALB/c小鼠,SPF级,体质量20~22 g,鼠龄7周,购自上海睿太莫斯生物科技有限公司,许可证号SCXK(沪)2016-0001。经本院动物伦理委员会批准,并遵守3R保护原则进行实验。
1.1.2药品与试剂茯苓多糖(REL-FLDT30)由西安瑞尔丽生物工程有限公司生产;小鼠白细胞介素22(IL-22)(SEKM-0023)、小鼠IL-17(SEKM-0018)、IL-10(SEKM-0010)、TGF-β(SEKR-0012)试剂盒购自北京Solarbio公司;CD4(46-0041-82)、CD25(17-0251-82)、IL-17(12-7177-81)和Foxp3(12-5773-82)抗体购自美国Thermo Fisher Scientific公司。
1.1.3主要仪器CX41型生物显微镜由日本Olympus公司生产;CytoFLEX型流式细胞仪由美国BioRad公司生产。
1.2 实验方法
1.2.1动物模型制备、分组及给药将购买的小鼠适应性饲养1周后,观察无异常表现后入组。参考建模方法[8],分别取雌性CBA/J小鼠与雄性DBA/2小鼠或BALB/c小鼠按照2:1比例合笼交配,建立CBA/J+DBA/2复发性流产模型和CBA/J+BALB/c正常妊娠模型,以检出阴栓当天(第0天)计为妊娠受孕。将CBA/J+BALB/c正常妊娠模型小鼠设置为对照组(n=10),CBA/J+DBA/2 RSA造模成功小鼠随机分为模型组(n=10)、茯苓多糖低剂量组(n=11)、中剂量组(n=10)、高剂量组(n=11)和阳性对照组(n=10)。妊娠第1天,给予对照组和模型组等量蒸馏水灌胃处理,茯苓多糖低、中、高组和阳性对照组分别给予蒸馏水溶解的50、100、200 mg茯苓多糖、156 mg/kg黄体酮胶囊灌胃处理,灌胃体积0.1 ml/10 g,每天1次,连续16d。
1.2.2RSA小鼠妊娠结局观察末次给药4 h后,称重各组小鼠,麻醉后采用颈椎脱臼法处死各组小鼠,打开腹部,暴露子宫,记录胚胎着床数目以及吸收数目,计算胚胎丢失率,胚胎丢失率=丢失胚胎数/(丢失胚胎数+存活胚胎数)。清除子宫组织中胚胎及脂肪组织等,清洗后,滤纸吸干保存于-80℃中。同时观察子宫生长情况。无菌条件下收集各组小鼠脾脏、胸腺组织,-80℃保存用于后续实验。
1.2.3RSA小鼠脾脏和胸腺指数检测将上述保存的小鼠脾脏、胸腺组织,洗涤后滤纸吸干,称重,计算脾脏和胸腺指数。脏器指数=脏器重量/体重。
1.2.4RSA小鼠子宫组织Th17、Treg细胞检测将上述收集的子宫组织研磨,IV型胶原酶消化过滤后制成1×107个/ml单细胞悬液,取100 μl加入一抗CD4、IL17、CD25和FOXP3反应30 min.,经PBS清洗、离心、弃上清后,添加500 μl PBS充分混匀,流式细胞仪上检测CD4+和IL17+双阳性细胞即为Th17细胞,CD4+、CD25+和FOXP3+阳性细胞为Treg细胞,计算Th17/Treg细胞比值。
1.2.5RSA小鼠子宫组织CD4+、CD8+T淋巴细胞检测取100 μl 上述制备的子宫组织单细胞悬液,加入一抗CD3、CD4和CD8染色30 min,经PBS清洗、离心、弃上清后,添加500 μl PBS充分混匀,流式细胞仪上检测CD4+、CD8+T淋巴细胞百分比。
1.2.6RSA小鼠子宫组织IL-17、IL-22、IL-10和TGF-β表达检测另取上述子宫组织研磨,PBS匀浆后离心,弃上清液,按IL-17、IL-22、IL-10和TGF-β试剂盒说明书,检测各组小鼠上述因子。
1.3 统计学方法
2 结果
2.1 各组小鼠妊娠情况
小鼠胚胎丢失率,对照组最低(4.21±0.13)%,模型组最高(57.36±6.20)%;茯苓多糖低(40.83±7.22)%、中(28.69±6.06)%、高剂量组(10.35±3.17)%依次降低,阳性对照组降低(16.33±4.72)%,均P<0.05。
2.2 各组小鼠脾脏和胸腺指数
小鼠脾脏和胸腺指数,模型组RSA均低于对照组;与模型组相比,茯苓多糖低、中、高剂量组RSA小鼠脾脏和胸腺指数依次升高,阳性对照组升高(均P<0.05),见表1。
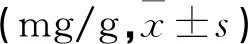
表1 各组小鼠脾脏和胸腺指数比较
2.3 各组小鼠子宫组织Th17、Treg细胞值
与对照组相比,模型组小鼠子宫组织Th17细胞比例、Th17/Treg比值均升高,Treg细胞比例降低(P<0.05);与模型组相比,茯苓多糖低、中和高剂量组RSA小鼠子宫组织Th17细胞比例、Th17/Treg比值依次降低,Treg细胞比例依次升高(均P<0.05),阳性对照组上述指标变化趋势与茯苓多糖各组一致。见图1、图2,表2。

图1 各组小鼠子宫组织Th17细胞比例
图2 各组小鼠子宫组织Treg细胞比例

表2 各组小鼠子宫组织Th17、Treg细胞比例及Th17/Treg比较
2.4 各组小鼠子宫组织中免疫因子表达
与对照组相比,模型组小鼠IL-17和IL-22表达升高,IL-10和TGF-β表达降低(P<0.05);与模型组相比,茯苓多糖低、中和高剂量组小鼠IL-17和IL-22表达依次降低,IL-10和TGF-β表达依次升高(均P<0.05),阳性对照组与上述各指标变化趋势与茯苓多糖各剂量组一致。见表3。
表3 各组小鼠子宫组织免疫因子水平表达比较
2.5 各组小鼠子宫组织CD4+、CD8+T淋巴细胞
与对照组相比,模型组小鼠子宫组织CD4+数量、CD4+/CD8+比值降低,CD8+数量升高(P<0.05);与模型组相比,茯苓多糖低、中和高剂量组RSA小鼠子宫组织CD4+数量、CD4+/CD8+比值依次升高,CD8+数量依次降低(均P<0.05),阳性对照组上述指标变化趋势与茯苓多糖各组一致。见表4。

表4 各组RSA小鼠子宫组织淋巴细胞比较
3 讨论
RSA致病原因复杂且较少循证诊断策略,至今病因尚无明确说法[9]。雌性CBA/J小鼠与雄性DBA/2小鼠交配是目前国际公认的RSA模型经典方法,其胚胎丢失率高于正常妊娠小鼠[10]。本研究结果显示,模型组小鼠胚胎吸收率均显著高于对照组,提示建模成功。
胸腺和脾脏指数是衡量机体免疫功能的重要指标[11]。本研究发现,模型组小鼠的胸腺和脾脏指数均显著降低,初步判断RSA可能导致小鼠整体免疫力下降。茯苓多糖具有降血糖、抗肿瘤、消炎和增强免疫力等药理功效[12]。刘坤等[13]发现,茯苓多糖可以增强小鼠的抗原特异性体液免疫反应。本研究给予RSA小鼠茯苓多糖治疗,胚胎丢失率呈剂量依赖性减少,胸腺和脾脏指数显著增加,提示茯苓多糖可能通过调节RSA小鼠的免疫功能,改善妊娠结局。原始CD4+细胞可以分化为包括Th1、Th2、Th17和Treg细胞的T细胞, CD4+T细胞及其相关的细胞因子在母胎免疫调节中起重要作用,其中Th17/Treg细胞比例失衡被认为是RSA的原因[14-15],因此推测茯苓多糖对RSA妊娠结局的保护作用可能与Th17/Treg细胞相关,但仍待进一步验证。
Th17细胞属于CD4+T淋巴细胞的Th亚型,能够产生IL-17和IL-22炎性因子,募集中性粒细胞,引起自身免疫和炎症反应[16]。相比之下,Treg细胞可以产生抗炎细胞因子IL-10和TGF-β,抑制免疫细胞活性及免疫反应,维持免疫稳态[17]。妊娠期间,Th17比率下降有利于抑制母体免疫排斥提高妊娠率,反之增加流产风险[18]。此外,CD4+ CD25+Foxp3+ Treg细胞对于胎儿免疫耐受性至关重要[19]。本研究结果显示,与对照组相比,模型组RSA小鼠Th17细胞比率以及炎症因子IL-17和IL-22表达显著升高,Treg细胞比例及炎症因子IL-10和TGF-β表达显著降低,Th17/Treg值显著升高,提示导致RSA小鼠妊娠结局不良的原因可能与Th17/Treg免疫失衡有关。给予茯苓多糖治疗后,上述各指标得到显著改善,Th17/Treg值呈剂量依赖降低,提示茯苓多糖能够减缓RSA小鼠子宫组织中Th17/Treg稳态失调。王慧莲等[20]研究发现,茯苓多糖能够通过提高系统性红斑狼疮患者体内Treg并降低Th17细胞比例,达到治疗效果,因此推测茯苓多糖可能通过调节RSA小鼠体内Th17/Treg平衡,发挥妊娠保护作用。此外,CD8+是另一种重要的T淋巴细胞亚群,CD4+/CD8+细胞比例异常也导致RSA发生[21]。本研究初步发现,茯苓多糖治疗后,RSA小鼠子宫组织CD4+/CD8+细胞失衡得到缓解,提示茯苓多糖可能对子宫组织周围CD4+/CD8+免疫细胞异常具有调节作用。
综上所述,茯苓多糖对RSA小鼠的妊娠结局具有保护作用,可能与调节Th17/Treg、CD4+/CD8+免疫失衡有关,这可能为茯苓多糖治疗RSA的潜在机制。然而成功妊娠涉及孕妇的生理变化以及胎儿和母亲之间细胞因子、血管生成介质和激素复杂相互作用,同时RSA涉及的免疫因素比较复杂,因此需联合临床试验更深入地探索其机制。

