冠状动脉粥样硬化性心脏病合并慢性肾病与慢性炎症因子的关系探讨
冠状动脉粥样硬化性心脏病简称冠心病(CHD),对人类健康有重大影响,年龄55岁以上男性和女性终身患病风险为67%[1]。随着肾功能下降,心血管事件发生风险增加。有研究表明,肾功能下降是心血管疾病发展的独立危险因素。与无慢性肾病(CKD)的CHD病人相比,合并CKD的CHD病人预后不良。CHD重要的病理基础是动脉粥样硬化(AS),它是一种炎症性疾病,炎症细胞在其发生发展过程中发挥关键性作用。32项前瞻性研究包括79 036例病人的荟萃分析,包括无血管疾病、稳定血管疾病和急性血管疾病30 d病人,结果显示脂蛋白磷脂酶A2(Lp-PLA2)水平与CHD和心血管疾病死亡率呈线性相关[2]。CKD是一种炎性疾病,病人有较高的炎性细胞因子生成[3-4]。有研究表明,CKD病人Lp-PLA2浓度和活性明显高于健康人[5]。超敏C反应蛋白(hs-CRP)和同型半胱氨酸(Hcy)是炎症反应的关键因素,与炎症反应程度密切相关。本研究探讨hs-CRP、Hcy、Lp-PLA2炎性因子与CHD合并CKD病人之间的关系,为改善CHD合并CKD病人预后提供研究方向。
1 资料与方法
1.1 研究对象 选取2016年9月—2017年11月于山西省人民医院心内科住院确诊为CHD病人286例,分为CHD组202例,其中男97例,女105例,年龄(66.43±8.48)岁;CHD合并CKD组84例,其中男40例,女44例,年龄(68.92±9.28)岁。
1.2 纳入与排除标准 CHD诊断标准:采用Judkin′s法进行冠状动脉造影,左主干、左前降支、左回旋支、右冠状动脉及主要分支,有一支直径狭窄≥50%即可诊断。CKD是指肾损伤(>3个月),显示肾脏结构或功能异常,肾小球滤过率下降或不下降;肾损伤表现为病理学检查异常或肾损害体征(包括异常的血液和尿液检查或影像学检查异常);肾小球滤过率<60 mL/(min·1.73 m2)超过3个月,无论是否有肾脏损伤的证据。排除标准:心内膜炎、心肌炎、肝病、急慢性感染、肿瘤等。
1.3 研究方法 收集受试者相关病史,抽取入院次日清晨空腹静脉血,检测指标包括血脂、尿酸、hs-CRP、Lp-PLA2、Hcy水平。

2 结 果
2.1 两组一般资料比较(见表1)

表1 两组一般资料比较 单位:例
注:两组各项比较,P>0.05。
2.2 两组临床资料比较 两组年龄、体质指数(BMI)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、血糖(GLU)、血尿酸水平比较,差异无统计学意义(P>0.05)。CHD合并CKD组血清hs-CRP、Lp-PLA2和Hcy水平显著高于CHD组(P<0.05)。详见表2。

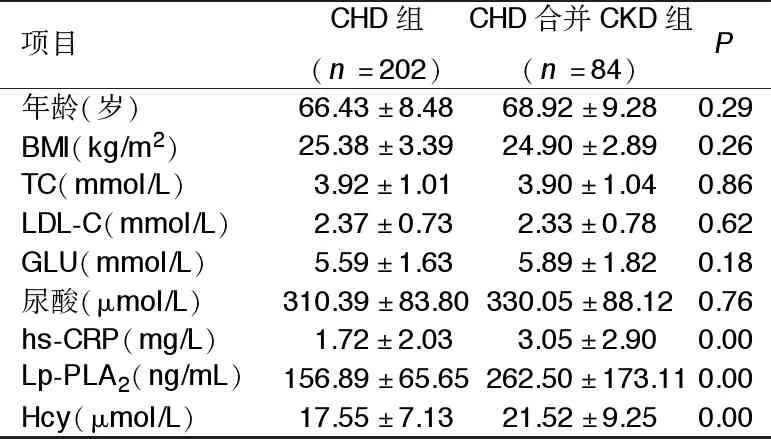
项目CHD组(n=202)CHD合并CKD组(n=84)P年龄(岁)66.43±8.4868.92±9.280.29BMI(kg/m2)25.38±3.3924.90±2.890.26TC(mmol/L)3.92±1.013.90±1.040.86LDL-C(mmol/L)2.37±0.732.33±0.780.62GLU(mmol/L)5.59±1.635.89±1.820.18尿酸(μmol/L)310.39±83.80330.05±88.120.76hs-CRP(mg/L)1.72±2.033.05±2.900.00Lp-PLA2(ng/mL)156.89±65.65262.50±173.110.00Hcy(μmol/L)17.55±7.1321.52±9.250.00
2.3 CHD合并CKD影响因素的分析 多因素Logistic回归分析结果显示,hs-CRP、Lp-PLA2和Hcy是CHD合并CKD的危险因素(P<0.05)。详见表3。
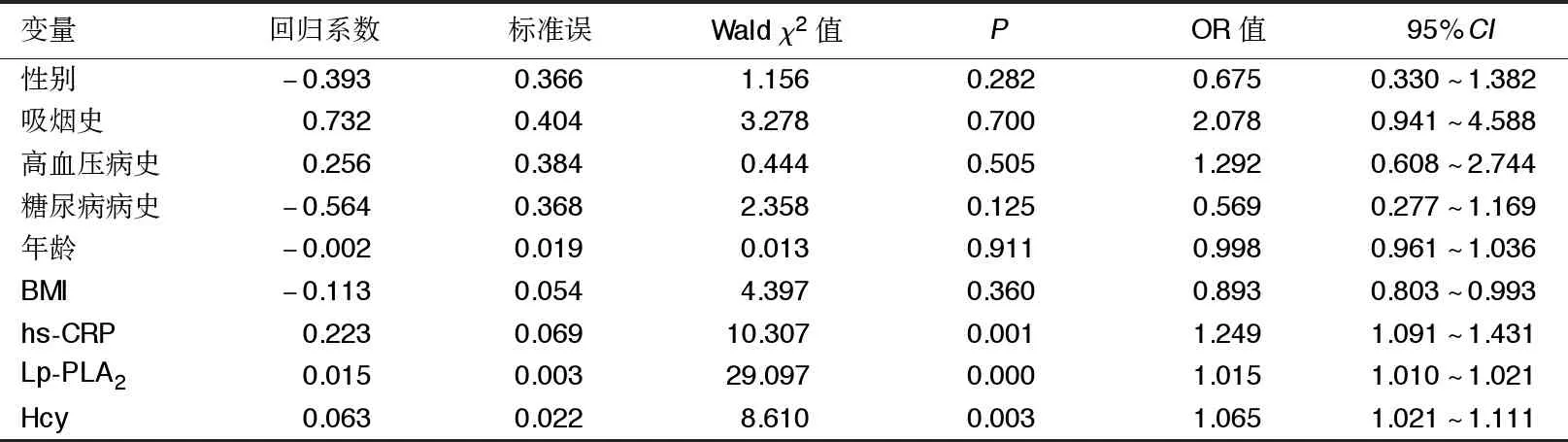
表3 CHD合并CKD影响因素的Logistic回归分析
2.4 ROC曲线分析预测CHD的诊断价值 hs-CRP预测CHD病人发生CKD的诊断临界值为1.065 mg/L,灵敏度为97.6%,特异度为56.4%;Lp-PLA2预测CHD病人发生CKD的诊断临界值为257.770 ng/mL,灵敏度为39.3%,特异度为97.0%;Hcy预测CHD病人发生CKD的诊断临界值为17.450 μmol/L,灵敏度为65.5%,特异度为61.9%。详见表4。hs-CRP、Lp-PLA2、Hcy的AUC分别为0.749、0.757、0.644(见图1),表明三者可预测CHD合并CKD。
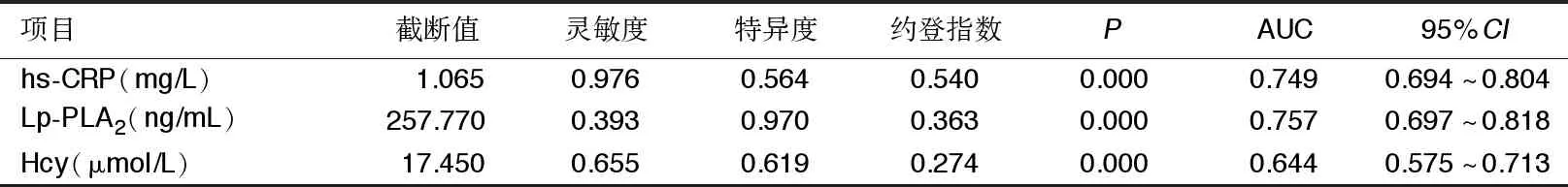
表4 各指标ROC生存曲线分析结果
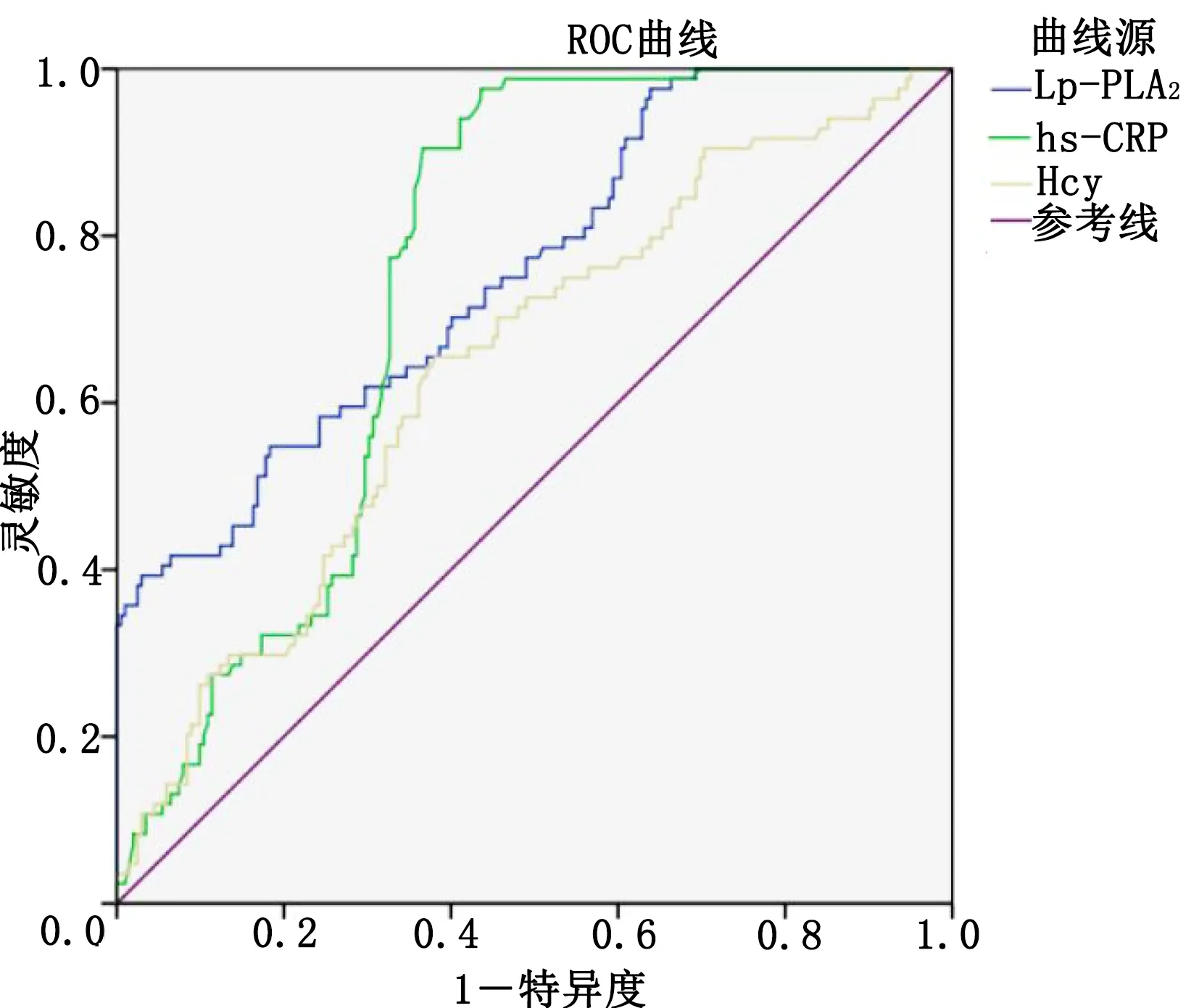
图1 血清Lp-PLA2、hs-CRP和Hcy预测CHD的ROC曲线
3 讨 论
CHD的重要病理基础是AS,在炎症反应中起重要作用。hs-CRP是由肝细胞分泌的非特异性急性时相蛋白,是目前临床常用的血清炎症标记物。近年来,有研究发现在CHD的发生发展中,hs-CRP作为炎症标记物,是CHD发生的独立危险因素。有研究发现,CKD病人心血管并发症患病率逐渐增加[6]。本研究结果显示,CHD合并CKD组hs-CRP水平较CHD组明显升高;Logistic 回归分析结果显示,hs-CRP是CHD合并CKD的危险因素。hs-CRP预测CHD病人发生CKD有一定的诊断价值,其灵敏度较高,但特异度偏低。
Lp-PLA2是磷脂酶家族的亚型,也称为血小板活化因子乙酰水解酶(PAF-AH),是非Ca2+依赖性酶,由巨噬细胞、T细胞和肥大细胞分泌,可水解氧化磷脂的氧化低密度脂蛋白产生脂质炎性物质,如溶血磷脂酰胆碱和氧化游离脂肪酸,从而产生多种动脉粥样硬化作用,包括内皮细胞和内皮细胞死亡、功能障碍,促进黏附因子和细胞因子的产生。这些物质进一步产生自我强化的循环,由炎症细胞的趋化作用产生较多的促炎物质[7]。相关研究表明,CKD组Lp-PLA2浓度和活性均显著高于健康对照组[5]。本研究结果显示,CHD合并CKD组Lp-PLA2水平明显高于CHD组;Logistic回归分析结果显示,Lp-PLA2是CHD合并CKD的危险因素。Lp-PLA2预测CHD病人发生CKD有一定的诊断价值,其特异度较高,但灵敏度偏低。
Hcy是甲硫氨酸甲基化产生的细胞毒性含硫氨基酸。有研究表明,Hcy是心血管疾病发生的独立危险因素,血清Hcy水平与心血管疾病严重程度呈正相关[8]。血清Hcy水平可作为监测老年CKD发生、发展的一个重要指标[9]。本研究结果显示,CHD合并CKD组Hcy水平较CHD组升高;Logistic回归分析结果显示,Hcy是CHD合并CKD的危险因素。Hcy预测CHD病人发生CKD有一定的诊断价值,但其特异度及灵敏度均偏低。
本研究结果证实炎症因子与CHD和CKD的相关性,提示Lp-PLA2和hs-CRP可作为心血管损害的预测因子,其具体机制仍需进一步深入研究。

