BAPN联合Ang-Ⅱ腹腔注射建立小鼠主动脉夹层模型
主动脉夹层(aortic dissection)是最常见、最凶险的急性主动脉综合征[1-2],起病急骤,可在短期内引起主动脉破裂而致死,其发病率为每年6/10万人,平均发病年龄为63岁,男性较女性更易患病,且逐年呈上升趋势,21%病人入院前死亡,68.2%病人入院48 h内死亡,1周内病死率高达90%[3]。主动脉夹层常见的病理特征包括白细胞浸润和结构性细胞外基质(ECM)重塑[4-5],血管炎症是常见的致病因素[6-7]。在主动脉重塑扩张过程中,中膜完整性被破坏是导致急性主动脉夹层或破裂高发病率和死亡率的重要原因。目前迫切需要对主动脉夹层发病机制和干预策略进行研究,然而由于主动脉夹层发生发展过程的不同时期机体组织标本难以获得,因此,建立模拟主动脉夹层发生病理变化及可靠的、重复性好的动物模型尤为关键。
血管紧张素Ⅱ(angiotensin Ⅱ,Ang-Ⅱ)是肾素-血管紧张素-醛固酮系统的主要效应肽,短时间内引起血管收缩、提高血压、增加血流对血管壁冲击[8];诱导血管平滑肌细胞(VSMC)过度肥大、细胞外基质过度分泌,导致炎性细胞浸润,破坏血管,诱导主动脉夹层形成[9]。Tieu等[10]报道,选用7~30周龄的雄性C57BL/6小鼠,微泵灌注Ang-Ⅱ,其主动脉夹层发生率分别为23%和25%。β-氨基丙腈(β-aminopropionitrile,BAPN)通过抑制胶原纤维交联诱导主动脉夹层,使用含0.25%BAPN饲料饲养小鼠,建立主动脉夹层模型,发生率为64.7%[11]。C57BL/6小鼠为心血管疾病发病机制研究的常用实验小鼠,因此,本研究采用给予C57BL/6小鼠Ang-Ⅱ及BAPN联合腹腔注射建立主动脉夹层模型,探索一种模拟主动脉夹层发生病理变化及可靠的、重复性好的主动脉夹层动物模型新方法。
1 材料与方法
1.1 实验动物 清洁级雄性C57BL/6小鼠40只(山西医科大学实验动物中心提供),动物合格证编号SXYK(晋)2015-0001,体重(19.50±0.42)g,鼠龄6~8周。将小鼠随机分为4组:BAPN组[BAPN 0.1 g/(kg·d)]、Ang-Ⅱ组[Ang-Ⅱ12 mg/(kg·d)]、BAPN+Ang-Ⅱ组[BAPN 0.1 g/(kg·d)+Ang-Ⅱ 12 mg/(kg·d)]和对照组(生理盐水),均采用腹腔注射。建立主动脉夹层小鼠模型,每日按实验方法对不同组别小鼠给予相应处理,时间为2周,每8 h观察1次小鼠,每2 d记录1次体重,直至实验结束。若发现有小鼠死亡,随即取出解剖,探查死亡原因。
1.2 主要试剂、材料与仪器 Ang-Ⅱ购自美国Sigma公司,BAPN购自美国Alfa Aesar公司;苏木素、伊红购自北京中杉金桥生物技术有限公司;多聚甲醛、无水乙醇、二甲苯购自上海生工生物工程有限公司;ASP6025型脱水机,德国Leica生产;5235型石蜡包埋机,日本Sakura生产;RM2016,德国Leica生产;CP225D电子分析天平,德国Sartorius公司生产;Scope A1型显微成像系统,德国ZISS公司生产。
1.3 实验方法
1.3.1 药物配制 将BAPN粉末溶于无菌生理盐水中,小鼠BAPN剂量为每日0.1 g/kg。每两天配制1次新溶液,以锡箔纸包裹(BAPN见光易分解)。Ang-Ⅱ粉末溶于无菌生理盐水中,小鼠Ang-Ⅱ剂量为每次4.0 mg/kg,每日3次,间隔8 h。
1.3.2 小鼠一般情况及血管形态观察 每日观察小鼠精神状态和进食情况;每2 d称重1次。发现死亡小鼠,立即解剖,观察死亡原因,摘取主动脉,用4%多聚甲醛固定。待实验结束时,对仍未死亡小鼠,给予过量戊巴比妥钠处死,显微镜下分离主动脉,从主动脉根部剥离动脉至髂动脉分支处,小心去除动脉外膜的疏松结缔组织,观察夹层形成情况。计算小鼠主动脉夹层发生率和死亡率。
1.3.3 病理切片制备 以4%多聚甲醛灌流固定主动脉组织,再常规浸泡于此固定液中72 h,石蜡包埋,切成5 μm厚度切片。烤片后,脱蜡、水化,苏木素染色5 min,盐酸酒精分化数秒,氨水浸泡15 min,伊红染色2 min,蒸馏水冲洗,梯度酒精脱水,二甲苯透明,中性树脂封片。

2 结 果
2.1 小鼠一般情况 小鼠体重随日龄增加而增加,4组体重无明显差异(见图1)。第14天时,BAPN+Ang-Ⅱ组较对照组体重增加较少。对照组一般情况良好,各实验组经BAPN和Ang-Ⅱ腹腔注射后,毛发无光泽,活动较对照组不灵活,双下肢跛行(是临近死亡表现)。

图1 小鼠体重变化曲线
2.2 4组主动脉夹层形成情况比较 实验过程中,对照组无主动脉夹层形成;BAPN组主动脉夹层形成率为20.0%;Ang-Ⅱ组主动脉夹层形成率为70.0%,破裂率为20.0%,其中1只死于腹腔注射第3天,1只死于第10天,死亡原因为主动脉夹层破裂;BAPN+Ang-Ⅱ组主动脉夹层形成率为80.0%,破裂率为10.0%,1只死于腹腔注射第12天,死亡原因为主动脉夹层破裂。详见表2,图2、图3。
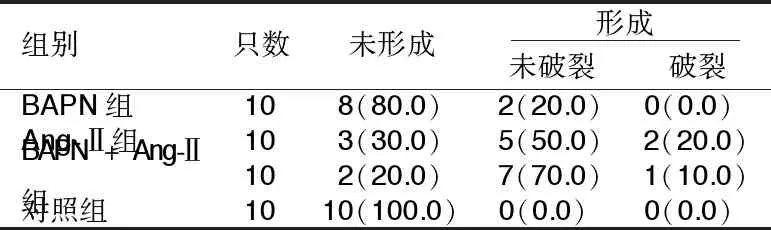
表2 4组主动脉夹层形成情况比较 单位:只(%)
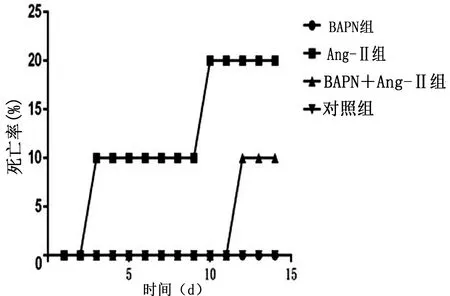
图2 各组小鼠死亡率比较
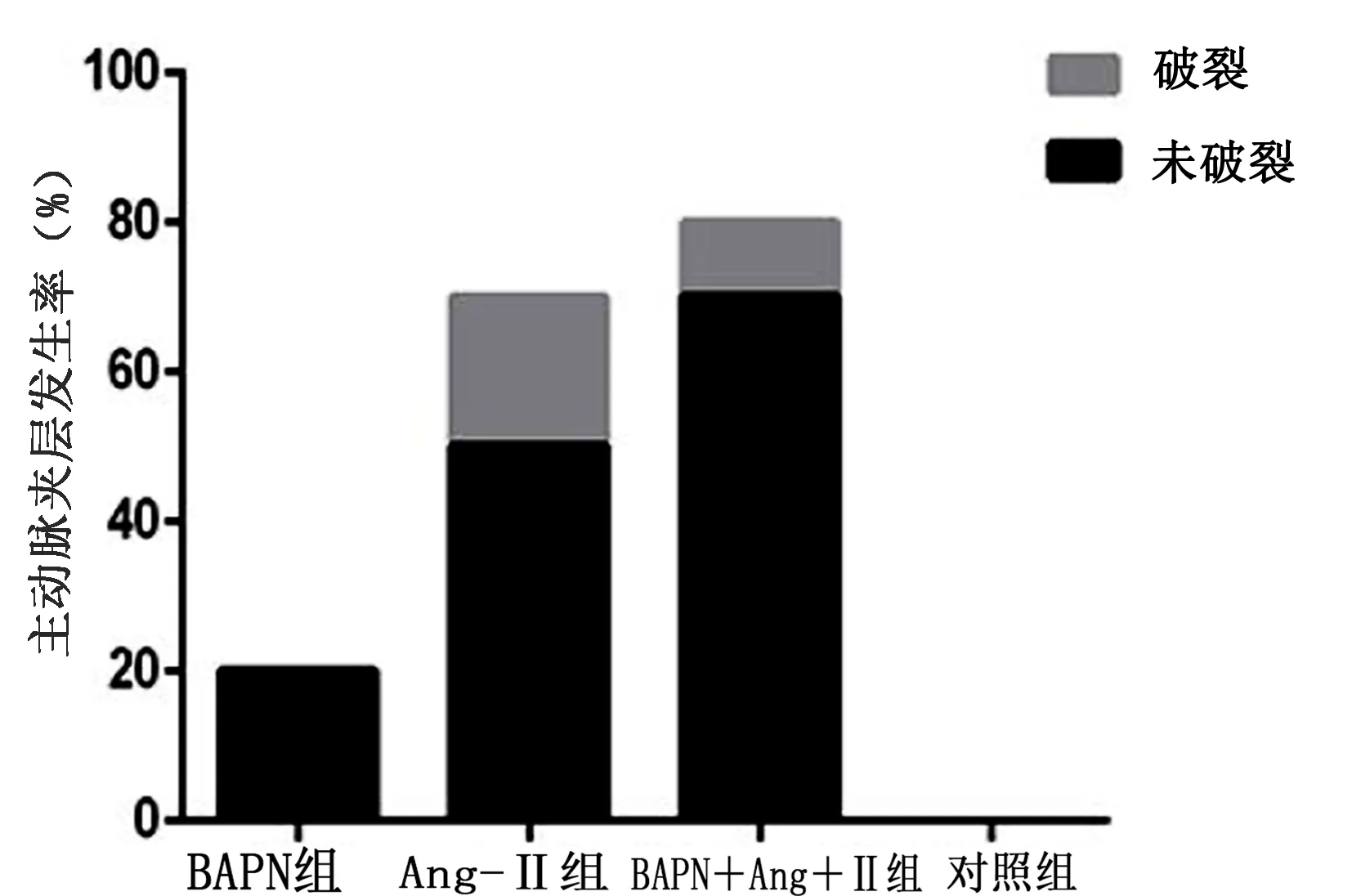
图3 各组主动脉夹层发生率
2.3 各组小鼠主动脉病理观察 对照组未发现肉眼可见的主动脉夹层形成,血管壁结构完整,平滑肌细胞排列整齐;各实验组主动脉可见明显扩张及壁内血肿;BAPN+Ang-Ⅱ组假腔中血细胞充盈,血管壁增厚及血管外膜炎症细胞浸润较BAPN组和Ang-Ⅱ组明显,Ang-Ⅱ组次之,BAPN组最轻。详见图4。
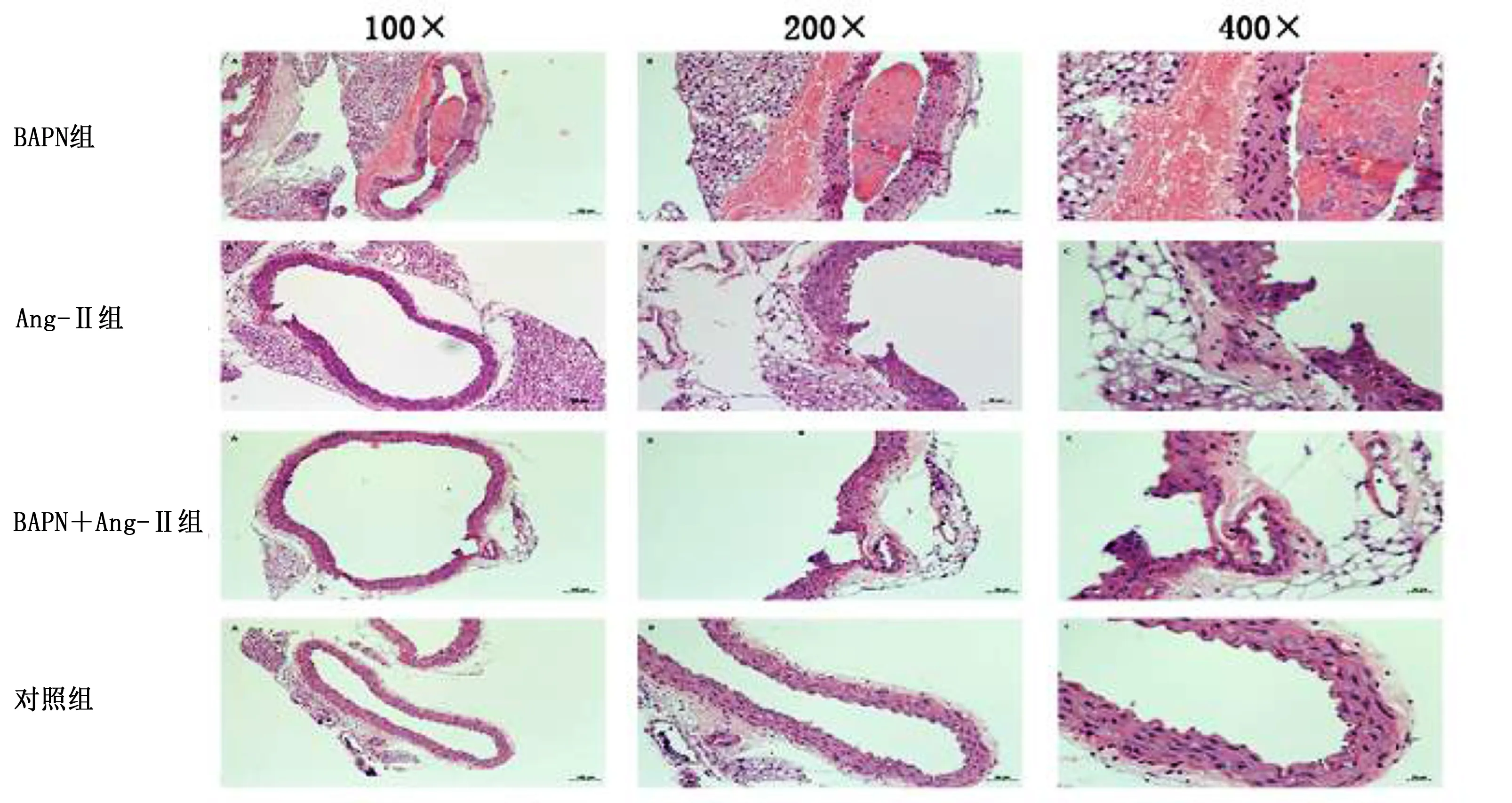
图4 4组小鼠主动脉病理观察
3 讨 论
主动脉夹层是血液经过主动脉内膜撕裂处进入中膜,中膜被撕裂,进而形成真假两腔的一类疾病[12-13],组织病理学明显特征是中膜的退行性变化、平滑肌细胞凋亡、弹性纤维破碎和消失,炎性细胞浸润是具体表现形式[14]。
目前主动脉夹层动物模型构建方法主要包括以下几种。①外科诱导法:选用大型动物作为研究对象,如猪、犬等,手术直接造成主动脉形态学改变,形成与人体主动脉夹层形态相似的动物模型[15],但直接手术诱导不能模拟主动脉夹层发生发展过程,与临床主动脉夹层组织病理学上存在一定差距,发病机制存在一定局限性[16]。②转基因技术诱导法:Ⅰ型(Callal)和Ⅲ型(Col3a1)胶原蛋白基因剔除大鼠,双糖链蛋白多糖(BGN)基因剔除大鼠[17],可建立主动脉夹层模型,但由于自身基因异常,在人类主动脉夹层研究仍存在局限性。③药物诱导:BAPN通过抑制胶原纤维交联诱导主动脉夹层。
本研究结果证实,使用BAPN、Ang-Ⅱ和BAPN联合Ang-Ⅱ腹腔注射可成功构建小鼠主动脉夹层模型,肉眼可见实验组主动脉明显扩张和壁内血肿形成,苏木素-伊红(HE)染色后镜下可见血管壁撕裂,大量血细胞进入管壁,弹力纤维紊乱、断裂,炎性细胞浸润,证明造模成功。实验室前期研究发现给予C57BL/6小鼠BAPN 0.667 g/(kg·d)可导致小鼠死亡,死亡率100.0%,当BAPN剂量减少至0.333g/(kg·d)时,小鼠死亡率下降,动脉破裂率仍达到40.0%。参考既往实验结果,认为选择100 mg/(kg·d)和4 mg/(kg·d)(每隔8 h给药1次),观察小鼠主动脉夹层不同形成效果。因此,选择3种BAPN和Ang-Ⅱ方案。其中,BAPN组采用BAPN,主动脉夹层形成率为20.0%,其余80.0%动脉病理显示炎症反应,但未形成主动脉夹层。Ang-Ⅱ组采用Ang-Ⅱ,主动脉夹层形成率为70.0%,破裂率为20.0%,可能血压升高导致血管破裂。前期实验显示,BAPN浓度上升至0.333 g/(kg·d),联合Ang-Ⅱ,死亡率高达80.0%(结果未显示),可能是由于BAPN处理后导致胶原蛋白和弹性蛋白交联障碍,此时给予Ang-Ⅱ,血管壁压力过大引起破裂,导致死亡。BAPN降至100 mg/(kg·d),BAPN+Ang-Ⅱ组主动脉夹层形成率为80.0%,破裂率仅为10.0%。
综上所述,推荐使用6~8周龄C57BL/6雄性小鼠,BAPN 100 mg/(kg·d)和Ang-Ⅱ4 mg/(kg·d)(每隔8 h给药一次)腹腔注射饲养2周,可形成主动脉夹层。腹腔注射较文献报道饲料喂养、给水灌胃在剂量方面更易控制;较微量泵而言,虽然不能模拟持续给药过程,但每隔8 h给药一次,操作更简单,造模费用更低,无须特殊仪器。本研究建立符合疾病病理变化,是可靠的、重复性好的主动脉夹层小鼠模型,为探讨主动脉夹层发病机制及相应治疗提供了研究基础。
——以渤海A 油藏为例

