微囊藻毒素毒性及其作用机理研究进展
贺 燕,黄先智,丁晓雯,
(1.西南大学食品科学学院,重庆 400716;2.西南大学科技处,重庆 400716)
在全球水体富营养化和气候变暖等因素的综合作用下,蓝藻水华爆发引起了公众的广泛关注[1],而蓝藻细胞释放的蓝藻毒素更是对动物及人类安全造成严重威胁。微囊藻毒素(microcystins,MCs)是水华爆发时微囊藻属、鱼腥藻属等蓝藻产生的次级代谢产物[2],是淡水中分布最广泛的蓝藻毒素之一,具有毒性强、对人体各器官损害大等特点。
MCs是一组环状七肽物质[3],结构可以表示为环-(D-丙氨酸-L-X-赤-β-甲基-D-异天冬氨酸-L-Z-Adda-D-谷氨酸-N-甲基脱羟基丙氨酸),如图1所示。
图1中R1、R2代表H或CH3,其中Adda-(3-氨基-9-甲氧基-2,6,8-三甲基-10-苯基-4,6-二烯酸)是MCs发挥毒性作用的重要结构。X、Z是2 个可变的氨基酸基团,基于不同的氨基酸组合和其他变化(如几种官能团的甲基化/脱甲基),到目前为止已有超过100 个MCs变体被报道。自然界中分布较广的变体为MC-LR、MC-RR和MC-YR(L、R、Y分别代表亮氨酸、精氨酸和酪氨酸),其中MC-LR分布最广且毒性最强。

图 1 MCs分子结构示意图Fig. 1 Molecular structure of MCs
MCs具有亲水性,在水中溶解度最高可达1 g/L[4]。同时,MCs具有很强的耐热性,在300 ℃条件下仍能保持较长时间不分解[5],加之耐酸碱,一旦自来水和食品发生MCs污染,高温烹调和煮沸等加工过程均不易将其破坏和去除,食品安全即无法保障。目前,已经研究了各种常规处理技术用于去除水和食品中MCs。例如活性炭吸附法[6]、化学氧化法[7]和生物降解法[8]。活性炭吸附法是国内外研究去除MCs最多的方法之一,吸附能力强、去除效率较高,但去除效率受吸附材料、pH值、水中有机质竞争吸附等影响,且操作过程复杂,结果不易控制。化学法使用次氯酸钠、高锰酸钾或臭氧,通过氧化MCs中Adda基团上的双键,破坏其发挥毒性的关键结构而达到去除MCs的目的,但存在化学剂残留和造成二次污染等问题。生物降解被认为是一种有效且环境友好的去除方法,MCs降解菌通过破坏MCs的结构,降低其毒性。但存在操作复杂、所需时间长等问题。因此,探讨针对饮用水和食品中MCs的有效去除工艺也应作为研究重点。
1 MCs对饮水和食品的污染
MCs污染水的事件时常发生。调查显示,在我国,MCs主要污染太湖、滇池等湖泊,长江、黄河等水源也检测到不同程度的MCs污染[9]。2014年8月期间,范亚民等[10]对太湖贡湖湾某水厂水源水及出厂水中的MCs进行检测,结果显示MCs的平均质量浓度为0.740 μg/L,检出频率较高;出厂水中MCs去除率相对较低,仅为62.9%~81.8%。高振美等[11]于2009年—2010年期间对太湖梅梁湾水体中MCs的3 种异构体MC-LR、MC-RR、MC-YR进行检测,3 种异构体的平均质量浓度分别为MC-RR(0.277±0.937)μg/L、MC-YR(0.120±0.262)μg/L、MC-LR(0.334±0.297)μg/L,总MCs平均质量浓度高达1.496 μg/L。2015年,金庭旭等[12]对贵阳市主要大型超市出售瓶装水(矿泉水、纯净水)中的MCs污染状况进行调查,结果发现矿泉水中MCs质量浓度为(0.514±0.219)μg/L,纯净水中MCs质量浓度为(0.537±0.218)μg/L。根据流行病学调查,如果长期持续低水平暴露于MCs,即使MCs平均质量浓度低于1.0 μg/L(GB 5749—2006《生活饮用水卫生标准》),也会对人体器官造成损害,促进肿瘤发生[13]。
大量研究表明,MCs能够在螺类、贝类、鱼、虾等多种水产品中积累并沿食物链转移。Williams等[14]将贝类饲喂在有产毒铜绿微囊藻生活的水华中,发现贝类可积累高水平MCs,最高含量可达16 μg/g,假设体质量为60 kg的人平均每天食用这些贝类30 g,则MCs的日摄入量为8.0 μg/kg,远超过世界卫生组织推荐的人群每日最大可耐受摄入量(tolerable daily intake,TDI)0.04 μg/kg[15]。郑竟等[16]对福州市售6 种共计44 份水产品中的MCs污染情况进行调查,结果发现花蛤、贻贝、田螺、鲫鱼、鲢鱼、草鱼样品中均有MCs检出,检出率为27.3%,以贝类污染率较高。水产品是人类重要的食物来源,由于水产品中的MCs不易通过清洗、高温烹煮等方式去除,因此,食用水产品摄入MCs的风险不容忽视。
农作物可通过用被MCs污染的地表水、地下水灌溉或蓝藻肥料施肥等途径受到污染,吸收并积累MCs[17]。Chen Jian等[18]在太湖周边农田种植的水稻谷粒中检测到MCs,含量达到0.04~3.19 μg/kg。朱久正等[19]用质量浓度分别为1、100、1 000、3 000 μg/L的MCs灌溉水稻,发现MCs能够在水稻的根、茎、叶和谷粒中富集,谷粒中MCs富集量分别为4.9、7.1、12.6 μg/kg和21.2 μg/kg。假设体质量为60 kg的人平均每天摄入此种米饭0.2~0.4 kg,以3 000 μg/L处理组的MCs富集量(21.2 μg/kg)计算,人体MCs的日摄入量为0.14 μg/kg,超过TDI 0.04 μg/kg。Mohamed等[20]发现沙特阿拉伯阿西尔地区的井水中MCs质量浓度为0.3~1.8 μg/L,用这些井水灌溉周边种植的蔬菜如萝卜、卷心菜后,在蔬菜的根茎、叶中都检测到了MCs,其最高含量分别为0.36 μg/g和0.26 μg/g。若人体每天食用这些蔬菜200~300 g,其MCs的摄入量是饮用该地区井水MCs摄入量的5~18 倍,高于TDI 0.04 μg/kg。加热、煮沸均无法去除谷粒、蔬菜中MCs,因此应尽量避免使用被MCs污染的水灌溉农作物。
MCs可经多种途径如原料、加工用水或生产设备而污染食物。人类除了通过饮用或者食用被MCs污染的水、食物暴露于MCs外,还包括服用以被MCs污染的蓝藻为原料生产的保健品。由于MCs化学性质稳定,人体摄入后不易将其降解,毒素经肠道吸收后随血液分布至肝脏等组织器官,对人体产生毒性作用。因此,了解MCs的毒性及其机理,对防控MCs对人类健康的危害具有重要意义。
2 MCs的毒性
MCs以肝脏为主要靶器官,对其具有毒性和致癌性,同时还具有肾毒性、生殖毒性、神经毒性和免疫毒性等。研究者常采用蛋白质组学、代谢组学分析与毒理学研究相结合,全面评估MCs的毒性效应[21]。
2.1 肝脏毒性
肝脏是MCs的主要靶器官。研究发现,对小鼠腹腔注射1~2 μg/kg MC-LR时,肝脏中该毒素的积累量可达75%,解剖可看到小鼠肝脏充血、肿胀严重[22]。MCs在纳摩尔浓度下即可引起肝脏细胞骨架重组,其中微管和中间丝形成核周束,微丝形成玫瑰花状结构[23]。隗黎丽[24]通过向草鱼腹腔注射50 μg/kg mb的MC-LR,连续21 d,观察到肝脏中线粒体膜下水肿、粗面内质网扩张、细胞连接间隙增宽、炎性细胞浸润,细胞质中出现大量脂滴及脂褐素、溶酶体增多等病理改变。张榜军[25]向小鼠腹腔注射MC-LR,染毒剂量分别为3.75、7.5 μg/kg mb和15 μg/kg mb,持续28 d,结果显示,与对照组相比,7.5 μg/kg mb和15 μg/kg mb处理组小鼠血清丙氨酸转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline AKP)活力均分别提高了80、200 U/L(P<0.05)。ALT和AKP在临床上被广泛作为肝损伤或肝疾病的诊断指标,其活力显著上升表明肝细胞受到损伤。随后的组织病理学检查也显示,7.5 μg/kg mb和15 μg/kg mb处理组小鼠肝组织中出现炎症细胞浸润,15 μg/kg mb处理组出现明显的凋亡细胞。施玮等[26]用MCs处理原代培养肝细胞,观察到细胞培养液中乳酸脱氢酶(lactate dehydrogenase,LDH)含量、谷草转氨酶(aspartate aminotransferase,AST)活力上升,细胞出现凋亡、坏死并伴有空洞样变化,提示MCs对肝脏有损害作用。流行病学调查显示,长期饮用被MCs污染水的人群中肝癌发生率较高[27]。在对塞尔维亚地区的一项长达10 年的流行病学调查研究表明,该区域原发性肝癌的高发病率可能与饮用被MCs污染的水库水密切相关[28]。俞顺章[29]指出,中国南方地区原发性肝癌的高发病率与沟塘水中MCs污染有关。
2.2 肾脏毒性
小鼠腹膜内注射MCs(75 μg/kg mb)氚标记衍生物后发现MCs不仅在肝脏中高度积累,肾脏中也有大量分布[30]。小鼠气管内注射MC-LR(100 μg/kg mb),通过免疫染色方法也证明了相似的分布特征[31]。这引起大量学者关注MCs肾毒性的研究。研究者通过向大鼠腹腔注射MC-LR(10 μg/kg mb),连续8 周,组织病理学显示肾小球塌陷,基底膜增厚,扩张的小管充满嗜酸性物质,出现明显肾损伤现象。为评估MC-LR对人胚肾细胞系(HEK-293)和人肾腺癌细胞系(ACHN)的细胞毒性和可能的细胞凋亡作用,Piyathilaka等[32]将细胞于纯MC-LR(1.0~200 μmol/L)暴露24 h发现,两种细胞系的细胞活力均显著降低且呈剂量依赖性,细胞凋亡启动子Bax和p53表达上调,Caspase 3/9活力显著增强,表明MC-LR在HEK-293和ACHN细胞中均产生细胞毒性并诱导细胞凋亡。Huang Xiao等[33]用0、1、10 μg/L和100 μg/L MC-LR处理草鱼肾细胞(CIK细胞)24 h和48 h,在CIK细胞中观察到活性氧(reactive oxygen species,ROS)含量和丙二醛(malondialdehyde,MDA)含量增加,谷胱甘肽(glutathione,GSH)水平降低,这些改变在较高剂量(10、100 μg/L)组中更明显,表明MC-LR引起了氧化应激;此外,激光扫描共聚焦显微镜观察显示,CIK细胞中微丝和微管聚集和塌陷,甚至一些细胞骨架结构丧失,表明氧化应激和细胞骨架破坏可能相互作用,共同导致MCs诱导的细胞凋亡和肾毒性。同时,该研究结果还显示,低剂量(1 μg/L)MCs可促进细胞增殖,而高剂量(10、100 μg/L)MCs则诱导细胞凋亡。关于MCs剂量的双效性,即低剂量促进细胞增殖,高剂量诱导细胞凋亡,也在多项研究[34-35]中被报道。由于人类更多地是长期持续暴露于MCs,故应侧重探讨长期暴露于MCs的人群与肾脏的病理改变及肾癌发生的相关性,进一步了解人体的MCs暴露风险。
2.3 生殖毒性
有研究证实MCs能在睾丸[36]和卵巢[37]中积累,并对性腺产生毒性作用。Trinchet等[38]在含质量浓度5 μg/L MC-LR的水体中饲喂青鳉,30 d后发现青鳉曲细精管中的细胞溶解,精子畸形率增加。研究表明,雄性小鼠腹腔注射3、6、12 μg/kg mb的MC-LR,持续14 d,3 μg/kg mbMC-LR没有显著增加小鼠睾丸细胞中DNA-蛋白质交联(DNA-protein cross-linking,DPC)系数,但当MC-LR剂量增加至6 μg/kg mb和12 μg/kg mb时,DPC形成显著增加,同时微核数量也显著增加,表明精子细胞中染色体受损[39]。在另一项研究中,雄性大鼠经腹腔注射剂量为5、10、15 μg/kg mb的MC-LR,连续28 d,5 μg/kg mbMC-LR处理组精子活力降低,精子异常率增加,15 μg/kg mbMC-LR处理组睾丸质量、精子密度和血清睾酮、促卵泡激素(follicle stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)水平降低,组织学检查结果显示,曲细精管萎缩并受阻[40]。慢性低剂量的MCs暴露也会诱导睾丸损伤,对雄性生殖产生实质性毒性。雄性小鼠暴露于1、3 μg/L和10 μg/L的MC-LR,持续3 个月,观察到精子质量下降,睾酮浓度下降,生精上皮呈轻微松弛,并呈剂量依赖效应;持续6 个月变化更明显[41]。Wang Xueting等[42]研究表明,除了对睾丸有直接影响外,MCs可通过破坏下丘脑-垂体-性腺轴间接影响雄性小鼠血清激素水平。由下丘脑分泌的下丘脑促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)刺激垂体释放FSH和LH,在神经激素控制的生殖系统中起关键作用。Xiong Xiaolu等[43]向小鼠经腹腔注射3.75、7.5、15 μg/kg mb和30 μg/kg mbMC-LR,持续14 d,发现MC-LR以剂量-时间效应方式降低GnRH表达,先增加随后降低FSH、LH和睾酮的表达,表明MC-LR可能通过下丘脑直接或间接抑制GnRH合成,改变雄性小鼠血清激素水平,进而损害精子。仅有少数研究报道MCs对雌性哺乳动物的生殖毒性。通过向雌性小鼠腹腔注射5 μg/kg mb和20 μg/kg mbMC-LR,持续28 d,发现卵巢相对质量显著降低,可能与卵巢的病理形态学变化有关;卵泡的组织学评估显示,与对照组相比,20 μg/kg mb的高剂量MC-LR使原始卵泡数量减少约一半[37]。虽然目前没有MCs对人类生殖毒性的数据,但是MCs暴露可能对人类的生殖健康构成威胁,特别是环境中MCs分布广且丰富,容易进入人体。因此,应对MCs的生殖毒性做进一步的调查研究。
2.4 神经毒性
尽管MCs主要被认为是肝毒素,但是一些中毒患者表现出多种神经症状。1996年巴西发生的MCs污染肾透析用水事件中,透析者除出现肝衰竭外,还存在头晕、耳鸣、眩晕、头痛、呕吐等多种神经症状[44]。Li Xiaobo等[45]探讨低剂量MCs(5 μg/kg mb)暴露下大鼠的神经毒性表现,研究发现MCs早期暴露阶段,大鼠出现空间学习和记忆能力下降,暴露后期阶段与记忆有关的大脑区域内一氧化氮合酶和一氧化氮含量等炎性指标上升,表明有炎症发生。已知MCs具有不可逆的抑制丝氨酸/苏氨酸特异性蛋白磷酸酶(protein phosphatase,PP)1和PP2A活性的作用。PP1尤其是PP2A作为神经元微管相关Tau蛋白的主要磷酸酶,其活性降低与异常Tau蛋白过度磷酸化、神经原纤维变性和神经元凋亡有关[46]。体外研究证明,低浓度(0.5 μmol/L)MCs能够作用于小鼠神经细胞诱导神经退行性作用[47]。星形胶质细胞在维持脑内稳态中起着重要作用,可调节突触传递,保护神经元免受氧化损伤[48]。Rozman等[49]用浓度为0.5、2、10 μmol/L的MC-LF、MC-LW(F和W分别代表苯丙氨酸和色氨酸)处理大鼠星形胶质细胞24 h,发现0.5 μmol/L的MC-LF、MC-LW可引起星形胶质细胞数量减少、活力下降、触发细胞凋亡。母体MCs暴露会对大鼠后代的大脑发育产生不利影响,MCs可经血脑屏障和胎盘屏障进入子代大脑并蓄积,诱导神经毒性。Li Xiaobo等[50]将孕期大鼠暴露于20 μg/kg mb的MC-LR中,发现其后代鼠的行为能力和认知功能出现障碍。为更好地了解MCs产前转移与脑组织中的细胞反应,Zhao Sujuan等[51]向孕期大鼠注射剂量为10 μg/(kg mb·d)的MC-LR,持续8 d,发现幼鼠大脑超微结构发生改变,如内质网扩张和线粒体肿胀,脑组织中MDA含量增加、乙酰胆碱酯酶(acetylcholinesterase,AChE)和GSH水平下降,AChE在中枢和外周神经系统胆碱能神经传递中起着重要作用;该研究表明MC-LR的神经毒性可通过母体传递给子代,通过破坏子代大脑细胞骨架、发生氧化应激诱导神经毒性。
2.5 免疫毒性
许多研究已证实MCs可以在脾脏组织中积聚并引起免疫毒性。Wei Lili等[52]对草鱼经腹膜注射MC-LR(50 μg/kg mb),观察到脾脏中淋巴细胞超微结构改变,炎性因子如白细胞介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、免疫球蛋白M(immunoglobulin M,IgM)的基因转录水平显著下降,证明MC-LR对草鱼免疫功能具有抑制作用。Lin Wang等[53]研究发现,不同质量浓度的MCs暴露对鱼类先天免疫系统具有二元影响,低质量浓度组(0.3、1 μg/L和3 μg/L)鱼类脾脏超微结构出现病理变化,且呈浓度依赖性,具体表现为黑素-巨噬细胞中心的形成和巨噬细胞伪足数量的增加,表明低质量浓度MCs能够引起免疫细胞吞噬活性增加;在高质量浓度组(10、30 μg/L)观察到鱼类巨噬细胞发生严重变性以及淋巴细胞的线粒体肿胀,表明细胞免疫功能受到抑制。关于哺乳动物暴露于MCs所导致的免疫毒性研究较少[54-55]。Li Guangyu等[56]对大鼠腹腔注射剂量为10 μg/kg mb的MC-LR,持续50 d,发现大鼠脾脏中MC-LR积聚,组织病理学改变,溶菌酶活性显著降低,免疫系统被破坏,参与细胞凋亡、免疫相关的蛋白如热休克蛋白(heat shock protein,HSP)表达显著上调。先前的研究主要集中探讨鱼类或小鼠在短期接触MCs后体内免疫指标的变化及其他免疫毒性作用,为进一步了解MCs对人类免疫功能的影响,必须系统地评估MCs在环境中的相关浓度和长期接触对人类的免疫毒性,从而更好地评估人类的MCs暴露风险。
2.6 其他毒性
MCs能在肺中积累并且产生毒性[57-58]。Zhao Sujuan等[59]通过向小鼠气管滴注剂量分别为0、10、25 μg/kg mb的MC-LR,在10、25 μg/kg剂量组观察到小鼠肺部塌陷区域增加、肺泡隔增厚以及肺泡壁破裂,说明MC-LR暴露可引起肺实质损伤。Li Xinxiu等[60]研究了暴露于不同质量浓度(1、5、10、20、40 μg/L)的MC-LR中12 个月小鼠的肺损伤情况,结果发现,随着MC-LR质量浓度的增加,小鼠肺组织发生塌陷等病理变化,超氧化物歧化酶活性下降,MDA水平显著上升,表明MC-LR暴露引起抗氧化系统失衡,小鼠肺部可能发生氧化损伤。此外,肺部出现炎症细胞聚集,IL-1β和p65亚基等蛋白水平升高,出现炎症反应。推测氧化应激增强可以改变炎性细胞因子的表达,并导致肺泡损伤和肺实质增厚。
MCs对心脏也有毒性。为评估MC-YR对大鼠心肌细胞的毒性作用,向大鼠腹腔注射剂量为10 μg/kg mb的MC-YR,连续8 个月,心脏切片显示心肌组织的体积密度降低,出现淋巴细胞浸润、心肌细胞增大、肌原纤维减少等现象,这表明长期接触低剂量的MC-YR可能导致心肌萎缩和纤维化[61]。
表1为MCs常见的毒性作用靶器官与毒性表现。
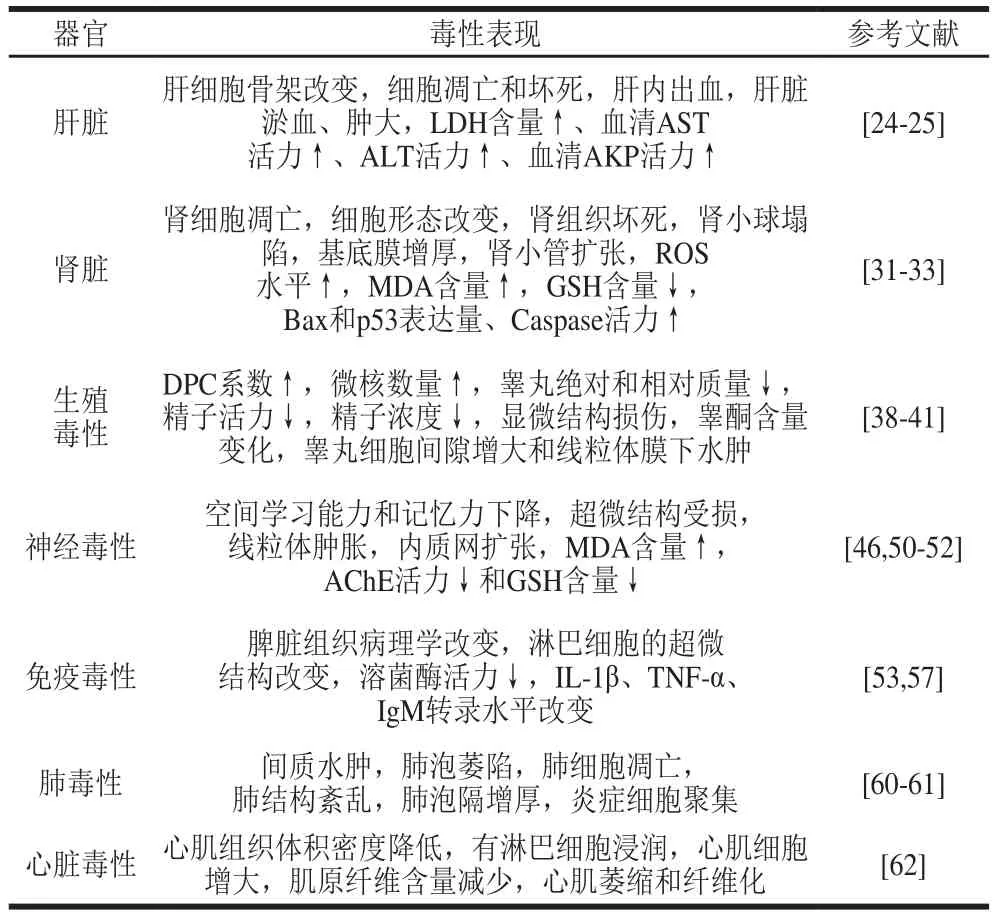
表 1 MCs的毒性作用Table 1 Toxic effects of MCs
3 MCs的毒性作用机理
MCs毒性作用的先决条件是通过多特异性有机阴离子转运多肽(OATP/Oatp)将其转运到细胞中,同时对PP1和PP2A活性产生不可逆的抑制作用。MCs主要通过两步反应抑制PPs活性。首先PPs催化亚基的4 个氨基酸形成疏水笼,迅速包裹MCs的Adda疏水侧链;然后MCs中Mdha侧链的末端碳原子与PPs半胱氨酸的巯基发生不可逆结合。MCs与PPs形成加合物,从而抑制PPs的催化活性,打破体内原有的蛋白磷酸化和去磷酸化平衡,这两者的平衡是调节真核细胞中信号转导的重要机制。MCs通过多种途径如氧化损伤、细胞凋亡、改变细胞骨架稳定性、细胞增殖等的交互作用发挥毒性效应。若要全面评估MCs的潜在健康风险,不能仅满足于简单地揭示由MCs诱导的细胞效应,应该深入了解MCs毒性的分子机制。
3.1 MCs对细胞结构的影响
研究表明,MCs通过引起细胞膜起泡、膜完整性丧失、细胞凝结和凋亡小体的形成导致细胞骨架解体,从而发挥毒性作用[63]。MCs可诱导细胞骨架的3 种组分(微丝、微管和中间丝)发生重排或塌陷。在众多细胞类型如肝细胞、肾细胞中,MCs暴露首先引发中间丝和微管解体,随后微丝发生改变,质膜下的肌动蛋白开始聚集并凝结成玫瑰花状结构,最终这些结构完全塌陷成致密的核周束,细胞核周围的细胞骨架成分逐渐崩溃。基于MCs破坏3 种细胞骨架成分,几种细胞骨架相关蛋白被广泛研究。MCs通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径引起不同类型的微丝相关蛋白过度磷酸化,如Tau、血管扩张剂刺激磷蛋白(vasodilator stimulated phosphoprotein,VASP)和HSP27。Tau是一种重要的神经微管相关蛋白,在微管的组装和稳定性中起重要作用,其过度磷酸化可导致神经元微管骨架形态和功能的紊乱,并被认为与多种神经系统退行性疾病的发生有关。HSP27是一种独立于ATP的分子伴侣,HSP27通过抑制Caspase蛋白的激活和活性来抑制细胞凋亡。当细胞受到MCs刺激时,HSP27通过磷酸化来增加F-肌动蛋白微丝的稳定性,阻止细胞骨架被破坏,从而有利于细胞存活[23],这表明HSP27的过度磷酸化可以补偿MCs诱导的细胞骨架的不稳定性。与HSP27一样,其他骨架蛋白如埃兹蛋白(Ezrin)、VASP受磷酸化调节,可在应激状态下共同维持肌动蛋白丝的结构。
3.2 MCs促进细胞凋亡
组织细胞在MCs暴露后超微结构改变,细胞发生凋亡,其特征为细胞膜起泡、细胞质收缩、染色质浓缩等。研究表明p53、Bcl-2/Bax、细胞色素c(cytochrome c,Cyt c)和Caspase的磷酸化参与MC-LR诱导的细胞凋亡[64]。p53是PP2A的底物,因此MCs和PP2A形成复合物会干扰p53活性,使其过度磷酸化,导致DNA修复受阻,细胞发生凋亡。研究已证实MCs可增加发生凋亡的HepG2细胞、肝细胞中p53的表达[65]。p53介导的细胞凋亡涉及调节Bcl-2家族的促凋亡成员如Bax、Bid的转录。Bax在其启动子区域具有p53结合位点,并且响应p53活化而上调。Bcl-2作为抗凋亡基因,定位于线粒体膜,通过与Bax蛋白形成异二聚体,以防止凋亡过程中线粒体发生改变[66]。Wang Xueting等[67]证实在MCs诱导的细胞凋亡中,p53的表达和磷酸化增加,诱导Bax的上调、Bcl-2的下调以及Bax/Bcl-2以剂量依赖性方式增加,线粒体通透性转换孔开放,Cyt c从线粒体释放到胞质溶胶中,触发Caspase级联反应,最终导致细胞凋亡。除线粒体途径外,内质网途径也可能参与MC-LR诱导的细胞凋亡。内质网是最大的细胞器之一,在调节蛋白的合成和折叠中起主要作用。正确折叠和修饰的蛋白可以从内质网中转运出来,而错误折叠的蛋白被保留在细胞器中导致内质网应激,加速细胞凋亡[68]。在多种细胞类型中,尤其是肝细胞中,MCs暴露导致内质网扩张伴随线粒体损伤和核仁变形[69]。这些结果表明线粒体和内质网通路均参与MCs诱导的细胞凋亡。此外,MCs暴露可使丝氨酸/苏氨酸蛋白激酶Ca2+/钙调蛋白依赖性蛋白激酶II(calcium/calmodulin-dependent protein kinase, CaMKII)过度磷酸化,引起细胞发生氧化应激,促进细胞凋亡[70]。
3.3 MCs促进细胞癌变
已有大量研究证实MCs是肿瘤促长剂。当长期持续低水平暴露于MCs,导致细胞大量增殖至肿瘤发生。Liu Jinghui等[71]对MCs刺激细胞生长和肿瘤促进过程的详细机制进行研究,发现MCs进入细胞并与PP2A/C结合,随后PP2A活性的抑制诱导多种分子变化,包括α4与PP2A/C解离,Akt/S6K1通路的激活,c-Myc、c-Jun、Bcl-2和Bad蛋白的过度磷酸化,进而促进细胞存活和增殖。α4是一种调节蛋白,通过与PP2A的催化亚基C结合调节PP2A活性。MCs可触发α4/PP2A/C亚基解离,这可以补偿由MCs介导的PP2A活性降低,促进细胞增殖。Akt/S6K1通路是细胞增殖和肿瘤发生中的重要通路。c-Myc是重要的致癌转录因子,其调节参与细胞增殖和分化的众多基因的表达,过表达时有助于细胞转化和肿瘤发生[72]。同时,在多种人类癌症中也发现了原癌基因c-Jun的失调。此外,Zhang Jianying等[73]在小鼠体内观察到核因子κB(nuclear factor-κB,NF-κB)和TNF-α与MCs在肿瘤发生中产生协同促进作用。Zhao Yanyan等[74]通过蛋白质组学和转录组学研究发现MCs改变了与肿瘤发生相关的几种途径中37 种mRNA和42 种蛋白质的表达,如GSH代谢、VEGF信号传导和MAPK信号传导途径。还有研究表明内质网应激途径、未折叠蛋白反应和内质网相关降解的激活也参与其中[75]。
3.4 减少DNA修复
MCs侵入机体后,通过抑制PP1和PP2A的活性和诱导ROS产生,导致DNA突变、结构受损、修复受阻,进而诱发DNA损伤。DNA依赖性蛋白激酶(DNA-dependent protein kinase,DNA-PK)是DNA损伤修复过程中的关键蛋白激酶,参与并决定着非同源末端连接DNA损伤修复通路的整个进程。由于DNA-PK在MCs暴露后失去活性,故常将其作为DNA损伤的激酶标记。为进一步证实DNA-PK在MCs暴露下对DNA修复的作用,Lankoff[76]检测了缺乏DNA-PK催化亚基的人胶质母细胞瘤细胞系MO59J中DNA修复的动力学,以含有DNA-PK的MO57K细胞为对照,发现用MCs处理可抑制MO57K细胞中的DNA修复但不抑制MO59J细胞中的DNA修复,表明DNA-PK可能是MCs的主要靶标。因此,DNA-PK活性的丧失和DNA双链断裂修复的能力受损可能是MCs遗传毒性的主要作用机制。
总地来说,MCs发挥毒性效应是一种多途径过程,是不同途径之间“交叉对话”和合作效应的结果(图2)。
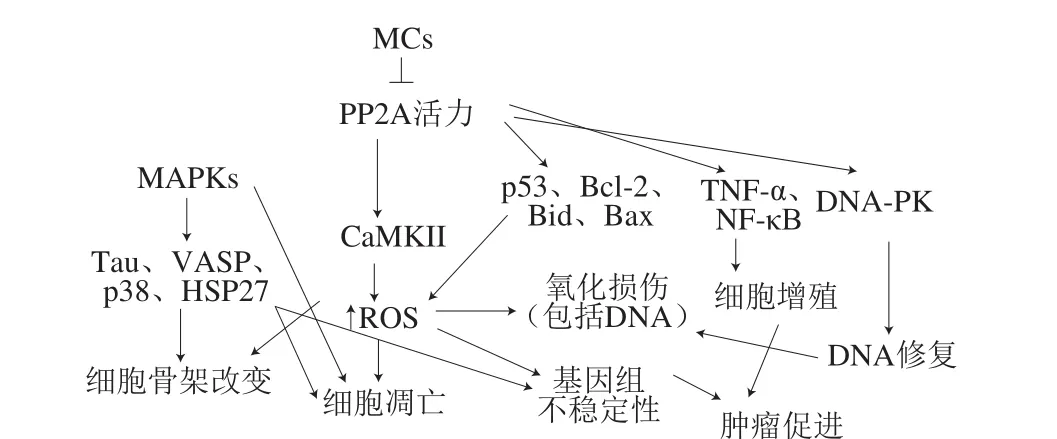
图 2 MCs作用途径[63]Fig. 2 Pathways of MCs mechanism of action[63]
4 MCs的降解
目前,开发更有效的降解水和食品中MCs并脱除其毒性的方法是国内外学者的研究重点。高级氧化工艺(advanced oxidation processes,AOPs)是一种有前景的化学氧化法,利用氧化剂、催化剂、辐射或它们的组合产生高活性氧化物质,如羟自由基、H2O2、O3等,以降解有机污染物。降解MCs的常用方法有光催化、电催化[77]、臭氧化[78]等。紫外线(ultraviolet,UV)是降解MCs的常用方法之一。研究表明,短波UV(波长254 nm)是用于水或食物去污的最常见和最有效的UV形式[79]。Zhao Yuan等[80]采用光电催化作为降解MCs的有效技术,结果表明,光电催化系统对MC-LR表现出高度降解作用;当UV波长设定为254 nm、电流强度为5.0 mA/cm2时,高(1 228.5 μg/L)和低(111.8 μg/L)质量浓度的MC-LR分别在90 min和20 min后完全降解;通过蚕豆根尖微核实验和单细胞凝胶电泳实验表明,遗传毒性和细胞毒性随着MC-LR的降解而被消除。研究表明,生物方法是目前最安全和最有效的方法[81],能有效降解水体中MCs而不产生任何有毒代谢产物,包括生物反应器法[82]和活性污泥法[83]等,这些方法都与MCs的降解菌有关。Ding Qin等[84]从太湖中分离出一株具有高MC-LR降解能力的菌株m6,该菌株可在4 h内完全分解MC-LR(1~50 μg/L),降解速率受温度、pH值和MC-LR质量浓度的显著影响。此外,物理法如超声波技术降解MCs,降低其毒性的研究较多[85]。谷秀等[86]研究不同条件下超声波技术对MCs的降解效果,结果显示,在1 200 W下超声15 min,质量浓度为12.43 μg/L的MCs溶液中MCs去除率达99%,几乎全部去除。
由于基质的复杂性,食品中MCs降解的研究受到诸多限制,在确定降解食品中MCs的适用方法时,应考虑食品品质(如颜色、质地、营养成分)和环境可持续性,以确保水体和食物的公共卫生安全。
5 结 语
日趋严重的蓝藻水华及其毒素MCs污染已成为全球性环境问题和食品安全问题。人类常常在多种途径(饮用水、水产品等食物及蓝藻保健品)中长期接触相对较低水平的MCs。因此,应继续对MCs在水、农作物及水产品等食物中的积累机制及持久性进行更详细的研究。急需开发用于检测食品中MCs的快速监测工具和改善食品中降解MCs的技术,以保护公众健康和确保食品安全与质量。

