麦麸中烷基间苯二酚诱导HepG2细胞自噬和凋亡
郭亚洲,杨小明,,李月英
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.江苏大学医学院,江苏 镇江 212013)
小麦是我国北方居民主食,随着生活水平的提高,在食不厌精的传统下,小麦的加工越来越精细,其剥落的皮层混合少量未剥净的胚乳和胚芽形成了麦麸。流行病学调查发现,食用含有麦麸的全谷物制品可以降低肥胖、糖尿病和一些癌症的发病率,特别是降低结肠癌、乳腺癌和前列腺癌的发病率[1-3]。麦麸脂溶性成分比水溶性成分能更有效抑制人结肠癌细胞生长[4]。进一步的研究表明,小麦麸皮中的烷基间苯二酚(alkylresorcinols,ARs)具有抗肿瘤活性[1]。ARs为1,3-二羟基苯衍生物,在苯环第5位碳上连接一个含奇数碳的烷基侧链,主要由C15:0、C17:0、C19:0、C21:0、C23:0和C25:0组成[5-6],小麦麦麸中以C19:0和C21:0含量最高[7-8]。ARs结构见图1。

图 1 ARs结构式Fig. 1 Structures of alkylresorcinols
由ARs结构式可知,其为两性分子,易溶于非极性溶剂而难溶于水,其在水中的溶解能力与烷基链长相关,烷基链越长,非极性程度越强,在水中溶解性越差[9]。ARs烷基侧链长度的增加还使其对结肠癌细胞的抑制作用降低[10]。ARs在体内的作用与其吸收、代谢密切相关,小肠能部分吸收或代谢ARs,血浆中也检测到一定浓度的ARs存在[11-13]。人群样本调查发现,人血浆中ARs含量与全麦或黑麦的摄入量呈正相关,与远端结肠癌风险呈负相关[11-14]。对ARs的抗肿瘤机理研究发现,ARs能够破坏肿瘤细胞的DNA并防止其修复[15],加速遗传毒性损伤细胞的死亡率[16],抑制癌细胞形成。
天然化合物通过诱导肿瘤细胞自噬和凋亡可以达到控制癌症细胞生长增殖的作用[17-19]。近年来有关ARs的抗肿瘤研究越来越多[1,10],但对ARs诱导肿瘤细胞自噬和凋亡的具体研究报道较少。本研究采用制备色谱法从麦麸中分离纯化得到ARs中含量最高的两个同系物(C19:0和C21:0),以液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)对2 个ARs同系物进行结构验证,并探讨ARs对人肝癌(HepG2)细胞自噬和凋亡的作用,为开发麦麸作为辅助抗肿瘤功能性食品原料提供依据。
1 材料与方法
1.1 材料与试剂
麦麸 镇江富华面粉有限公司;HepG2细胞中国科学院细胞生物学研究所(上海)。
Fast Blue RR 1/2 ZnCl2上海罗恩试剂公司;甲醇(色谱级) 美国TEDIA公司;DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶-乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA) 美国Gibco公司;噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;山羊抗小鼠多克隆免疫球蛋白G(immunoglobulin G,IgG)(稀释比1∶10 000)、山羊抗兔多克隆IgG(稀释比1∶10 000)、Annexin V-FITC/PI细胞凋亡检测试剂盒上海碧云天生物技术公司;β-actin抗体(稀释比1∶1 000) 圣克鲁斯生物技术(上海)有限公司;剪切型Caspase3抗体 沈阳万类生物科技有限公司;其余抗体均购自美国Cell Signaling Technology公司;其他试剂(均为分析纯)均购自国药集团化学试剂(上海)有限公司。
1.2 仪器与设备
HSGF254硅胶板(20 cm×20 cm,0.4~0.5 mm)国药集团化学试剂(上海)有限公司;制备高效液相色谱(high performance liquid chromatography,HPLC)仪(配备WK 500LC-500P泵、SPD-500紫外检测器、Marathon XT手动进样器) 杭州旭昱科技股份有限公司;LC-MS仪(配备Xcalibur 2.0.7 SPI软件、LXQ离子阱) 美国Thermo公司;iMark-17852酶标仪美国Bio-Rad公司;FACSCalibur流式细胞仪 美国BD公司;MiniChemi化学发光成像仪 北京赛奇创想科技有限公司。
1.3 方法
1.3.1 ARs的制备和鉴定
ARs的制备:干燥的麦麸经16 目筛过滤除去粉末,取1 kg麦麸于2 L乙酸乙酯中浸泡48 h,真空抽滤,滤渣重复浸提2 次,合并提取液,旋蒸得到浸膏。浸膏以少量乙酸乙酯溶解,点样于HSGF254制备薄层硅胶板,用石油醚-乙酸乙酯(7∶3,V/V)展开。根据间苯二酚与重氮盐特异性显色反应确定Rf[20],采集斑点,洗脱,浓缩。将初次分离物采用柱层析(2 cm×35 cm,200~300 目硅胶)二次纯化,用氯仿-乙醚(9∶1,V/V)以2 mL/min流速洗脱,10 mL/管,用紫外光谱扫描和重氮盐反应检测各管中的ARs。依据ARs紫外特征吸收峰[20-21]结合ARs与重氮盐显色反应呈紫红色,选取馏分,合并浓缩。浓缩的馏分继续采用制备HPLC仪分离,收集AR C19:0和C21:0馏分。HPLC条件:Welch Ultimate AQ-C18色谱柱(250 mm×21.2 mm,10 μm);流动相甲醇;流速12 mL/min;紫外检测波长280 nm。
ARs的鉴定:用LC-MS对纯化后组分进行成分鉴定。检测条件:流动相为甲醇;流速1.0 mL/min;紫外检测波长280 nm;进样量20 μL;电喷雾电离源;负离子模式;扫描范围m/z 50~1 000;喷雾电压4.5 kV;鞘气流量35 arb;辅助气体流量5 arb;离子传输管温度180 ˚C;喷雾压力1.4 MPa;毛细管温度275 ˚C;毛细管电压30 V;透射电子显微镜电压100 V。
1.3.2 细胞存活率测定
采用MTT法测定ARs的细胞毒性。HepG2细胞用含10% FBS的DMEM培养液在37 ˚C、5% CO2细胞培养箱中培养。取对数生长期细胞,以5×103个/孔接种于96 孔板,待细胞贴壁后用不同终质量浓度(10、20、40、80、160、320 μg/mL)的ARs(用DMSO溶解,且细胞培养液中DMSO体积分数不超过0.1%)处理细胞,对照组每孔加入100 μL含有体积分数0.1% DMSO的培养液,无细胞孔加入培养液作为空白组,每组5 个复孔。培养24、48 h后,每孔加入10 μL 5 mg/mL MTT处理4 h,吸去培养液,加入100 μL/孔DMSO溶解生成的甲瓒晶体,用酶标仪在490 nm处测定各孔光密度值。细胞存活率按下式计算。

用SPSS 22.0软件计算ARs的半抑制质量浓度(half inhibitory concentration,IC50)。
1.3.3 Annexin V-FITC/PI检测细胞凋亡
以5×105个/孔将HepG2细胞接种在6 孔板,经终质量浓度80、160 μg/mL ARs处理24 h后,根据Annexin V-FITC/PI试剂盒说明书步骤进行操作收取细胞,用流式细胞仪采集2万 个细胞样本并分析各组细胞凋亡率。
1.3.4 蛋白质免疫印迹法检测蛋白表达
以5×105个/孔将HepG2细胞接种在6 孔板。经不同终质量浓度ARs处理24 h后,根据王海等[18]的方法提取细胞总蛋白并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,化学发光成像仪进行曝光。使用ImageJ软件分析各蛋白条带灰度。
1.4 数据统计与分析
结果表示为平均值±标准差,实验重复至少3 次。使用SPSS 20.0统计软件进行数据统计分析和Student t检验,P<0.05表示有统计学显著性差异。
2 结果与分析
2.1 ARs制备结果
麦麸乙酸乙酯提取物首先采用HSGF254硅胶板粗分离,分别收集各斑点,采用重氮盐特异性显色,显色反应呈红色的斑点(Rf=0.52)含有间苯二酚结构,收集Rf=0.52的斑点组分,进行硅胶柱色谱分离。根据硅胶柱色谱各馏分的紫外扫描图,组分5和组分6在275 nm和280 nm波长处具有ARs特征吸收峰(图2),且与重氮盐显色反应阳性。
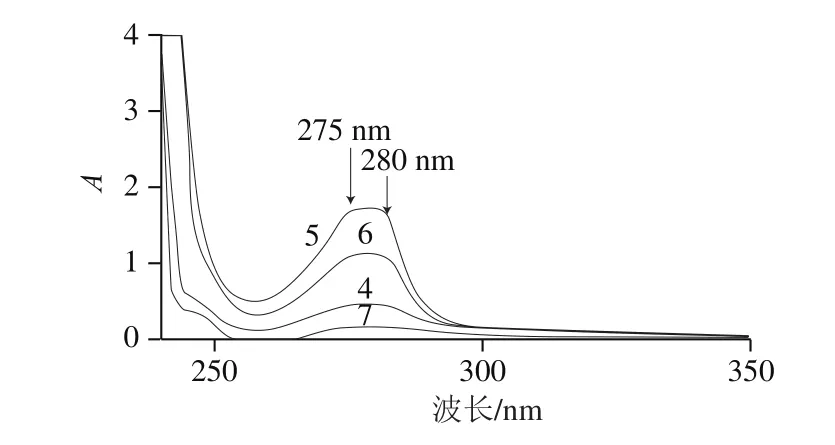
图 2 柱层析收集组分4~7的紫外扫描光谱Fig. 2 UV absorption spectra of fractions 4 through 7 eluted from column chromatography
将符合上述条件的组分(组分5、6)进行合并浓缩,用制备HPLC进一步纯化。根据制备HPLC图,收集2 种含量较高的组分。将保留时间为10.715 min的组分记为A1;保留时间13.607 min的组分记为A2(图3)。

图 3 组分5、6的制备HPLC图Fig. 3 Preparative high performance liquid chromatography of fractions 5 and 6
2.2 LC-MS鉴定ARs结构的结果
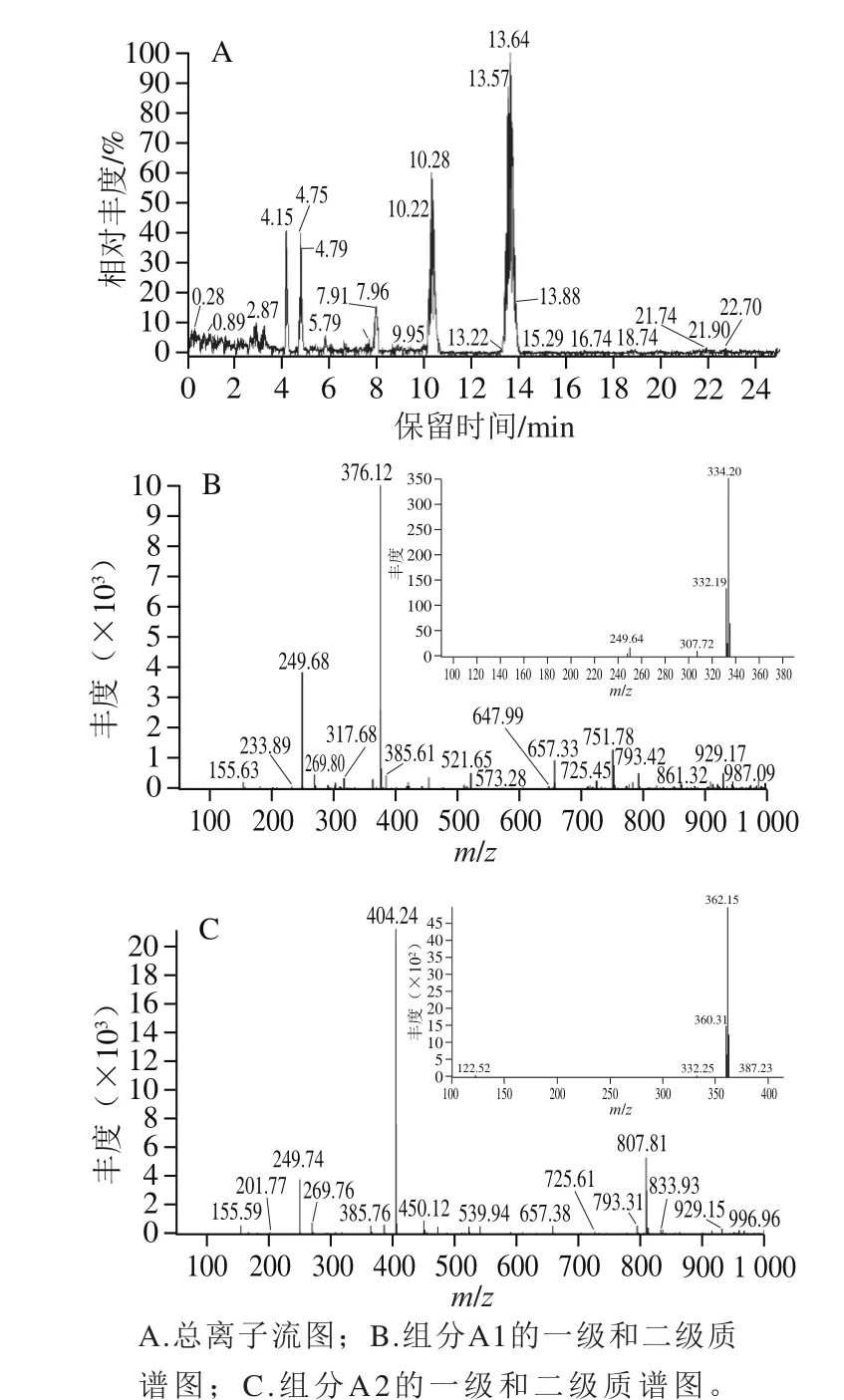
图 4 组分A1、A2的LC-MS分析图谱Fig. 4 LC-MS chromatograms of fractions A1 and A2
LC-MS分析的总离子流图和质谱图如图4所示。组分A1、A2的一级质谱分别显示了m/z 376和m/z 404分子离子。根据一级和二级质谱图,2 个主峰的碎片损失均为m/z 42,考虑到分析物的结构,这种损失对应于乙烯酮(C2H2O),这与Ross等[22]对ARs的研究结果一致。上述结果证实分离物成分是ARs C19:0和C21:0。根据总离子流图,用面积归一化法得到两种组分的总相对含量为81%。这些ARs C19:0和C21:0同系物在后续实验中简称为ARs。
2.3 ARs处理对HepG2细胞存活率的影响
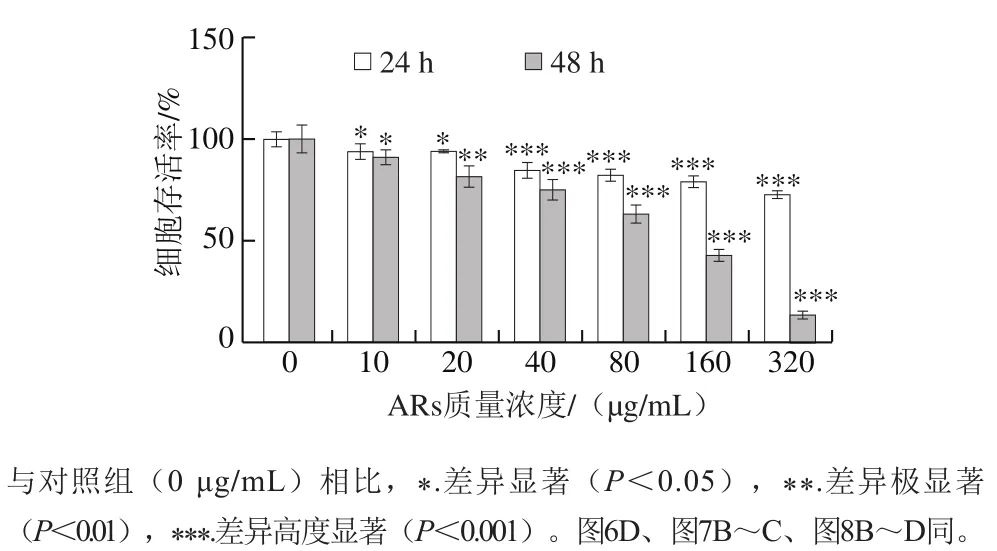
图 5 ARs处理对HepG2细胞存活率的影响Fig. 5 Effects of AR treatments on the survival rate of HepG2 cells
由图5可知,40、80、160 μg/mL和320 μg/mL ARs处理HepG2细胞24 h和48 h后,细胞存活率高度显著降低(P<0.001),呈剂量和时间依赖效应关系,处理48 h时对细胞毒性更加明显。结果显示ARs对体外培养HepG2细胞活力具有较好的抑制效果,计算得到其IC50为112.6 μg/mL。
2.4 ARs处理对HepG2细胞凋亡的影响


图 6 ARs处理对HepG2细胞凋亡的影响Fig. 6 HepG2 cell apoptosis detected by flow cytometry
采用80、160 μg/mL的ARs处理HepG2细胞24 h,经Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率,结果如图6A~C所示。由图6D可知,160 μg/mL ARs诱导后细胞凋亡率相比对照组极显著升高(P<0.01)。
2.5 ARs处理对HepG2细胞凋亡相关蛋白表达的影响
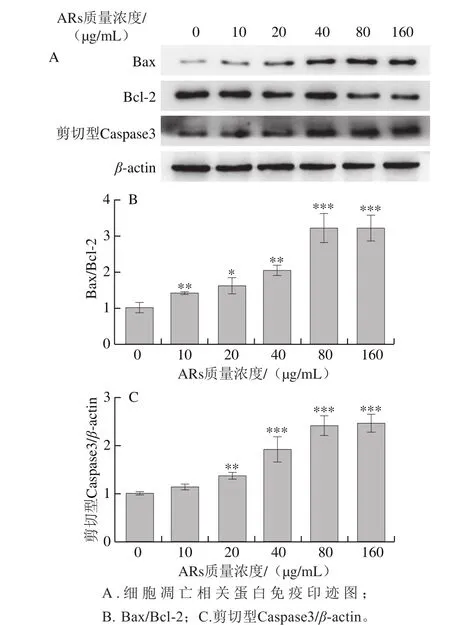
图 7 蛋白免疫印迹法检测HepG2细胞凋亡相关蛋白Fig. 7 Expression of apoptosis-associated proteins detected by Western blot
分别用10、20、40、80 μg/mL和160 μg/mL ARs处理HepG2细胞24 h,细胞凋亡相关蛋白免疫印迹图如图7A所示。由图7可知,较高质量浓度(80、160 μg/mL)ARs处理24 h,促凋亡蛋白Bax相对表达水平高度显著增加,且抗凋亡蛋白Bcl-2表达减少,凋亡启动蛋白剪切型Caspase3相对表达水平高度显著增加(P<0.001)。
2.6 ARs处理对HepG2细胞自噬相关蛋白表达的影响
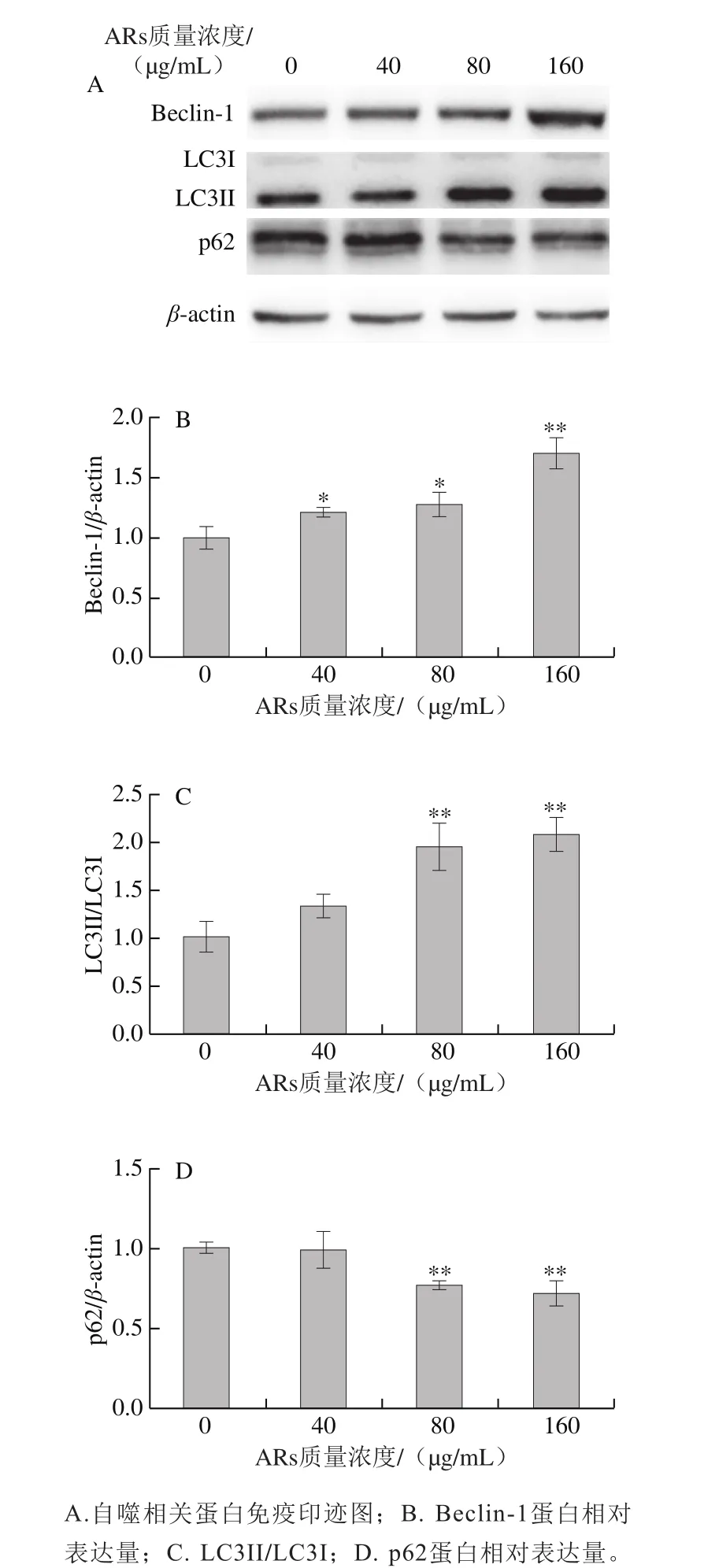
图 8 蛋白免疫印迹法检测HepG2细胞自噬相关蛋白表达量Fig. 8 Expression of autophagy-associated proteins detected by Western blot
用0、40、80、160 μg/mL ARs处理HepG2细胞24 h,其自噬相关蛋白表达结果如图8A所示。由图8B~D可知,160 μg/mL ARs处理细胞24 h后,自噬上游蛋白Beclin-1相对表达量极显著升高(P<0.01),LC3II蛋白表达水平极显著增加(P<0.01),自噬下游蛋白p62表达极显著下降(P<0.01),细胞自噬水平增加。以上结果表明,ARs可能通过调节自噬相关蛋白表达诱导自噬体形成和自噬溶酶体溶解,从而诱导HepG2细胞自噬。
3 讨 论
全谷物食品对心血管疾病和某些癌症的预防作用已经被流行病学研究所证实[13]。麦麸中ARs的抗肿瘤作用越来越引起广泛的关注[1,23]。对麦麸中活性化合物的研究,及全麦食品的营养及麦麸的开发利用都有一定的价值。
前期已有研究报道ARs具有体外抑制前列腺癌和结肠癌细胞生长的效果,但大多数研究限于细胞存活率的测定[1-3],未有更进一步的研究。本研究也发现经ARs处理后HepG2细胞存活率显著降低,说明ARs对体外培养的HepG2细胞具有较好的生长抑制效果,经ARs处理后细胞凋亡率显著增加,证明ARs可以通过诱导肝癌细胞凋亡发挥抗肿瘤效果。Bcl-2是典型的凋亡抑制因子,Bax是典型的凋亡促进因子,Bcl-2和Bax的表达情况常被用作评价癌变程度[17]。本实验结果显示ARs通过显著下调Bcl-2表达和上调Bax表达来促进肝癌细胞凋亡。Caspases家族作为哺乳动物细胞中程序性死亡的介导者和执行者参与癌细胞的凋亡,大多细胞凋亡需要通过Caspase3介导的信号传递途径诱导癌细胞凋亡[17]。ARs通过增加肝癌细胞中的Caspase3表达促进癌细胞凋亡,起到体外抗癌效果。自噬的失调与肿瘤的发生、发展和转移之间存在密切关系,过度的自噬也会导致细胞死亡。自噬体中LC3I的存在和LC3II的转化被用作自噬的指标[24-25]。自噬细胞内p62含量与Beclin-1和LC3II表达水平呈负相关[25-26]。ARs能诱导HepG2细胞内Beclin-1和LC3II蛋白表达水平升高,p62蛋白表达水平下降,从而促进HepG2细胞发生自噬。
综上所述,ARs能够有效地抑制人肝癌HepG2细胞生长,起到促进肿瘤细胞凋亡的作用。ARs可能通过上调Bax/Bcl-2的表达来激活Caspase通路进而诱导HepG2细胞发生凋亡。ARs也能通过促进细胞发生过度自噬从而引起细胞死亡,但其诱导自噬与凋亡之间的联系仍需深入研究。小麦麸皮ARs良好的抗肿瘤活性使其具有良好的开发利用价值。

