芽孢杆菌Bacillus sp.dwc-2对模拟地下水中U(Ⅵ)的还原行为研究
王 静,刘 军,2,赵长菘,涂 鸿,贺含毅,杨吉军,廖家莉,杨远友,*,刘 宁
(1.四川大学 原子核科学技术研究所,辐射物理及技术教育部重点实验室,四川 成都 610064;2.成都理工大学 核技术与自动化工程学院,四川 成都 610059)
铀是最重要的核能资源之一,具有放射性和化学毒性[1]。铀的主要化学价态为6价,在溶液中的溶解度大,易迁移至生物圈。U(Ⅵ)迁移时会与环境介质中的微生物等发生相互作用,如沉淀、氧化还原等反应[2-5],当U(Ⅵ)被还原为U(Ⅳ)时,铀的溶解度和迁移率降低,从而减弱铀的迁移。因此关注环境中铀的生物还原行为具有重要意义。
铀的生物还原行为近年来受到广泛重视。梁君等[6]研究发现,丝状真菌黑曲霉还原U(Ⅵ)为U(Ⅳ),且U(Ⅳ)产物是单核U(Ⅳ)原子紧密包围的轻元素壳组成的形态。Stirling等[7]发现硫酸盐还原菌代谢过程中产生的H2S会参与并促进铀的生物还原;Zhou等[8]的研究表明,Fe(Ⅲ)金属还原菌产生的电子参与了铀的生物还原;Newsome等[9]报道了在乳酸钠和乙酸存在时,U(Ⅵ)从铁还原菌得到电子从而被还原。此外,Ding等[10]发现了芽胞杆菌Bacillussubtilis胞外表面复合物之间斥力抑制铀的还原过程;Zhang等[11]也认为U(Ⅵ)的生物还原受形成的复合体类型的影响。
芽胞杆菌Bacillussp.dwc-2是从中国西南地区某处典型土壤中分离出的一种优势菌。本研究小组[12]曾初步探讨了厌氧条件下Bacillussp.dwc-2还原去离子水中U(Ⅵ)的行为。本文拟在此基础上进一步在厌氧条件下研究Bacillussp.dwc-2对模拟地下水中U(Ⅵ)的还原行为,重点考察时间、地下水中主要无机阴离子、腐殖酸(HA)以及富里酸(FA)对芽孢杆菌还原铀的影响,并通过EDS、SAED、TEM、XPS对还原机制进行初步探讨,以便在接近真实环境条件下了解微生物对U(Ⅵ)的还原行为与机理。
1 实验
1.1 主要试剂与仪器
UV-2450型紫外可见分光光度计,日本岛津;ZDX-35BI型座式压力蒸汽灭菌锅,上海申安医疗器械厂;TG16G离心机,湖南凯达科学仪器有限公司;pHs-3C精密pH计,上海精密科学仪器有限公司雷磁仪器厂;ZQLY-180GF振荡培养箱,上海知楚仪器有限公司;LSHZ-300型恒温冷冻水浴振荡器,太仓市豪诚实验仪器制造有限公司;DELLIX型真空手套箱,成都德力斯实业有限公司。
1.2 Bacillus sp.dwc-2对U(Ⅵ)的还原
培养分离Bacillussp.dwc-2后,以4 000 r/min离心5 min,然后用0.05 mol/L NaCl溶液洗涤3次,最后将洗净的Bacillussp.dwc-2放入真空手套箱中备用。
将配置好的250 mL UO2(NO3)2·6H2O溶液(U(Ⅵ)溶液)加入500 mL烧杯中,并用0.1 mol/L NaOH或HNO3调节溶液pH值为7.0,再用N2(99.999%)除氧30 min,将处理后的溶液移入500 mL厌氧培养瓶中,放置在真空手套箱内,使氧含量低于1 mg/L,随即加入一定质量的Bacillussp.dwc-2,在恒温振荡器上以150 r/min的转速振荡一定时间,之后以10 000 r/min离心分离,测量上清液中U(Ⅵ)的浓度,下层沉淀物经过冷冻干燥后进行表征。
1.3 材料表征
将冷冻干燥后的下层沉淀物在厌氧手套箱中制作为材料表征用样品。样品在充满氮气的环境中送至检测中心。采用Escalab 250Xi X射线光电子能谱(XPS)仪进行U价态分析;采用透射电子显微镜(TEM)和区域电子衍射(SEAD)分析样品的内部结构。
1.4 数据处理
分析还原反应前后溶液中U(Ⅵ)的含量,按式(1)计算还原率R:
R=(c0-ct-ca)/c0×100%
(1)
其中:c0和ct分别为还原反应前和还原反应进行到t时刻溶液中U(Ⅵ)的浓度,mg/L;ca为Bacillussp.dwc-2吸附的总U(Ⅵ)的浓度,mg/L。通过XPS peak 4.1分峰计算U(Ⅳ)、U(Ⅵ)的面积比,从而计算吸附的U(Ⅵ)和还原的U(Ⅳ)占芽孢杆菌总吸附铀的比值,得到ca和还原的U(Ⅳ)浓度。
2 结果与讨论
2.1 Bacillus sp.dwc-2还原U(Ⅵ)的影响因素
1) 时间
1)做好顶层设计,助推实验室管理制度体系化。设立由单位领导及各相关部门负责人组成的实验室安全管理委员会,按专业类别下设实验室安全专家咨询组,例如:化学、生物、辐射、环境保护、特种设备、职业健康等安全专家咨询组;为委员会评价和审核各项管理制度、安全手册、规范及细则等提供专业性意见或建议,促进实验室管理制度体系化发展。
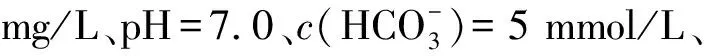
2) 无机阴离子
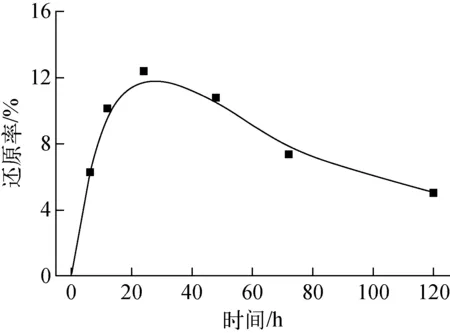
图1 时间对Bacillus sp.dwc-2还原U(Ⅵ)的影响Fig.1 Effect of time on U(Ⅵ) reduction by Bacillus sp.dwc-2
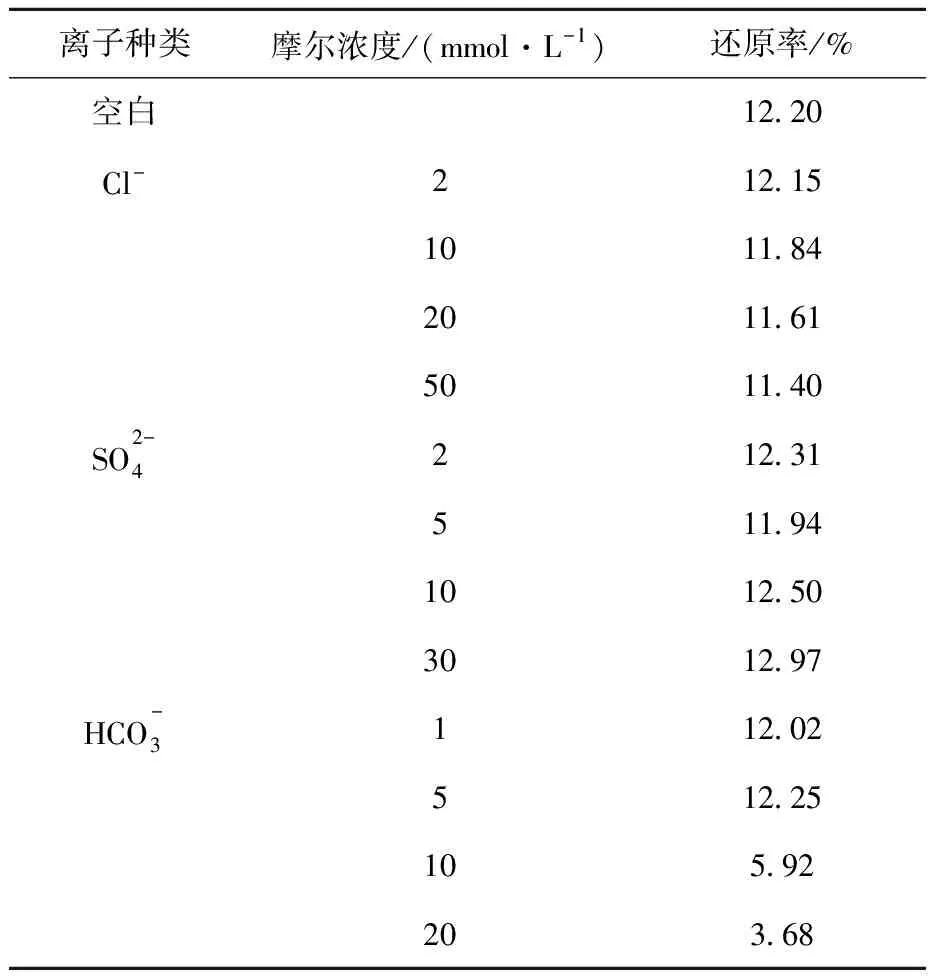
表1 无机阴离子对Bacillus sp.dwc-2还原U(Ⅵ)的影响Table 1 Effect of anion on U(Ⅵ) reduction by Bacillus sp.dwc-2
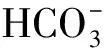
3) 腐殖酸

4) 富里酸
在与腐殖酸因素研究的相同条件下,富里酸(FA)浓度(0~200 mg/L)对Bacillussp.dwc-2还原U(Ⅵ)的影响示于图3。由图3可见,在0~25 mg/L浓度范围内,Bacillussp.dwc-2对U(Ⅵ)的还原率随FA浓度的升高而增加,最大还原率为16.2%。此后继续增大FA浓度,Bacillussp.dwc-2对U(Ⅵ)的还原率有所降低,200 mg/L时还原率只有5.3%。相对于HA,FA对Bacillussp.dwc-2还原U(Ⅵ)的促进作用大,可能是因为HA携带的羧基较FA多,羧基与U(Ⅵ)离子形成新的配合物,配合作用成为主要反应,从而减弱了Bacillussp.dwc-2对U(Ⅵ)的还原。
2.2 还原U(Ⅵ)后的Bacillus sp.dwc-2样品的表征
1) XPS分析

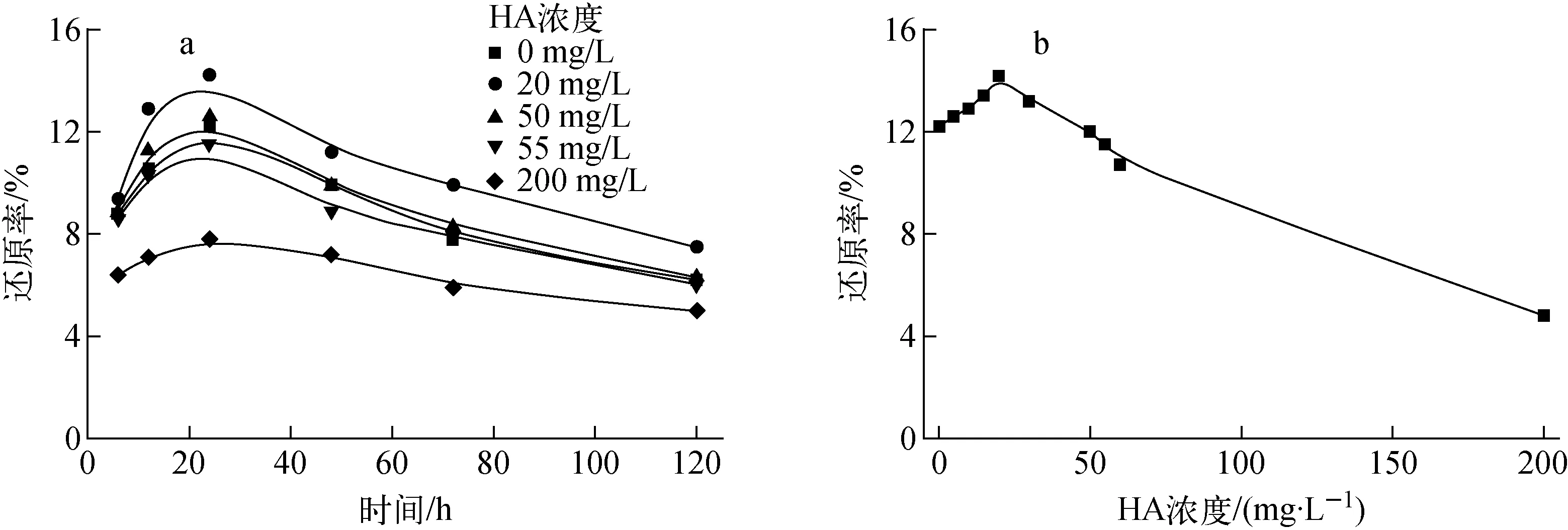
图2 HA浓度对Bacillus sp.dwc-2还原U(Ⅵ)的影响Fig.2 Effect of HA concentration on U(Ⅵ) reduction by Bacillus sp.dwc-2
图3 FA浓度对Bacillus sp.dwc-2还原U(Ⅵ)的影响Fig.3 Effect of FA concentration on U(Ⅵ) reduction by Bacillus sp.dwc-2
图4a、b为U 4f的XPS谱。所有数据均参照文献[10,12,21-22]进行解析处理,分析结果准确。XPS谱中的U 4f7/2U(Ⅵ)和U 4f5/2U(Ⅵ)峰值中心点位于(391.9±0.2) eV和(381.5±0.2) eV,U 4f7/2U(Ⅳ)和U 4f5/2U(Ⅳ)峰值中心点位于(390.8±0.2) eV和(380.1±0.2) eV。已有研究[23]表明,位于381.5 eV处的特征峰是≡SOUO2+,可知羟基(≡SO-)与U(Ⅵ)形成了配合物,表明U(Ⅵ)离子的吸附主要是由于芽孢杆菌表面上羟基的配合作用。上述结果显示芽孢杆菌还原U(Ⅵ)过程中吸附和还原同时存在。

图4 U(Ⅵ)还原后U 4f(a,b)、C 1s(c,d)、O 1s(e,f)的XPS谱Fig.4 XPS pattern of U 4f (a, b), C 1s (c, d), O 1s (e, f) after U(Ⅵ) reduction
由图4a、b可知,不加HA和FA时,最大还原率为12.2%。HA和FA浓度为25 mg/L时,U(Ⅳ)与Bacillussp.dwc-2吸附的总U(Ⅵ)的峰面积比最大,此时还原率最大。最大还原率分别为14.2%和16.2%。HA和FA浓度继续增大,该比值下降,还原率有所下降。


2) TEM-EDS、SAED分析

3 结论
1)Bacillussp.dwc-2对U(Ⅵ)在24 h时达到最大还原率12.2%,HA浓度和FA浓度为25 mg/L时,Bacillussp.dwc-2对U(Ⅵ)的最大还原率分别为14.2%和16.2%。
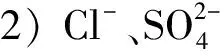
3) 低浓度的HA和FA在U(Ⅵ)的生物还原中是电子载体,促进U(Ⅵ)的生物还原;随HA和FA浓度的增加,HA、FA在U(Ⅵ)离子表面形成致密的腐殖层,抑制了铀酰离子与菌体间电子的转移,减弱了U(Ⅵ)的还原。相对于FA,HA对U(Ⅵ)的还原影响较弱。
4) TEM-SAED和XPS证实了还原过程中U(Ⅳ)的存在。
上述结果有助于进一步了解真实地下水环境中微生物还原U(Ⅵ)的行为。

