MCUR1表达对卵巢癌细胞生长的影响及作用机制
白翔宇曹珊珊杨世荣高天陈艳琴鲍登克
作者单位:475004开封 1河南大学药学院;710032西安 2空军军医大学唐都医院普外科;3空军军医大学西京医院妇产科;716000延安 4延安大学医学院
卵巢癌是女性发病率和死亡率均较高的恶性肿瘤,全世界范围内每年新发病例近239 000例,而相关死亡病例152 000例[1-2]。卵巢癌临床症状隐匿,早期难以发现,且易发生转移,侵袭性强,但临床上尚缺乏特异性的诊断方法,70%以上的患者确诊时已为晚期[3],5年生存率低于30%[4-5]。因此亟待开发可用于卵巢癌诊断及治疗的靶点。
线粒体作为“能量工厂”为细胞提供能量,Ca2+作为细胞内第二信使在细胞内传递信号,两者都在细胞生命活动中扮演重要的角色。线粒体钙单向转运体调节因子1(mitochondrial calcium uniporter regulator 1,MCUR1)是细胞内的钙调节分子,在调控线粒体钙稳态方面发挥至关重要的作用[6-7]。而线粒体钙稳态可决定细胞氧化呼吸功能进程、细胞生死、活性氧生成、线粒体ATP生成、细胞质内的钙信号及胞浆钙环境维持等,目前研究发现线粒体钙稳态异常与多种肿瘤的发生和发展紧密相关,且MCUR1在其中起重要作用[8-9]。本研究首先利用TCGA(the Cancer Genome Atlas)数据库分析卵巢癌组织中MCUR1的表达水平与患者预后的关系,然后进一步收集组织标本及在细胞水平和动物实验中观察MCUR1对卵巢癌细胞增殖、凋亡的影响,并初步探讨MCUR1发挥作用的分子机制,以期为卵巢癌诊断和治疗寻找的新靶点。
1 材料与方法
1.1 材料
1.1.1 TCGA数据库 在TCGA数据库中筛选卵巢癌患者数据集,采用R语言(3.1.1版本)软件进行统计分析。共下载372例卵巢癌患者数据,年龄为30~87岁,均有总生存期(overall survival,OS)和RNA seq数据,OS定义为诊断日期至死亡或者失访的时间。
1.1.2 组织样本来源 纳入43例卵巢癌组织石蜡切片,均购自空军军医大学西京医院病理科,组织样本于2017年2月至2019年2月由空军军医大学西京医院收集,所有患者具有完整临床资料并签署知情同意书,本研究已通过空军军医大学西京医院医学伦理委员会批准。
1.1.3 细胞株与裸鼠 人卵巢癌细胞系A2780购自武汉普诺赛公司;4~6周雌性BALB/c-nu裸鼠购自空军军医大学动物实验中心,饲养于无菌条件下,12 h明暗周期,水和食物充足。动物实验按照空军军医大学动物伦理委员会批准的规程进行。
1.2 主要试剂
新生胎牛血清、RPMI1640培养基购自Hyclone公司;LipofectamineTM2000、引物购自Invitrogen公司;MCUR1干扰片段和过表达质粒购自上海吉玛公司;real-time PCR试剂盒购自TaKaRa公司;免疫组化试剂盒、DAB显色液购自福州迈新试剂公司;MCUR1抗体购自Sigma-Aldrich公司;p53抗体购自Cell Signaling Technology公司;Caspase-3抗体、Bax抗体、Bcl2抗体、Cyclin D1抗体、Cyclin E抗体购自Abcam公司;β-actin抗体购自北京天德悦公司;MTS试剂盒购自Promega公司。
1.3 免疫组织化学法检测卵巢癌组织中蛋白的表达水平
免疫组化染色采用SP法,即脱蜡水化、抗原修复、封闭内源性过氧化物酶、山羊血清封闭,滴加对应一抗过夜,第2天滴加生物素标记的二抗、链霉亲和素标记的辣根过氧化物酶三抗孵育,用新鲜配置的DAB工作液显色,苏木精复染,脱水、透明、封片,镜下观察。结果判读采用IRS表示,IRS为每个样本中的染色强度值(0分:无染色;1分:弱染色;2分:中度染色;3分:强染色)和阳性细胞百分比值(0分:<10%;1分:10%~25%;2分:26%~50%;3分:51%~75%;4分:76%~100%)的乘积,IRS>3为阳性,IRS≤3为阴性。
1.4 细胞培养和转染
A2780细胞用含10%胎牛血清的DMEM培养于37℃、5% CO2细胞培养箱中,取适量对数生长期细胞接种于6孔培养板,24 h后细胞培养板覆盖率为70%~80%时进行转染。转染试剂采用LipofectamineTM2000,用瞬时转染法分别将MCUR1干扰片段及过表达质粒转染A2780细胞,标记为siMCUR1组和MCUR1组,并分别设置相应的阴性对照,标记为siCtrl组和EV组。
1.5 qRT-PCR实验检测卵巢癌细胞中MCUR1 mRNA的表达情况
按总RNA提取试剂盒操作方法提取瞬时转染后的卵巢癌细胞总mRNA,OneDrop检测RNA纯度和浓度,反转录为cDNA后进行qRT-PCR实验。MCUR1上游引物:5'-AACTCTACTTCGACACTCATGCCTTAG-3',下游引物:5'-GCCTCCAGGATCTTGACCAATGC-3';GAPDH上游引物:5'-GGAGCGAGATCCCTCCAAAAT-3',下游引物:5'-GGCTGTTGTCATACTTCTCATGG-3'。反应体系为25μL,反应条件设置为95℃30 s;95℃5 s、55℃30 s、72℃30 s,40个循环;72℃1 min。每个样品设置3个复孔,采用2-△△Ct法计算基因相对表达量,实验重复3次。
1.6 Western blot实验检测卵巢癌细胞中增殖和凋亡相关蛋白的表达水平
收集转染48 h后的A2780细胞,PBS洗涤3遍,加入RIPA裂解液,冰上孵育30 min,4℃12 000 r/min离心30 min,收集上清液。BCA蛋白定量试剂盒测定蛋白浓度,加入蛋白上样缓冲液,100℃煮沸10 min使其变性。按每孔40μg上样,蛋白样品经SDS-PAGE电泳后转移至PVDF膜上,5%脱脂奶粉室温封闭1 h后,加一抗4℃孵育过夜。用1×TBST洗膜3次,每次5 min。加二抗室温孵育1 h。用1×TBST洗膜3次,每次5 min。采用ECL化学发光液显影分析。
1.7 MTS法检测干预MCUR1后卵巢癌细胞的生长情况
取对数生长期细胞,调整细胞悬液浓度为100μL/孔,加入96孔板,2×103/孔;5% CO2、37℃孵育24 h,显微镜观察;每孔加入20μL MTS溶液(5 mg/mL),培养2 h后,使用酶标仪在490 nm波长处检测细胞吸光度值。每组采用5个复孔,实验重复3次。
1.8 克隆形成实验检测干预MCUR1后卵巢癌细胞的增殖能力
取对数生长期细胞,胰蛋白酶消化收集细胞,将细胞悬液梯度稀释接种于6孔板,1 000/孔,置于培养箱静置培养3周,中间更换2次培养基,当板中出现细胞克隆团时,弃去上清,PBS洗涤,用4%多聚甲醛于室温下固定细胞30 min。弃去固定液,加适量结晶紫染色液染色10 min,将平板克隆进行拍照,计数克隆细胞数。
1.9 裸鼠皮下成瘤实验
将裸鼠按接种细胞随机分为4组,分别标记为siMCUR1组、siCtrl组、MCUR1组和EV组,打上耳标,每组7只,观察2 d若状况均良好,即接种细胞。取对数生长期细胞,2.5%胰酶消化后,加PBS制备成细胞悬液,细胞密度为1×107/mL。于裸鼠右侧肩胛下部皮下注射200μL细胞悬液,形成隆起皮丘后拔出注射器,再次消毒局部皮肤。1周后开始观察皮下肿瘤形成情况,并用游标卡尺测量皮下肿瘤长径和短径,计算肿瘤体积,每隔2 d测量1次。5周后处死裸鼠,取出瘤体并称重。肿瘤组织切至黄豆大小,用福尔马林常规固定,脱水,至透明,石蜡包埋,制成0.3μm切片。
1.10 组织TUNEL实验检测细胞凋亡情况
石蜡切片脱蜡水化后,加蛋白酶K孵育20 min,1×PBS洗涤3遍;加TUNEL反应液,37℃避光孵育1 h,1×PBS洗涤3遍;DAPI染色,封片,荧光显微镜拍照。将DAPI和TUNEL均呈阳性的细胞记为凋亡细胞,每块组织于40倍目镜下拍摄5个视野,统计细胞阳性率。
1.11 统计学方法
采用SPSS 21.0软件和GraphPad Prism 7.0软件对实验数据进行统计分析。计量数据采用均数±标准差(±s)表示,两组间比较采用独立样本t检验;计数资料采用百分比表示。对TCGA数据进行分析,采用Kaplan-Meier法计算生存率,根据MCUR1 mRMA表达量的中位数将患者分为低表达组和高表达组,两组间生存曲线的比较采用Log-rank检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 MCUR1在卵巢癌组织中的表达及其与预后的关系
根据MCUR1 mRNA表达水平中位数(9.95)进行分组,低于中位数的样本为低表达组,共203例;高于中位数的样本为高表达组,共169例。对372例卵巢癌患者进行Kaplan-Meier生存分析,MCUR1高表达组中位生存期为53.7个月,低表达组中位生存期为41.3个月,两组比较差异有统计学意义(P=0.003),见图1A;43例卵巢癌标本进行免疫组织化学法染色,MCUR1阳性率为25.6%(11/43),见图1B。
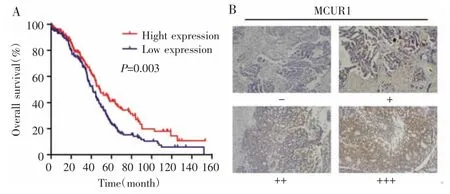
图1 MCUR1在卵巢癌组织中的表达及其与预后的关系Fig.1 Expression of MCUR1 in ovarian cancer tissues and its relationship with prognosis
2.2 MCUR1的转染效果
在卵巢癌A2780细胞中,与siCtrl组相比,siMCUR1组细胞中MCUR1的mRNA和蛋白表达量均显著下降(P<0.01);MCUR1组细胞中MCUR1的mRNA和蛋白表达量均较EV组显著升高(P<0.01)。见图2。
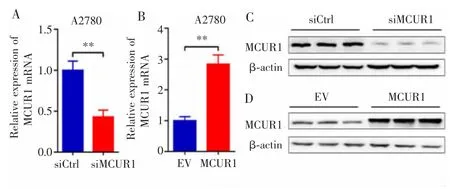
图2 MCUR1在卵巢癌细胞系中的表达Fig.2 Expression of MCUR1 in ovarian cancer cell lines
2.3 MCUR1对卵巢癌细胞生长的影响
MTS实验检测结果显示,转染96 h后,siCtrl组和siMCUR1组相对应的OD值分别1.14±0.02和2.47±0.03,差异有统计学意义(P=0.004);MCUR1组和EV组OD值分别为1.06±0.05和1.61±0.04,差异亦有统计学意义(P=0.032),见图3A;克隆形成实验检测结果显示,siCtrl组和siMCUR1组细胞克隆形成数分别为(113±27)个和(245±31)个,差异有统计学意义(P=0.006);MCUR1组和EV组细胞克隆形成数分别为(46±11)个和(107±23)个,差异有统计学意义(P=0.004),见图3B。
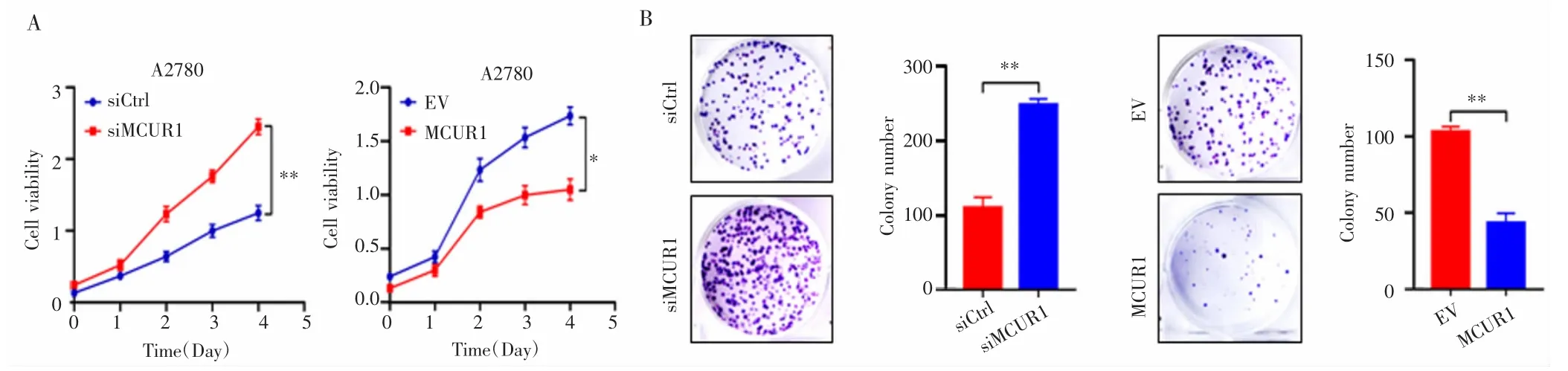
图3 MCUR1对卵巢癌细胞增殖的影响Fig.3 Effect of MCUR1 on the proliferation of ovarian cancer cells
2.4 MCUR1对裸鼠皮下移植瘤生长的影响
裸鼠皮下移植肿瘤模型实验结果显示,接种31 d后,siMCUR1组和siCtrl组的肿瘤体积分别为(1 450±37)mm3和(347±51)mm3,肿瘤重量分别为(1.37±0.21)g和(0.42±0.13)g,差异均有统计学意义(P=0.006,P=0.004),见图4A。MCUR1组和EV组的肿瘤体积分别为(271±53)mm3和(1 230±90)mm3,肿瘤重量分别为(0.29±0.15)g和(1.18±0.17)g,差异亦均有统计学意义(P=0.005,P=0.004),见图4B。
裸鼠皮下移植瘤组织切片的HE染色、免疫组化染色结果显示,siMCUR1组的Ki67阳性率高于siCtrl组[(79.46±1.33)% vs(42.75±1.28)%,P=0.007],见图5A;MCUR1组的Ki67阳性率低于EV组[(19.73±1.45)%vs(53.20±1.19)%,P=0.004],见图5B。TUNEL实验结果显示,siMCUR1组的细胞凋亡率较siCtrl组降低[(1.73±0.53)% vs(3.72±0.66)%,P=0.023],见图5C;MCUR1组细胞凋亡率较EV组上升[(13.41±1.21)% vs(6.43±0.44)%,P=0.041],见图5D。
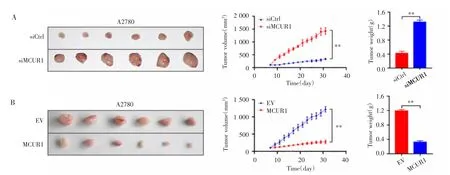
图4 MCUR1对裸鼠皮下成瘤的影响Fig.4 Effect of MCUR1 on subcutaneous tumorigenesis in nude mice

图5 MCUR1对卵巢癌细胞增殖和凋亡的影响Fig.5 Effect of MCUR1 on proliferation and apoptosis of ovarian cancer
2.5 MCUR1对增殖和凋亡相关分子蛋白表达的影响
Western blot实验检测结果显示,siMCUR1组相较于siCtrl组细胞,p53、Caspase-3和Bax表达下调,而Bcl2、Cyclin D1和Cyclin E表达上调;MCUR1组相较于EV组,p53、Caspase-3和Bax表达上调,Bcl2、Cyclin D1和Cyclin E表达下调,见图6。
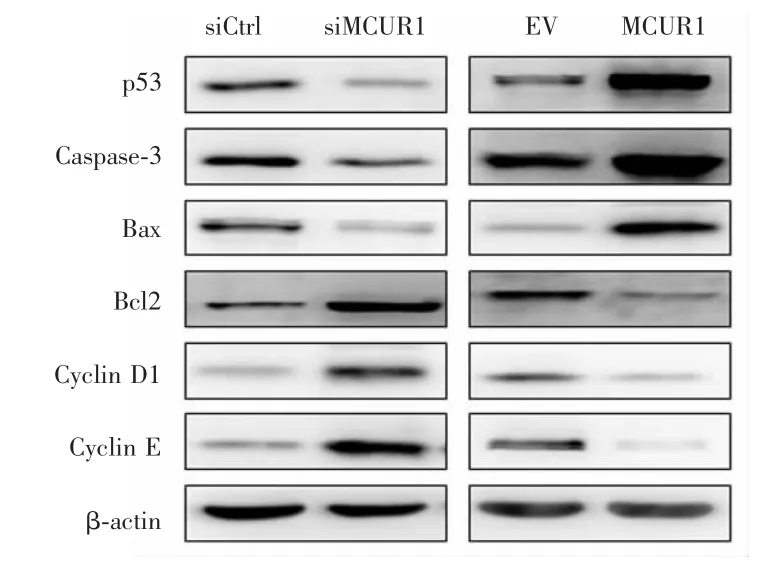
图6 MCUR1对增殖和凋亡相关分子蛋白表达的影响Fig.6 Effect of MCUR1 on protein expression of proliferation-and apoptosis-related molecules
3 讨论
线粒体作为细胞中的主要能量来源细胞器,通过线粒体生物发生、代谢重编程、氧化应激信号通路参与肿瘤细胞生长、生存和转移,与肿瘤恶性进展密切相关[10-11]。Ca2+是细胞内第二信使,可调节基因转录和细胞增殖、迁移和死亡[12]。线粒体代谢功能和Ca2+稳态作为细胞生命活动的重要调控环节,两者密切相关,共同维持细胞生命活动进程[13-14]。1967年CORTASSA等发现,离体线粒体内能大量累积游离Ca2+,后续研究进一步证实线粒体是细胞主要的钙储存场所之一[15]。MCUR1于2012年被MALLILANKARAMAN等通过靶向RNAi技术筛查得到,定位于线粒体内膜上[7]。该研究还报道MCUR1可与线粒体Ca2+单向转运体(MCU)、线粒体钙摄取分子1(mitochondrial calcium uptake 1,MICU1)、MICU2形成复合体,调节线粒体Ca2+转运[16]。但细胞内MCUR1的缺失会导致线粒体Ca2+浓度显著降低(约85%),过表达MCUR1不仅能正向调节MCU的Ca2+摄取效率,显著促进线粒体Ca2+内流,同时也可提高线粒体对胞浆钙离子的缓冲能力。值得一提的是,尽管MCUR1功能的发挥依赖于MCU,但当MCUR1表达缺失,MCU则无法维持正常线粒体Ca2+水平,由此可见MCUR1的表达与功能的发挥是调节线粒体钙稳态的关键[7]。此外,MCUR1在细胞正常生命活动和各种疾病发生发展中起重要作用[17]。MALLILANKARAMAN等[7]发现,HeLa细胞中敲除MCUR1后可阻碍细胞氧化磷酸化过程,导致细胞三磷酸腺苷合成减少及其依赖的蛋白激酶活性降低,最终引起细胞自噬。TOMAR等[18]发现血管内皮细胞敲除MCU及MCUR1后,线粒体生物合成减弱,细胞增殖速度减缓、迁移能力减弱,同时可诱发细胞自噬。REN等[19]发现MCUR1在肝细胞癌中表达显著升高,且MCUR1高表达的患者预后较差,MCUR1升高还会使线粒体对Ca2+的摄取加强,同时抑制线粒体依赖性的细胞凋亡,促进细胞增殖。以上研究说明MCUR1是维持细胞正常生命活动的关键分子,MCUR1异常表达可能通过损害线粒体功能和改变细胞钙稳态损害细胞生长。为了解MCUR1与卵巢癌的关系,本研究首先下载并分析TCGA数据库中有关数据,结果发现MCUR1表达水平越高的卵巢癌患者预后较好,由此初步推测MCUR1可能与卵巢癌密切相关。
随后本研究收集组织标本进行验证,免疫组织化学法检测发现大多数卵巢癌样本MCUR1染色为阴性,MCUR1阳性率仅为25.6%。进一步构建干涉和过表达MCUR1卵巢癌细胞系,通过细胞增殖及构建裸鼠成瘤模型等观察MCUR1表达对卵巢癌细胞增殖和凋亡的影响,发现干涉MCUR1表达后,卵巢癌细胞增殖能力明显增强,裸鼠皮下荷瘤生长速度亦加快,Ki67表达升高,而细胞凋亡能力减弱,说明干涉MCUR1可明显促进卵巢癌细胞生长;反之过表达MCUR1则抑制了卵巢癌细胞及裸鼠皮下移植瘤生长。在分子机制方面,本研究发现过表达MCUR1后,p53蛋白表达升高,p53下游凋亡关键分子Caspase-3和Bax表达升高,而Bcl2表达则降低,周期关键分子Cyclin D1和Cyclin E表达亦降低,提示MCUR1抑制卵巢癌细胞生长可能通过激活p53通路,从而促进线粒体介导细胞凋亡和抑制细胞增殖实现。
本研究结果表明,MCUR1在卵巢癌组织中的阳性表达率较低,而在卵巢癌细胞中干涉MCUR1可抑制卵巢癌细胞增殖,促进细胞凋亡,且可能通过激活p53通路实现。MCUR1可能作为一个抑癌基因,有望为卵巢癌的诊断及治疗提供新思路。未来本课题组将收集更多样本并在多个细胞系重复上述实验,进一步深入研究MCUR1参与卵巢癌恶性进展的机制。

