子宫内膜异位症患者血清TIMP-1、MCP-1、MMP-9水平及与不孕的关系
顾晓荔 吴新华 姬梦鸽 符元元★
子宫内膜异位(endometriosis,EMs)是子宫内膜组织在经期脱落后转移到宫腔以外的其他部位而引发的疾病,育龄妇女的发病比例约占10%左右[1]。经血中的内膜碎片随血液循环转移至盆腔,可导致盆腔黏连、痛经和不孕症的发生[2]。EMs 的发病机制复杂,医学界尚未形成统一的认识,目前广泛得到认可的有是经血逆流-内膜种植学说。子宫内膜组织由宫腔转移到盆腹腔需突破腹水、腹腔细胞和细胞外基质(extracellular matrix,ECM)三道防线,才能完成异位部位的种植和生长[3-4]。因而有研究人员推测,部分细胞因子和活性酶在组织的转移和侵袭过程中发挥了重要作用[5]。相关研究证实,基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)可降解ECM 的胶原蛋白和纤维连接蛋白等成分,破坏ECM 结构的完整性,而基质金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)是其天然抑制物,两者含量的变化对EMs 疾病的发生和进展有密切联系[6]。单核细胞 趋 化蛋 白-1(monocyte chemotactic protein 1,MCP-1)是趋化因子家族中的一员,在EMs 的炎症损伤和盆腔黏连中发挥重要作用[7]。本研究旨在观察EMs 患者血清细胞因子及活性酶水平,为EMs 及相关不孕症的发生及诊断治疗提供数据支持,现汇报如下。
1 资料与方法
1.1 一般资料
选取2016年5月至2018年12月于郑州大学第二附属医院妇产科就诊的EMs 患者102例,根据美国生育协会(revised American Fertility Society,rAFS)分期标准[8],其中Ⅰ期27 例,Ⅱ期29例,Ⅲ期25 例,Ⅳ期21 例。将102例EMs 患者中的54 例不孕患者作为观察组,48 例非不孕患者作为对照组。观察组年龄26~41 岁,平均年龄(30.42±4.20)岁,病程(0.5~8)年,平均(3.86±1.64)年;对照组年龄25~42 岁,平均(30.76±4.55)岁,病程1~7年,平均(3.72±1.60)年。两组患者年龄、病程等一般资料比较无统计学差异(P>0.05)。纳入标准:①符合EMs 诊断标准[9];②所有患者知情且自愿参与实验研究。排除标准:①半年内曾使用激素治疗;②恶性肿瘤患者;③子宫腺肌症患者。
1.2 试剂/仪器
血清基质金属蛋白酶组织抑制因子-1(TIMP-1)、单核细胞趋化蛋白-1(MCP-1)、基质金属蛋白酶-9(MMP-9)试剂盒购自美国ThermoFisher 公司。离心机为德国艾本德公司生产。检测仪器为芬兰Labsystem 公司生产的MK3 型全自动酶标仪。
1.3 实验室检测
1.3.1 样本采集
采集所有研究对象外周血4 mL,3 000 r/min低温离心10 min ,取上层血清置于-80℃冰箱备用。
1.3.2 酶联免疫吸附法检测
将所有患者的备用血清及酶联免疫吸附试剂盒置于常温下复苏。按照说明书要求进行加样,封口后置于37℃恒温箱内孵育,反复冲洗3 次,倒置将孔内残余液体吸干。加入相应抗体,封口后继续孵育,重复上述清洗步骤。加入酶标抗体100 μL,避光孵育30 min,重复清洗步骤。加入底物工作液,孵育15 min,终止反应,使用酶标仪读数。
1.4 治疗方法
两组患者均经腹腔镜病灶切除和粘连分离术治疗,统计两组患者术后血清TIMP-1、MCP-1、MMP-9水平。
1.5 统计学处理
采用SPSS 23.0 件进行数据分析,计数资料用%表示,采用χ2检验,计量资料用()表示,采用t检验,等级比较使用秩和检验;血清TIMP-1、MCP-1、MMP-9水平的相关性分析采用Pearson分析,不孕症的多因素分析采用Logistic 回归分析。以P<0.05差异有统计学意义。
2 结果
2.1 两组患者rAFS 分期、血清TIMP-1、MCP-1、MMP-9水平比较
观察组rAFS Ⅲ期与Ⅳ期患者比例明显高于对照组,血清TIMP-1 水平显著低于对照组;观察组MCP-1、MMP-9水平显著高于对照组,差异有统计学意义。(P<0.05),见表1。
表1 两组患者rAFS 分期、血清TIMP-1、MCP-1、MMP-9水平比较[n(%),(±s)]Table 1 RAFS stages,levels of serum TIMP-1,MCP-1 and MMP-9 in different groups[n(%),(±s)]

表1 两组患者rAFS 分期、血清TIMP-1、MCP-1、MMP-9水平比较[n(%),(±s)]Table 1 RAFS stages,levels of serum TIMP-1,MCP-1 and MMP-9 in different groups[n(%),(±s)]
注:与对照组相比,aP<0.05。
组别观察组对照组n 54 48Ⅰ期0(0.00)a 18(37.50)Ⅱ期1(1.85)a 15(31.25)Ⅲ期18(33.33)a 10(20.83)Ⅳ期35(64.81)a 5(10.42)TIMP-1(ng/mL)205.19±41.31a 308.56±52.19 MCP-1(pg/mL)45.67±5.36a 26.18±4.27 MMP-9(ng/mL)413.56±61.79a 278.19±54.37
2.2 不同分期患者血清TIMP-1、MCP-1、MMP-9水平比较
EMs Ⅰ期患者血清TIMP-1 水平高于Ⅱ期、Ⅲ期、Ⅳ期(P<0.05);随着rAFS 分期的增高,TIMP-1水平呈下降趋势(P<0.05);EMs Ⅰ期患者血清MCP-1、MMP-9水平低于Ⅱ期、Ⅲ期、Ⅳ期(P<0.05);随着rAFS 分期的增高,MCP-1、MMP-9水平呈上升趋势(P<0.05),见表2。
2.3 两组治疗前后血清TIMP-1、MCP-1、MMP-9比较
两组患者治疗后TIMP-1 显著增加(P<0.05),MCP-1、MMP-9水平显著降低(P<0.05),见表3。
2.4 EMs 血清TIMP-1、MCP-1、MMP-9水平的相关性
EMs 患者血清TIMP-1 与MMP-9水平呈强相关(P<0.05);MCP-1 与TIMP-1 水平呈弱相关(P<0.05);MCP-1 与MMP-9水平呈弱相关(P<0.05),见表4。
表2 观察组不同分期患者血清TIMP-1、MCP-1、MMP-9水平比较[n,(±s)]Table 2 Levels of serum TIMP-1,MCP-1 and MMP-9 in patients at different stages in the observation group[n,(±s)]
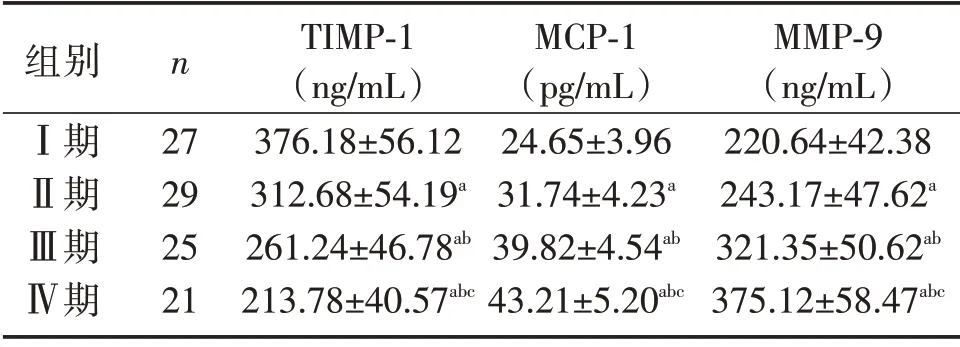
表2 观察组不同分期患者血清TIMP-1、MCP-1、MMP-9水平比较[n,(±s)]Table 2 Levels of serum TIMP-1,MCP-1 and MMP-9 in patients at different stages in the observation group[n,(±s)]
注:与Ⅰ期相比,aP<0.05;与Ⅱ期相比,bP<0.05;与Ⅲ期相比,cP<0.05。
组别Ⅰ期Ⅱ期Ⅲ期Ⅳ期n 27 29 25 21 TIMP-1(ng/mL)376.18±56.12 312.68±54.19a 261.24±46.78ab 213.78±40.57abc MCP-1(pg/mL)24.65±3.96 31.74±4.23a 39.82±4.54ab 43.21±5.20abc MMP-9(ng/mL)220.64±42.38 243.17±47.62a 321.35±50.62ab 375.12±58.47abc
表3 两组治疗前后血清TIMP-1、MCP-1、MMP-9 比较[n,(±s)]Table 3 Serum TIMP-1,MCP-1 and MMP-9 in the two groups before and after treatment[n,(±s)]

表3 两组治疗前后血清TIMP-1、MCP-1、MMP-9 比较[n,(±s)]Table 3 Serum TIMP-1,MCP-1 and MMP-9 in the two groups before and after treatment[n,(±s)]
注:与治疗前相比,aP<0.05。
组别观察组对照组n 54 48 TIMP-1(ng/mL)治疗前205.19±41.31 308.56±52.19治疗后375.24.56±66.19a 364.21±65.12a MCP-1(pg/mL)治疗前45.67±5.36 26.18±4.27a治疗后19.37±4.57a 18.21±4.52a MMP-9(ng/mL)治疗前413.56±61.79 278.19±54.37治疗后222.51±57.22a 219.24±55.71a
2.5 血清TIMP-1、MCP-1、MMP-9水平与不孕症的logistics 回归分析
以是否不孕为因变量,以EMs患者血清TIMP-1、MCP-1、MMP-9水平为自变量进行logistics 回归分析,结果显示,血清TIMP-1、MMP-9 与不孕症的发生具有相关性(P<0.05),见表5。
3 讨论
EMs 虽属于良性病变,但也存在着向恶性转变的可能。脱落的子宫内膜上皮细胞若想发生侵袭转移,EMC 是必须突破的第一道屏障[10]。相关文献证实,具有侵蚀EMC 能力的宫腔内组织才能完成异部位的定植和生长[11]。MMPs 是一类在金属离子辅助作用下发挥生物学活性的蛋白酶。有研究显示,MMPs 可降解EMC 中的胶原、纤维连接蛋白等成分,破坏机体的组织学屏障,在细胞的浸润转移中发挥重要作用[12]。MMP-9 经有机汞激活后,可降解EMC 和重塑其动态平衡[13]。Rai 等人[14]在研究中发现,MMP-9 对EMs 的发生不限于促进EMC 的降解,还具有诱导血管生成的作用。TIMP-1 作为MMP-9 的抑制剂,可特异性的与羧基末端结合后抑制其活性。此外,TIMP-1 还对细胞的增殖和凋亡具有调控作用[15]。陈志华等[16]的研究结果显示,EMs 患者血清MMP-9水平与病情的进展程度密切相关。马艳鸽等[17]在通过靶向沉默COX-2 基因后发现,原代培养的子宫内异症细胞MMP-9 表达水平显著降低,细胞凋亡率显著增加,因而猜测MMP-9 的表达水平可能与内异症细胞的凋亡有关。本研究结果显示随着rAFS 分期的增高,EMs 患者TIMP-1 呈下降的趋势,MMP-9 呈上升的趋势,提示TIMP-1/MMP-9 可能与EMs 的发生和进展存在一定的关联。任威等[18]采用腹腔镜手术联合米非司酮治疗EMs 患者,观察组患者临床症状明显减轻,血清TIMP-1、MMP-9水平较治疗前也显著下降,与本研究结果相符,证实了MMP-9水平与疾病的关联。EMs 患者中合并不孕症的比例高达40%,EMs 可造成孕龄妇女输卵管阻塞、盆腔炎症、黄体功能异常等疾病,给女性的生殖系统造成严重侵害[19]。EMs 患者免疫功能异常,可导致腹盆腔的炎症反应,各种炎性介质和趋化因子呈高表达,造成患者盆腔及腹腔环境的改变,营造有利于宫腔组织种植的环境,损害生殖系统的正常功能,进而导致不孕。本研究中EMs 组血清MCP-1 水平显著高于健康组,且随着疾病的进展,MCP-1 水平逐渐升高,提示MCP-1 在EMs的疾病演化中扮演重要角色。本研究还发现,EMs组中不孕症患者MCP-1 水平显著高于非不孕组,但血清MCP-1 水平与不孕症的发生并无相关。
综上所述,EMs 不孕患者血清TIMP-1 水平显著低于Ems 非不孕患者,MCP-1、MMP-9 高于Ems非不孕患者,且随着rAFS 分期的增高,TIMP-1 表现出下降趋势,MCP-1、MMP-9 表现出升高趋势。血清TIMP-1、MMP-9 与不孕症的发生具有相关性。
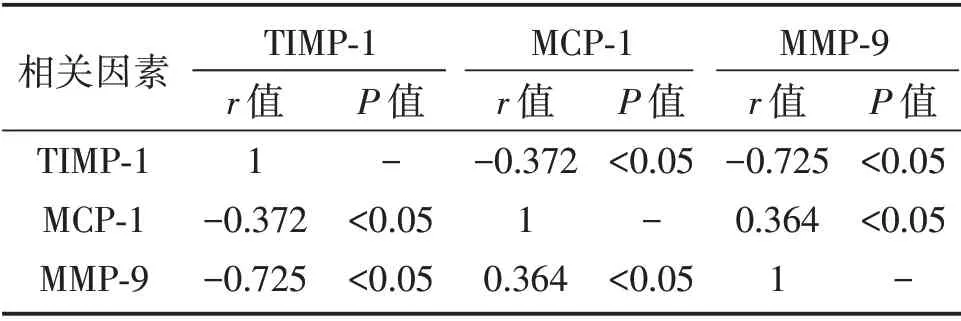
表4 观察组患者血清TIMP-1、MCP-1、MMP-9水平的相关性Table 4 The correlations among serum TIMP-1,MCP-1 and MMP-9 levels in the observation group
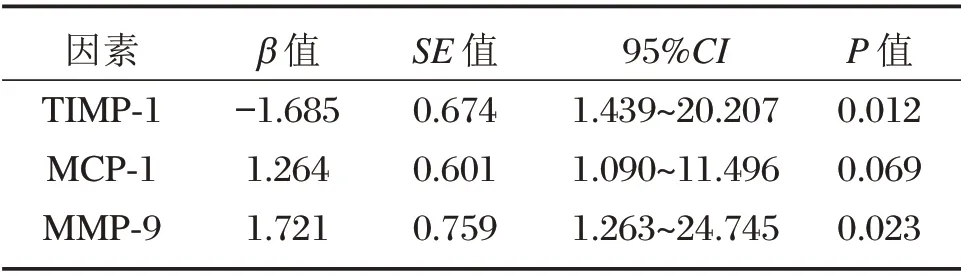
表5 血清TIMP-1、MCP-1、MMP-9水平与不孕症的logistics 回归分析Table 5 Logistics regression analysis of the correlation between serum TIMP-1,MCP-1,MMP-9 levels and infertility

