海南地区571例男性感染HPV的基因型分布特点研究
吕家庆 胡俊杰 符生苗 陈鑫苹★
人乳头瘤病毒(human papilloma virus,HPV)主要通过性接触传播,一般夫妻或性伴侣双方共同发病。女性感染部位主要分布在宫颈、外阴、阴道和肛门,可导致良性乳头状瘤或无乳头状瘤等临床症状,男性除在肛周区域和外生殖器(包括包皮、阴囊、龟头和阴茎)外,尿道、输精管、附睾和睾丸等部位也会发生感染。与女性感染不同,男性感染高危型HPV 通常无明显症状,并且男性感染后不仅有癌变风险还可能会导致男性不育症的发生[1]。临床研究表明女性因HPV感染导致患宫颈癌(cervical cancer)的风险明显受到男性性行为的显著影响,在实际调查中男性感染HPV的现象越来越普遍,导致女性高风险HPV 相关癌症和癌前病变的发病率增加,因此研究男性HPV感染类型对女性宫颈癌的预防和康复治疗都至关重要[2]。本研究对571例男性感染者的HPV 基因型进行统计分析,以明确HPV 基因型在男性感染者中的分布特征,减少男性感染者的传播途径,并降低HPV相关癌变风险。
1 材料和方法
1.1 研究对象
对2014年8月至2018年2月间于海南省人民医院中心实验室进行HPV 基因分型检测并确诊的571例男性患者,年龄范围为16~76 岁,平均年龄(35±9)岁结果进行统计分析,所有待检样本取自男性患者外生殖器的包皮、冠状沟、尿道口及肛周的组织脱落细胞或分泌物,使用一次性生殖道拭子(深圳亚能生物技术有限公司)采集后立即送检,低温保存运送,采集管内样本4℃保存不超过7 天,-20℃保存不超过3 个月,避免反复冻融。
1.2 主要试剂和仪器
亚能生物技术(深圳)有限公司生产的人乳头瘤病毒基因分型(23 型)检测试剂盒(主要组成成份:反应液Ⅰ和反应液Ⅱ、阴阳质控品、膜条、裂解液、链霉亲和素辣根过氧化物酶、3,3′,5,5′-四甲基联苯胺)以及YN-H16 型恒温杂交仪,T100 Thermal Cycler 型基因扩增仪(美国BIO-RAD 公司)。
1.3 方法
1.3.1 DNA 分离提取
取出保存有组织脱落细胞或分泌物的细胞保存液转移至1.5 mL 离心管中,13 000 rpm 离心10 min,弃上清液后,利用细胞裂解液(分离法)提取DNA。
1.3.2 PCR 扩增
分别向装有反应液Ⅰ和反应液Ⅱ的PCR 反应管(规格为20 μL/管)中分别加入5 μL 抽提好的DNA,扩增总反应体系均为25 μL/反应。设置反应条件:50℃15 min;95℃10 min,94℃30 s,42℃90 s,72℃30 s 共40 个循环;72℃5 min。
1.3.3 HPV 基因分型
用人乳头状瘤病毒基因分型检测试剂盒(PCR-反向点杂交法)检测23 种HPV 亚型:6、11、42、43和81(5 种低危亚型);16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82 和83(18 种高危亚型)。主要原理是采用PCR 体外扩增和DNA反向点杂交相结合的HPV 基因分型检测技术,利用HPV的基因特点设计特异性引物,扩增出23 种HPV 基因型的目的片段后,再将扩增产物与固定在膜条上的分型探针进行杂交,根据杂交信号的有无来判读结果。变性产物通过冰盒转移至离心管中并加入杂交液,先沸水浴10 min,再放入杂交箱51℃杂交1.5 h,洗膜和显色后,按照试剂的判读标准判读结果,每组实验阴、阳性质控品均进行同步处理以作对照。
1.3.4 统计学分析
运用SPSS 19.0 软件进行数据分析,单一感染组和多重感染组中各基因亚型频率用%表示、不同年龄段感染HPV的危险类型以及不同危险类型的感染类型的组间使用卡方检验,以P<0.05 为有统计学意义。
2 结果
2.1 HPV 各亚型频率分布
低危型感染较高的基因型有:6 型202(35.38%)、11 型109(19.09%)、42 型58(10.16%);高危型感染率较高的基因型有:52 型76(13.31%)、51 型65(11.38%)、16 型63(11.03%),见表1。单一感染和多重感染(见图1)中HPV 各亚型对比分析显示,多重感染均高于单一感染差异有统计学意义(P<0.05),见图2。
2.2 不同年龄段感染HPV的危险类型
571例男性HPV感染者中,单纯低危型感染率为38.18%,单纯高危型感染率为34.15%,高低危混合型感染率为27.67%,2 组间感染率差异无统计学意义(P>0.05),但2 组的感染率均高于高低危混合型组(P<0.05)。不同年龄组之间HPV感染率总体比较,21~30 岁组和31~40 岁组的HPV感染率最高(P<0.05),分别为33.98%和34.15%。不同感染类型的各年龄段之间HPV感染率比较,单纯低危型中21~30 岁组和31~40 岁组感染率最高(P<0.05),均为13.84%,2 组间比较无明显差异(P>0.05);单纯高危型中31~40 岁组的感染率为12.61%,高于其它年龄组(P<0.05);高低危混合型中21~30 岁组的感染率为10.16%,高于其它年龄组(P<0.05),见表2。
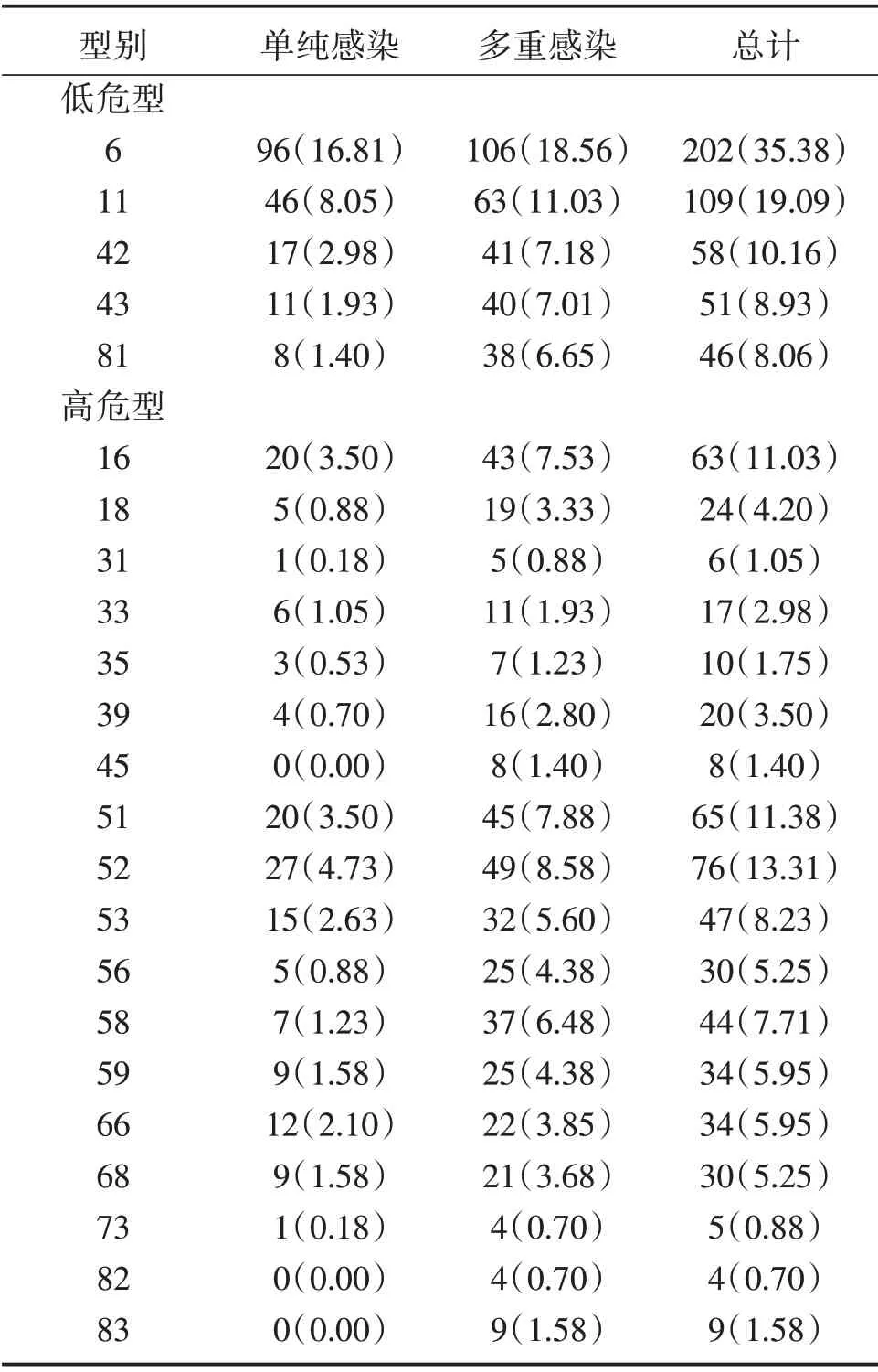
表1 HPV 各亚型分布情况[n(%)]Table 1 Frequency distribution of HPV subtype[n(%)]

图1 不同感染类型的基因检测结果Figure 1 Genetic test results for different infection types
2.3 不同HPV感染类型分布
不同感染类型中单一感染有322 人,占56.39%,多重感染有249 人,占43.61%,单一感染的感染率高于多重感染(P<0.05)。随着感染重数的增加,单纯低危型、单纯高危型和高低危混合型的感染率均呈下降趋势(见图3),其中单一感染中,单纯低危型占31.17%,单纯高危型占25.22%,单纯低危型感染率高于单纯高危型(P<0.05);多重感染中,二重感染和三重感染的感染率最高,分别为25.22%和9.98%,且高低危混合型组感染率高于单纯低危型组或单纯高危型组(P<0.05),见表3。
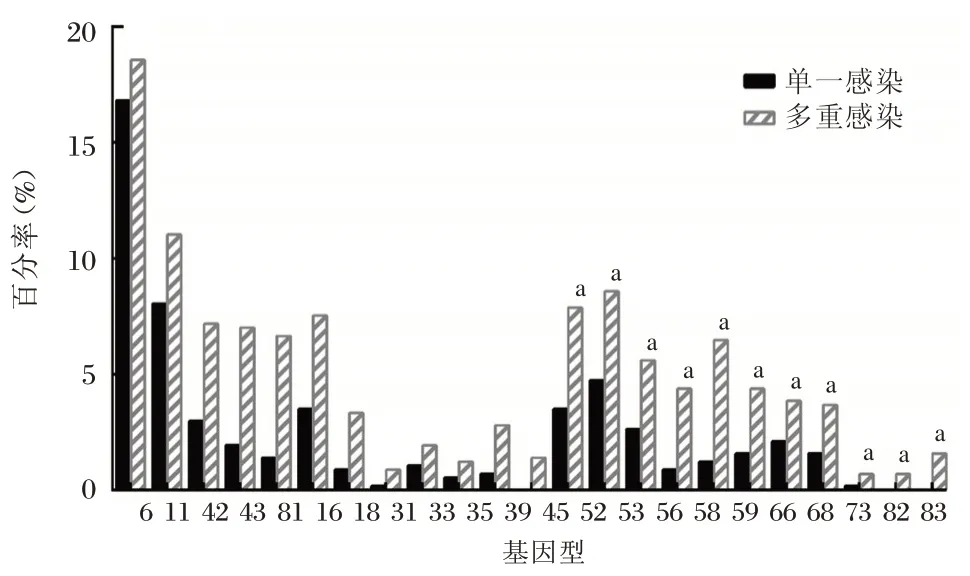
图2 单一感染和多重感染中HPV 各亚型频率分布Figure 2 Distribution of HPV subtypes in single infection and multiple infections
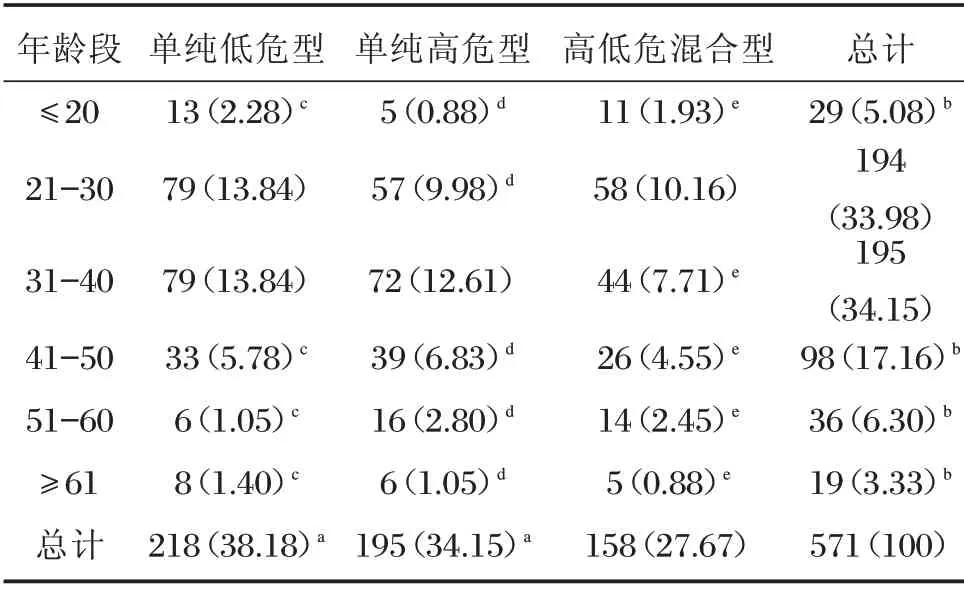
表2 不同年龄段感染HPV的危险类型[n(%)]Table 2 Types of hazards infected with HPV at different ages[n(%)]
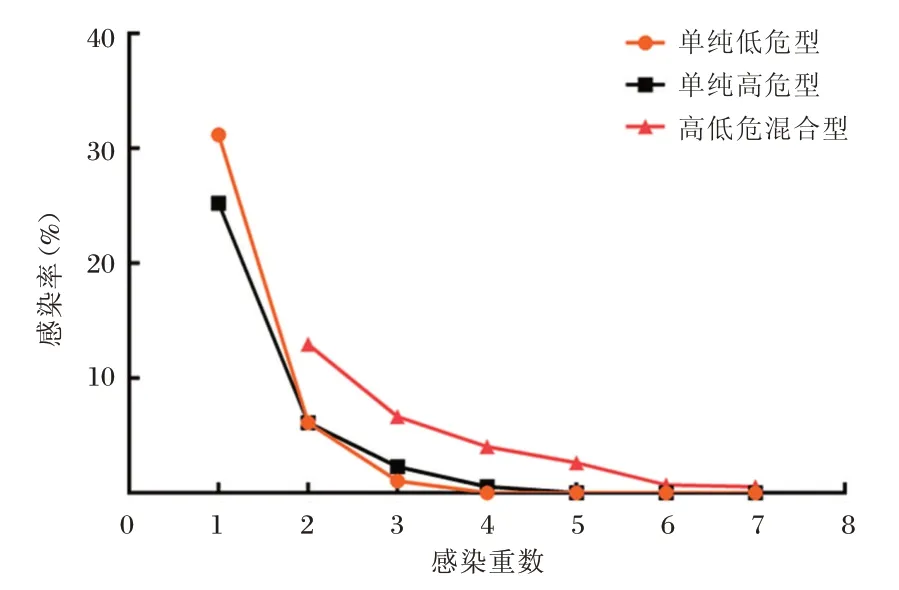
图3 不同感染类型的感染率分布情况Figure 3 Distribution of infection rates for different infection types
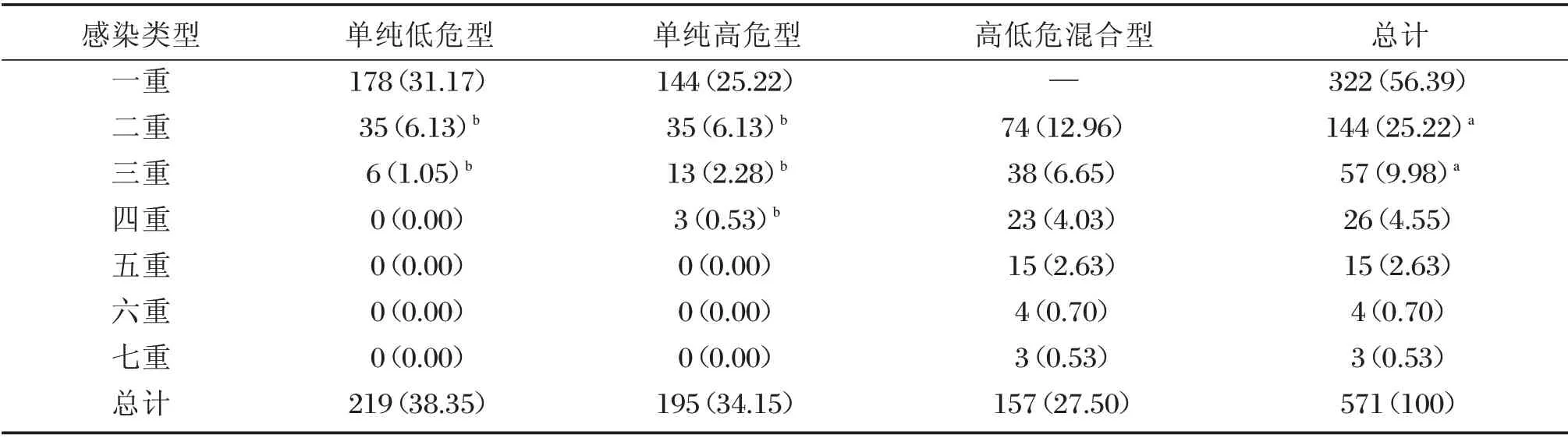
表3 不同HPV感染类型分布n(%)Table 3 Distribution of different HPV infection types n(%)
3 讨论
HPV 是一类嗜上皮性的双链DNA 病毒,已经确定的HPV 基因型达200 多种,根据其致癌性将粘膜型HPV 分为高风险型(high risk,HR)和低风险(low risk,LR)型,而HR-HPV的持续感染是导致正常上皮转变为癌前病变和癌变的主要原因[3]。据统计,宫颈癌和其他肛门生殖器癌症的发生率约占全球癌症总发生率的5%,并且已经证实这类疾病与HR-HPV感染密切相关[4]。此外研究资料还显示全世界约70%的宫颈癌患者是由HPV16 和HPV18感染引发,约60%的口咽癌发生是与HPV16 和宿主细胞染色体整合造成持续性感染有关[5]。
近年来,随着高特异性HPV 基因分型检测技术的推广,HPV感染检出率逐渐上升,但由于地区、人口组成、采样周期和测试方法的差异,导致研究结果可能存在偏差。LR-HPV感染分布中,本研究结果显示HPV6 和HPV11 感染频率分别为35.38%和19.09%,为男性群体中主要的LR-HPV感染类型,与黄泽棋等人[6]在广东地区的研究显示HPV6 和HPV11 为主要感染基因型的研究结论相似。而与LR-HPV感染相关的许多良性皮肤疣、粘膜病变和低度宫颈上皮内病变都会产生相当大的健康负担[7]。HR-HPV感染分布中,田欣欣等人报道HPV16、52、58 和18 是国内多个地区男性群体中主要的HR-HPV 类型,其中HPV16 被发现与异常细胞学检测的关联度最高,其次是HPV58、18、52,并且感染类型和感染率存在区域差异性[8]。本研究结果中HPV16、52、58 和18 的感染率依次为11.03%、13.31%、7.71%和4.20%,其中HPV16 和HPV52 的感染率最高,且多重感染类型中HPV 各亚型频率均高于单一感染,与田欣欣的研究结果比较本研究中男性HPV 多重感染中各亚型分布具有范围广、基因型复合程度和携带率较高等特点。不同年龄段的HPV感染结果显示,≤20 岁组中呈现初始的感染状态,21~40 岁组中感染率最高,40岁以上组感染率呈下降趋势,此结果可能与21~40岁组男性处于性生活活跃期而导致HPV感染几率增加有关。据报道[9]由HPV 引起的宫颈癌是中低收入国家孕期妇女(年龄为20~40 岁)发病率和死亡率的主要原因,每年约有50 万新病例和266 000人死亡,处于性活跃期的男性群体增加了HPV 通过性传播途径传染给女性的可能。此外21~60 岁组中HPV 高危型(包括单纯高危型和高低危混合型)携带率高于单纯低危型,表明男性人群中HRHPV感染较为常见,这不仅增加了自身癌变的潜在风险同时也增加了其性伴侣的感染和癌变机率。
虽然多重感染影响生存的具体原因还不完全清楚,但多种HPV 基因型的存在可能增加持续性感染的长度和致癌风险。所以HPV 多重感染的流行特征对宫颈癌的发生以及持续感染患者的预后有重要意义,通过HPV 基因分型检测可以对患者的生存质量进行预测[10]。本研究男性感染者中二重感染和三重感染的人数最多,并且随着感染重数的增加,不同类型的感染率均呈下降趋势。此外高低危混合型组感染率高于单纯低危型组或单纯高危型组,表明男性HPV 多重感染中以高低危混合型为主且感染谱较广,可能增加CA 和高度癌前病变的发生风险以致对患者的治疗及预后产生影响。
用HPV 疫苗进行大规模免疫接种能够降低HPV感染率,自2007年以来国外许多中低收入国家已经通过HPV 疫苗接种试点,同时许多示范项目和国家项目都获得了HPV 疫苗接种经验[11-12]。研究报道目前还没有较为成熟的男性HPV 相关癌症的筛查方案,而男性感染者往往会增加前列腺癌、肛门癌和口腔癌的风险,尤其男男性接触者的发病率明显高于其他人[13-15]。虽然各国正试图将HPV 疫苗扩大到男性人群中使用,且有研究报道[16]HPV 疫苗接种对男性具有保护作用,但监测HPV疫苗对男性癌症发病率的影响将需要相对较长时间观察。而HPV感染导致的非宫颈癌有关癌症往往其发病中位年龄较大,同时在样本规范收集和不同人群诊断和筛查等方面也面临较多困难,所以给男性HPV 疫苗接种研究带来阻碍[17]。例如Tatar 等人[18]进行的一项加拿大大学生(主要为男性群体)对接种HPV 疫苗的认识调查中,结果显示研究对象中大多数人并不知道HPV 疫苗能给予男性使用,也均未接种过男性HPV 疫苗,该群体的调查结果尚且如此,其他男性群体的了解程度可能会更低。本研究结果为男性群体的HPV 检测、治疗和疫苗接种提供了流行病学依据,对降低男性HPV感染率和癌变发生风险具有一定的参考价值。

