LPS对人牙周膜成纤维细胞中骨唾液蛋白和白细胞介素-8表达的影响的研究
武月霞,司姗姗,张 昕,连克乾
(1.南方医科大学口腔医院番禺院区正畸科,广州 511400;2.中山大学附属第一医院口腔科,广州 510080;3.南方医科大学口腔医院番禺院区牙体牙髓科,广州 511400;4.南方医科大学口腔医院番禺院区种植修复科,广州 511400)
牙周炎是一种以多种炎症反应为特征的慢性炎症性疾病,包括牙槽骨,牙骨质,牙周膜(PDL),牙龈组织等牙周组织的破坏,这也是导致牙齿脱落的主要原因[1]。革兰氏阴性厌氧菌,如牙龈卟啉单胞菌(Porphyromonas gingivalis),被认为造成成人慢性牙周炎的重要原因[2],而革兰氏阴性细菌细胞壁的主要成分脂多糖(LPS),被证明是造成牙周病的重要危险因素[3]。在不同的革兰氏阴性菌种中LPS的组成成分不同。 LPS能够增加成骨细胞炎性溶骨因子(如前列腺素E2)的释放速率,从而间接刺激骨吸收[4]。
TLRs是先天性抗微生物和炎症反应的关键介质,并在适应性免疫应答中发挥重要作用。有研究表明LPS通过与病原体相关的模式分子结合转导信号,从而介导Toll样受体(TLR)[5]。然而,当在感染过程中TLR被过度激活或不适当地控制时,可能会造成炎性相关疾病例如牙周炎的发生[6]。尽管如此,成骨细胞和破骨细胞表达TLR并且通过TLR刺激的破骨细胞生成而被激活表明TLR可能将炎症与骨代谢相联系[7]。TLRs有很多种表型,文献报道,TLR2不仅参与LPS的信号转导,还能识别分枝杆菌和革兰氏阳性菌的脂磷壁酸和脂蛋白受体[8]。研究显示在牙周炎病变中有TLR2的上调[9]。然而,牙周炎疾病中人骨细胞TLR2的表达水平和作用尚不清楚。
生理性骨重塑被骨形成和骨吸收之间的平衡控制。骨唾液蛋白和白细胞介素-8(IL-8)是与骨代谢密切相关的两种主要蛋白。骨涎蛋白基因表达的调节在成骨细胞的分化、骨基质矿化和肿瘤转移中具有重要作用[10]。IL-8被证明与多种疾病密切。它是一种重要的促炎细胞因子和免疫调节因子,能够诱导破骨细胞分化成熟,从而维持牙周组织破骨细胞吸收活性。研究表明IL-8基因的表达能够被多种刺激激活,从而诱导不同的信号转导途径。IL-8不仅能够抑制成骨细胞的碱性磷酸酶活性,而且还可以作为破骨细胞分化和骨吸收的直接的刺激物[11]。
有文献报道,0.1mg/L LPS能够减少大鼠成骨细胞样细胞中骨唾液蛋白mRNA的水平,而0.01mg/L LPS能够增加大鼠成骨细胞样细胞中骨唾液蛋白mRNA的表达[12]。但其具体机制尚不清楚,本研究拟体外培养人牙周膜成纤维细胞,并进一步探讨LPS调节人牙周膜成纤维细胞骨唾液蛋白和IL-8表达的相关机制。
1 材料与方法
1.1 仪器和试剂DMEM培养基(Gibco,美国);胎牛血清(Gibco,美国);胰蛋白酶(Gibco,美国);Lipofectamine 2000(Invitrogen,Grand Island,NY,美国);LPS(Invivogen,San Diego,CA,美国);小干扰RNA(siTLR2)(GCU GAUGCC GCU GAU GCC AdTdT-)(锐博生物,中国广州);对照siRNA(siNT)(Control)(GCU GAUGCC GCU GAU GCC AdTdT-)(锐博生物,中国广州);EXScript RT reagent Kit 和SYBR Premix Ex Taq(QIAGEN,Tokyo,Japan);Beta-actin(Santa Cruz Biotechnology,美国);hPDLFs(上海中科院细胞库);RT-PCR仪(Bio-rad,美国)引物由软什primer5设计,Invitrogen公司合成。
1.2 方法
1.2.1 细胞培养与铺板hPDLFs培养于含10% FBS和1%青链霉素的DMEM培养基中,每两天换液一次,培养2~3周。然后用矿化诱导培养基(不含酚红的MEM,10%FBS,10-8μM地塞米松,10 mMβ-甘油磷酸,50μg/mL抗坏血酸)替换第三代粘附诱导细胞培养基,以刺激hPDLFs的成骨分化。然后将细胞接种于六孔板中,每组三个复孔,每孔4万个细胞。贴壁培养24h后,更换MEM培养基(含1%青链霉素,无血清)继续培养12h。
1.2.2 浓度依赖性实验和时间依赖性实验用培养基将LPS稀释成不同浓度(0.1、1、10 和 50 mg/L),然后加入孔板中孵育8h进行浓度依赖性实验;选取10mg/L LPS浓度LPS加入孔板中孵育0、2、4、8、12小时,进行时间依赖性实验。实验终点时,弃去培养基,PBS清洗3遍,采用RNeasy Mini Kit和RNase-Free DNase Set试剂盒抽提细胞总RNA,检测基因浓度及完整性,经逆转录反应合成相应cDNA,以β-actin为内参基因。配制real-time PCR 20μL反应体系,进行qRT-PCR检测(反应参数均根据试剂盒使用说明),反应完成后进行扩增曲线和熔解曲线分析。引物序列见表1。

表1 引物序列表
1.2.3 siRNA 转染实验当hPDLFs达到指数生长状态时用于转染实验。将细胞铺与六孔板中,每孔4万个细胞,但细胞密度达到50~70%时开始转染实验。将siTLR2或siNT与Lipo2000共孵育15~20 min后,加入孔板中,转染浓度为20nM,具体转染步骤见试剂盒说明书,无血清培养基转染24h后,更换含血清培养基继续培养12h,然后加入10mg/mL LPS继续培养8h,对照组不加LPS刺激。实验终点时提取总RNA,q-RT-PCR检测骨唾液蛋白和IL-8 mRNA水平。
1.3 统计学分析所有实验从复独立进行三次。采用Graphpad Prism 5.0 进行作图,SPSS 17.0软件进行统计分析,行单因素方差分析,以LSD法进行两两比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 LPS调节骨唾液酸蛋白mRNA的表达通过qPCR检测不同LPS浓度(0.1、1、10 和 50 mg/L)刺激和刺激不同时间(0、2、4、8、12h)后hPDLFs的骨唾液酸蛋白mRNA的表达水平,结果如图1和图2所示。由图1可知,在于LPS孵育8h后,除0.1mg/mL LPS显著增加hPDLFs的骨唾液酸蛋白mRNA的表达外,随着LPS浓度的进一步增加,骨唾液酸蛋白mRNA的表达逐渐显著降低。图2表明,骨唾液酸蛋白mRNA的表达随着LPS刺激时间的延长,逐渐降低,8h时有最低值,进一步增加刺激时间,骨唾液酸蛋白mRNA的表达不再降低,结果具有显著性差异。

图1 不同浓度LPS对骨唾液酸蛋白mRNA的影响
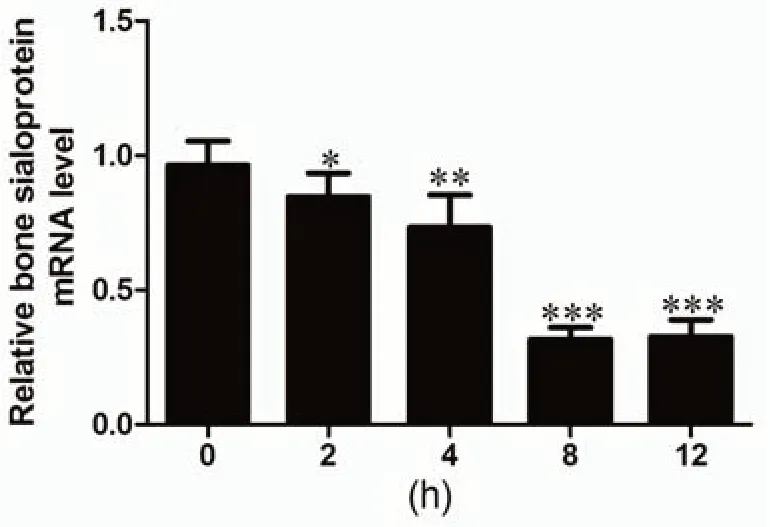
图2 LPS处理不同时间对骨唾液酸蛋白mRNA的影响
2.2 LPS调节IL-8 mRNA的表达通过qPCR检测不同LPS浓度(0.1、1、10 和 50 mg/L)刺激和刺激不同时间(0、2、4、8、12h)后hPDLFs的IL-8的表达水平,结果如图3和图4所示。由图3可知,随着LPS浓度的增加,hPDLFs的IL-8的表达显著增加,具有浓度依赖性,当LPS浓度为10mg/mL时,IL-8的表达有最高,进一步增加LPS浓度,hPDLFs的IL-8的表达不再增加。由图4可知,随着刺激时间增加,hPDLFs的IL-8的表达水平也显著升高,8h时有最大值,进一步增加刺激时间至12h时,IL-8的表达水平显著减少。实验结果具有统计学差异。
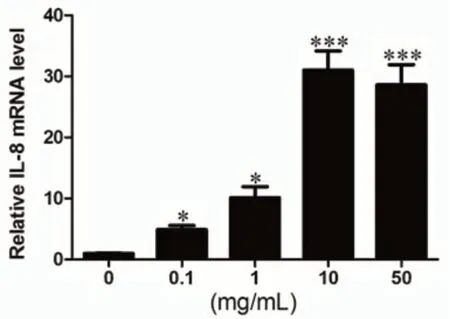
图3 不同浓度LPS对IL-8 mRNA的影响

图4 LPS处理不同时间对IL-8 mRNA的影响
2.3 siTLR2对LPS调节骨唾液酸蛋白和IL-8 mRNA表达的影响为进一步探讨LPS调节骨唾液酸蛋白和IL-8 mRNA表达的相关机制,本研究采用siTLR2转染hPDLFs,qPCR检测TLR2 mRNA表达水平,结果见图5。结果表明siTLR2能够显著抑制TLR2 mRNA的表达。采用siTLR2和LPS共处理hPDLFs,qPCR检测骨唾液酸蛋白mRNA和IL-8 mRNA的表达情况,结果见图6和图7。由图6可知,siTLR2转染过后,完成废除了LPS抑制骨唾液酸蛋白mRNA的表达的作用,反而增加了骨唾液酸蛋白mRNA的表达。由图7可知,siTLR2转染同样完全废除了LPS增加IL-8 mRNA水平的作用,反而显著降低IL-8 mRNA的表达。实验结果表明TLR2在LPS调节骨唾液酸蛋白和IL-8 mRNA表达的作用中起到关键调节因子的作用。LPS可能通过调节TLR2的表达从而影响唾液酸蛋白和IL-8 mRNA的表达。

图5 LPS处理不同时间对IL-8 mRNA的影响(***P<0.001)
3 讨论
LPS作为革兰氏阴性细菌细胞壁的一种成分,具有非常高的毒性和抗原性,在牙周病的发生发展中起到关键的作用。研究表明LPS不仅能够直接诱导炎症反应,还能够通过成骨细胞的作用间接影响牙槽骨吸收,并直接作用于破骨细胞[13]。在本研究中,我们研究了LPS调节骨唾液蛋白和IL-8 mRNA表达的作用。并且采用具有干细胞和多向分化潜能的特点的hPDLFs进行相关实验[14]。

图6 siTLR2对LPS调节骨唾液酸蛋白mRNA表达的影响

图7 siTLR2对LPS调节IL-8 mRNA表达的影响(**P<0.01)
有文献报道,在ROS17/2.8细胞上,高剂量LPS能够降低骨唾液蛋白的表达,而低剂量LPS能够增加骨唾液蛋白的表达[12]。本研究中,LPS能够浓度依赖性的调节hPDLFs中骨唾液蛋白的表达,而且。高剂量LPS(10mg/mL)刺激8h显著上调hPDLFs中IL-8的表达水平。这些研究结果表明LPS能够同时调节骨唾液蛋白和IL-8的转录水平。
LPS能够通过TLR2通路激活上皮细胞和内皮细胞,提示LPS可能在TLR表达的细胞中充当TLR2的激动剂[15]。有文献报道0.01mg/mL LPS能够ROS17/2.8细胞中TLR2 mRNA的表达。本研究中,我们之间用siRNA去敲除TLR2,研究表明siTLR2显著废除了LPS调节骨唾液蛋白和IL-8 mRNA表达的作用。siTLR2单独作用能够显著增加骨唾液蛋白mRNA的表达,可能原因为siTLR2同时能够影响其他调节骨唾液蛋白mRNA表达的蛋白或细胞因子,具体机制有待进一步研究。有研究报道,IL-8对破骨细胞分化和骨吸收的刺激作用依赖于破骨细胞表面上的特异性IL-8受体(CXCR1)[16]。单核细胞驱动的树突状细胞能够被TLR的下游信号分子IL-8所调控[17],进一步揭示的IL-8和TLR之间的联系。本研究进一步证实了这一联系。
本研究揭示了LPS对骨唾液蛋白和IL-8 mRNA的调节作用,而且这种作用可能与其直接调节TLR2的表达有关。

