不同核苷(酸)类药物治疗慢性乙型肝炎患者发生原发性肝癌危险因素分析
饶建国,杨 健,余 龙,高乾峰
(安徽医科大学附属六安医院感染科,六安 237000)
慢性乙型肝炎(chronic hepatitis B,CHB)是由乙型肝炎病毒(hepatitis B virus,HBV)感染引起的较为常见的感染性疾病,全世界约有3.7亿HBV感染者[1]。据中国疾病预防控制中心统计,我国约有9000万HBV携带者,其中2800万为CHB患者[2]。由CHB所引发的原发性肝癌(PLC)导致每年约70万人死亡[3]。核苷(酸)类药物(NAs)是当前临床上治疗CHB常用的药物之一,作用强,患者耐受性好,给药方便[4]。有研究表明核苷(酸)类药物在抗病毒治疗过程中能抑制HBV复制,延缓CHB疾病的发展[5],显著降低CHB患者发生PLC风险,但核苷(酸)类药物治疗仍不能消除发生PLC[6-8]。女性PLC的发病率显著低于男性[9,10]。PLC的临床特点为恶性程度高、转移发生率和治疗后复发率较高,多数患者确诊后已发展为进展期,错过了手术治疗的机会[11,12]。本研究随访观察了我院诊治的100例CHB患者在接受不同核苷(酸)类药物治疗过程中,PLC的发生情况及其相关的危险因素。
1 资料与方法
1.1 一般资料2010年1月~2018年1月安徽医科大学附属六安医院感染科诊治的CHB患者1400例,男性758例,女性642例;年龄25~76岁,平均年龄为(47.2±7.6)岁。符合慢性乙型肝炎防治指南的诊断标准[13],排除标准:其他类型病毒性肝炎、肝硬化、自身免疫性、药物性、代谢性肝病;排除近期应用过α-干扰素或免疫抑制剂等治疗者。患者给出知情同意书,本研究经我院医学伦理委员会审核通过。
1.2 原发性肝癌的诊断标准①肝脏占位病灶或肝外转移灶活检或手术切除组织标本确诊为PLC;②电子计算机断层扫描或磁共振显示为肝脏占位特征性变化;③肉眼可见血性腹水或腹水中存在癌细胞;④血清AFP>400mg/mL持续一个月或>200mg/mL持续两个月。
1.3 治疗方法自研究开始,分别给予拉米夫定、恩替卡韦、阿德福韦酯或替诺福韦治疗。
1.4 研究方法入组患者均参加问卷调查,内容包括性别、年龄、酗酒史、吸烟史、乙型肝炎家族史、PLC家族史、抗病毒治疗情况、糖尿病史、酗酒史。
1.5 检测方法收集患者清晨空腹肘静脉血5mL,HBV DNA检测采用乙型肝炎病毒(DNA)检测试剂盒(厦门海菲生物技术有限公司),采用全自动生化分析及配套试剂(DXC-600,美国贝克曼公司)进行血清指标ALT,AST的检测。校验品和质控品由罗氏公司提供并进行把控。ALT和AST分别通过丙酮酸氧化酶法和免疫抑制法进行检测,采用酶联免疫吸附法进行HBV标志物检测(上海万泰生物有限公司提供)。
1.6 统计学方法应用SPSS 20.0统计学软件分析数据,计数资料以百分比(%)表示,采用χ2检验,计量资料以mean±SD表示,采用t检验,采用Logistic回归分析肝癌发生的危险因素,P<0.05表示差异有统计学意义。
2 结果
2.1 患者临床资料1400例CHB患者中发生PLC患者84例,男性49例,女性35例,年龄34~76岁,平均(46.5±7.4)岁;HBV DNA低于检测下限~5.93lgIU/mL,中位数3.08lglU/m;ALT(75.73±56.71)U/L;AST(84.9±50.72)U/L。
2.2 CHB患者发生PLC的单因素分析单因素分析患者PLC家族史、性别、抗病毒治疗、酗酒史、吸烟史、肝硬化程度、HBeAg表达状态、HBV DNA定量水平、年龄、乙肝家族史、糖尿病史;结果显示,男性、年龄≥41岁、未抗病毒治疗、肝硬化程度、HBV DNA水平、有PLC家族史与PLC发生有关,两组比较差异有统计学意义(P<0.05);在酗酒史、吸烟史、HBeAg、乙肝家族史、糖尿病史差异无统计学意义(P>0.05),见表1。
2.3 CHB患者发生PLC的多因素Logistic回归分析
以性别、年龄、肝硬化程度、不同药物抗病毒治疗情况、未抗病毒治疗、HBV DNA定量高水平、PLC家族史为协变量,是否发生PLC为因变量,多因素Logistic回归分析。结果显示,年龄≥41岁、未抗病毒治疗、PLC家族史、肝硬化程度是发生PLC的危险因素,但在接受不同核苷类抗病毒治疗药物,也会发生PLC,其中拉米夫定治疗组、阿德福韦酯治疗组、替诺福韦治疗组组与恩替卡韦治疗组相比(OR=2.150、1.235、1.951,P值0.002、0.000、0.002)。与无肝硬化比,肝硬化患者Child-Pugh A级、B级、C级(OR=17.688、2.162、12.157,P=0.008,0.001,0.006)。CHB患者性别及HBV DNA水平的高低不是发生PLC的独立因素,见表2。
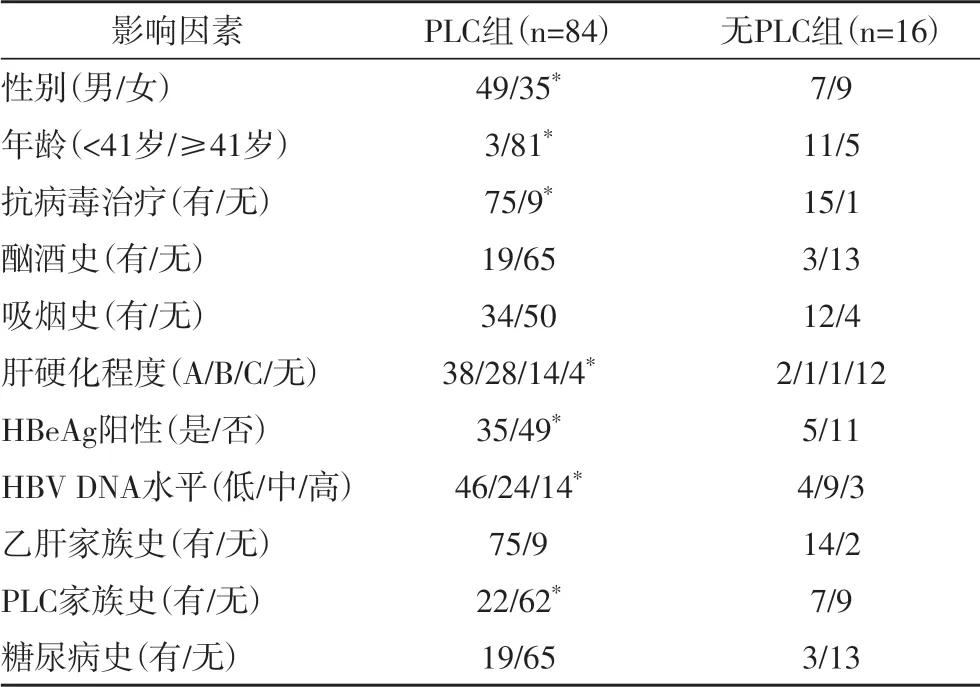
表1 发生PLC的单因素分析(例)
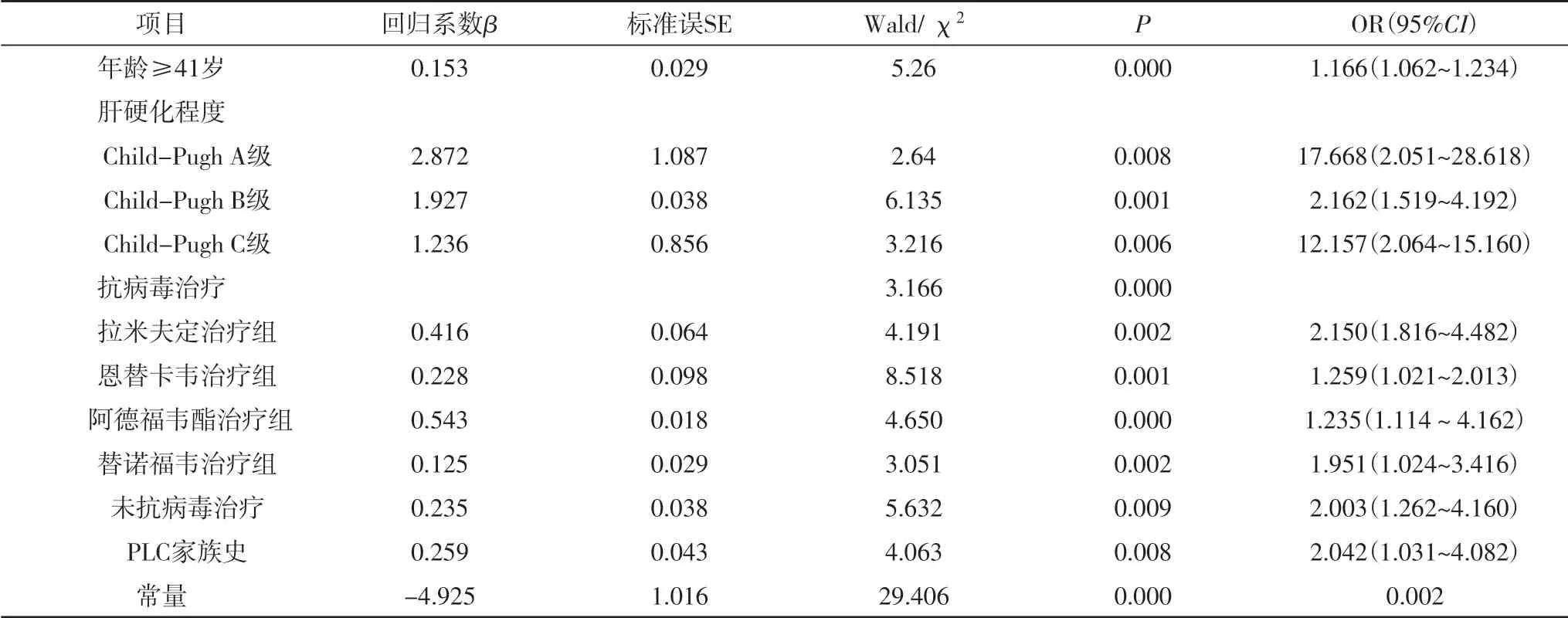
表2 发生PLC的多因素Logistic分析
3 讨论
3.1 有研究表明乙型肝炎病毒(HBV)持续感染者(包括乙肝病毒携带者、慢性乙型肝炎患者)PLC(Hepatocellular carcinoma,HCC)的发病率显著升高[14,15,16]。虽然HBV介导恶性转化的发病机制仍未完全弄清楚,但越来越多的证据表明,乙型肝炎病毒基因组区X区编码蛋白(hepatitis B virus X protein,HB)在HBV相关的HCC发生过程中起十分关键的作用[17]。研究发现,HBx基因突变与HCC发生有关。HBV基因中,PreS突变、C1635T、T1735V和A1762T/G1764A 与HCC患病率的增加有关[18,19],且可使HBx突变体表达。这些突变体是慢性乙肝患者肝纤维化和HCC进展的重要指标,可能通过促进HCC细胞系的细胞增殖、细胞周期调控基因中增殖相关基因的表达增强、胞内ROS表达,以及线粒体去极化参与宿主细胞的异常增殖和肝癌发生[20]。研究表明,在86.4%的HCC患者的癌组织中检测到HBV DNA,显著高于癌旁组织(30.7%)[21]。HBV DNA的通过改变内源性基因功能或导致宿主细胞染色体不稳定进行整合,最终导致HCC的发生[22]。由细胞毒性T淋巴细胞介导的肝脏炎症,导致细胞内遗传物质损伤的累积,从而促进肝癌的发生[23]。
在HBV DNA整合过程中,小部分逆转录环节需要依靠自身的DNA聚合酶,大部分是需要宿主的酶活性。所以阻断HBV的逆转录过程为当前抗病毒治疗的主要环节[24]。核苷(酸)类药物抗病毒治疗,可降低HBV DNA载量,改善肝脏炎症,降低HBeAg滴度的作用来降低HCC发生的风险[25]。虽该类药物对乙型肝炎病毒(HBV)复制功能具有较强的抑制作用,但却难以清除闭合环状DNA,多面临停药复发的风险[26]。在慢性乙肝患者中,可通过获取清除效果的方式,中断HBV-DNA复制功能,但转移率相对较低,1年内<3.0%[27,28]。
3.2 影响因素分析结果
已有证据表明≥41岁、男性、高HBV DNA载量、肝硬化程度、高水平HBeAg均为HCC发生的危险因素[29]。本研究中患者年龄≥41岁与<41岁患者相比,发生HCC的风高,CHB患者年龄>41岁是发生HCC的独立危险因素。无肝硬化患者比,肝硬化程度不同的患者中Child-PughA级、B级、C级,发生HCC的可能性显著增加,由此表明,肝硬化程度是发生HCC的危险因素。HCC发生的独立危险因素还包括血小板计数(Platelet count)和静脉曲张破裂出血史[30]。肝硬化代偿期表现为血小板计数下降、静脉曲张出血,此类CHB患者大多为Child-Pugh B级、C级,提示Child-Pugh B级或C级是发生HCC的独立因素。本研究中,不同核苷类抗病毒治疗组与未接受治疗相比,接受治疗的CHB患者发生HCC风险降低;本研究结果表明,阿德福韦酯组发生HCC的风险最大,其次是拉米夫定组,恩替卡韦组与替诺福韦组发生HCC的风险性显著低于阿德福韦酯组与拉夫米定组。但长期应用NAs治疗CHB,是否能降低HCC发生率还有进一步的研究。规范的NAs治疗CHB可显著改善患者预后,延长生存时间,但是对于NAs治疗与HCC的发生之间的具体关系还有待进一步考证。
本研究中结果显示,HCC家族史也是发生HCC的独立危险因素,此类CHB患者在HBV的作用下,更容易发生HCC;但HCC的发生与高水平HBV DNA、糖尿病史无显著相关性,且HBeAg阴性患者多,可能是患者通过自身免疫将HBV DNA水平降低,每个患者的血糖情况及降糖药物的使用不同,及在CHB发展中HCC患者的HBeAg血清实现了转换。
综上所述,本研究中不同核苷(酸)类药物治疗慢性乙型肝炎患者发生PLC的危险因素主要有年龄≥41岁、肝硬化程度、未接受NAs抗病毒治疗、HCC家族史;在接受NAs抗病毒治疗中,拉米夫定与阿德福韦酯药物发生HCC的相关性大。本文的研究也存在着许多不足之处,例如样本量太少,选取样本的时间跨度大等,以上结果还需要扩大样本进一步验证。

