小细胞肺癌卵巢转移临床分析1例
郝琳琳,刘忠山,林 霞,郭 杰
(吉林大学第二医院 放疗科,吉林 长春130041)
1 临床资料
患者,女,46岁,因“咳痰咳血、呼吸困难加重,抗生素治疗无效”就诊,入院查体:一般状态尚可,因呼吸困难活动受限,被迫坐位,以腹式呼吸为主,右肺门部叩诊浊音,右肺上叶听诊闻及呼气相哮鸣音。胸部CT(2018-08-06):右肺上叶前段支气管开口闭塞,右肺上叶肺门旁见团块状软组织密度影,与纵膈分界欠清,CT值33Hu,最大层面约5.7 cm×5.0 cm。纵隔内见类圆形软组织密度影,直径2.6 cm,右侧胸腔见少量积液(图1)。支气镜下活检(2018-08-09):(右肺上叶)结合形态学特征及免疫组化染色结果支持小细胞癌。免疫组化染色结果:CgA(-),Syn(-)、CD56(-)、Ki67(阳性率60%)、CK(AE1/AE3)(局灶+)、TTF(+)、LCA(-)。神经元特异性烯醇化酶(NSE):24.70 ng/ml(正常参考范围0-15 ng/ml)。全腹CT及头部核磁检查无异常。治疗方案定为第2周期诱导化疗后行根治性胸部放疗联合同步化疗。具体为:依托泊苷120 mg,d1-d3;洛铂50 mg,d1(EP方案),每3周重复,共6周期。胸部放疗与第3周期化疗同时开始,靶区剂量:PTV(残留原发灶及化疗前肺门、纵隔阳性淋巴结):60Gy/2Gy/30F。第1周期化疗后患者咳嗽及呼吸困难症状明显减轻,第2周期化疗后行胸部CT,与前片对比,右侧肺上叶及肺门部病灶增大,最大层面约为9.2 cm×9.9 cm。因病情进展,更换化疗方案TP,具体方案为:多西他赛100 mg,d1;洛铂40 mg,d2。3周期TP方案化疗与同步放疗后,复查胸部CT(图2)(2018-10-29):右肺门旁软组织密度片状影约为1.0 cm×1.9 cm,较第一次CT片所示病灶明显缩小,未见肿大淋巴结,两侧胸腔未见明显积液。
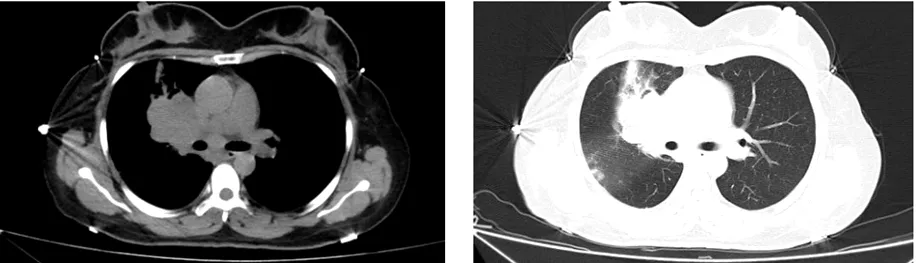
图1 同步放化疗前胸部CT纵隔窗和肺窗,最大层面约5.7 cm×5.0 cm
患者于2018年12月5日出现腹胀、排便困难及骶骨部位疼痛,就诊于我院妇科。全腹CT平扫加增强(图3):子宫两侧见类圆形肿物影,边缘较清楚,密度不均匀,大小分别约为8.3 cm×8.8 m×11.1 cm、9.5 cm×9.4 cm×12.8 cm,CT值约263.5 Hu,增强扫描动脉期病灶边缘及实性成分呈轻度强化,静脉期及平衡期进一步强化。两侧盆壁见淋巴结影显示,大者短径约为7.9 mm。骶骨岬前方见团片状软组织密度影,增强扫描呈轻度强化,骶骨可见低密度区。CA125:400.30 U/ml(正常值范围 0-35 U/ml)。为进一步明确肿瘤性质,于2018年12月11日行剖腹探查术,术中根据病情决定行肿瘤减灭术,术后病理(图4):(双侧卵巢)结合免疫组化染色结果及形态学特征符合小细胞癌(肺型),脉管内见癌浸润,结合病史不能除外肺小细胞癌转移,请结合临床。免疫组化染色结果:CK(AE1/AE3)(点+)、CgA(-)、Syn(弱+)、CD56(+)、TTF-1(+)、Ki67(阳性60%)、PAX-8(-)、ER(-)、PR(-)。复查CA125:38.20 U/ml。术后行全身骨扫描:骶骨前缘软组织占位伴邻近骶骨受侵破坏。结合临床,考虑为骨继发恶性肿瘤。根据病情,针对骶骨前软组织影及骶骨破坏部位拟给予姑息性放疗,靶区剂量:50Gy/2Gy/25F,患者拒绝化疗。放疗后,疼痛明显缓解,复查CA125:29.5 U/ml。放疗后3周,该患出现左侧锁骨上淋巴结肿大,大小约为10.0 cm×5.0 cm,左侧第5肋出现占位性病变,大小约为4.0cm×3.0cm,复查CA125:52.30 U/ml(正常值范围0-35 U/ml)。随后行2周期伊立替康(400 mg,d1,8)联合安罗替尼口服(10 mg,d1-14),锁骨上淋巴结及肋骨病灶明显缩小,肉眼不可见,触诊肿瘤仅少量残留,复查肿瘤标志物均为正常。
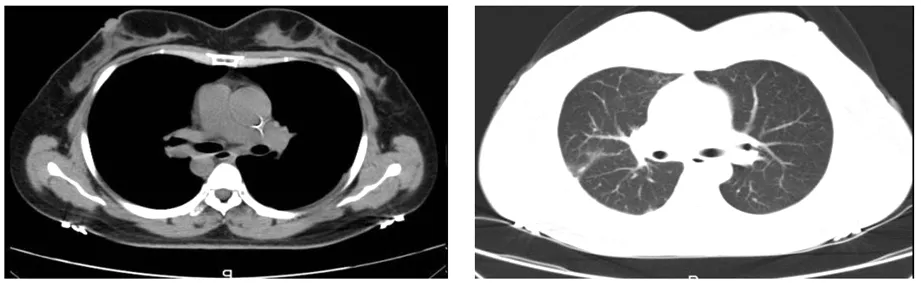
图2 同步放化疗后胸部CT纵隔窗和肺窗,病灶缩小至1.0 cm×1.9 cm

图3 卵巢继发恶性肿瘤全腹CT增强和平扫

图4 卵巢继发恶性肿瘤术后病理
2 讨论
小细胞肺癌(SCLC)约占新发肺癌病例的15%-20%,是肺癌中分化程度最低,恶性程度最高的类型[1,2]。初诊的SCLC中,60%-70%已为广泛期[3]。局限期患者中位总生存期(OS)约为15-20个月,2年和5年生存率分别为20%-40%和10%-20%。广泛期的中位OS约为8-13个月,2年和5年生存率分别为5%和1.2%[4]。SCLC易发生转移,颅脑是最常见的转移部位,其次是对侧肺部,肝脏、肾上腺及骨转移也很常见[4]。卵巢在SCLC患者中不是常见的转移部位,仅有少数报道的病例报告[5]。卵巢继发恶性肿瘤占卵巢恶性肿瘤的5%-10%[6],大多数来源于女性生殖道其他部位,如对侧卵巢、子宫体,或来源于生殖器官以外的部位,通常是胃肠道和乳腺[6,7]。来源于肺的卵巢继发恶性肿瘤总体发病率较低,却呈上升趋势,通常发生在相对年轻的女性身上[8],女性吸烟增加可能预示着未来女性SCLC患者卵巢转移的增加[9,10]。在目前的研究中,80%的SCLC卵巢转移患者有小细胞肺癌史或同时发生肺和卵巢肿瘤[8]。患者通常表现为腹胀、阴道流血,肿瘤体积较大,多为10 cm的囊实性包块[8]。此类患者通常预后较差,大多数在诊断为卵巢转移后1年内死亡。妇科肿瘤的卵巢继发恶性肿瘤生存期高于非妇科恶性肿瘤的卵巢继发恶性肿瘤,肿瘤切除术后的5年生存率分别为49%与17%,因此卵巢继发恶性的肿瘤减灭术是有意义的[6]。本例患者压迫症状明显,术后症状明显好转。
目前,SCLC患者一线治疗的标准方案仍然是顺铂和依托泊苷。大多数SCLC患者对化疗非常敏感,初治缓解率高,但80%的局限期患者和几乎所有的广泛期患者会在1年内复发或进展[11],并且复发时具有相对的耐药性。二线化疗使许多患者获得明显缓解,而且缓解程度取决于从最初治疗反应到复发的时间。治疗后<6个月复发的患者首选拓扑替康,治疗后6个月复发的患者推荐原方案。伊立替康、紫杉醇、多西他赛和吉西他滨是早期复发耐药患者的二线治疗药物。伊立替康、多西紫杉醇、吉西他滨、依托泊苷和长春瑞滨是治疗复发敏感患者的二线药物[12]。然而,这些化疗药物对OS的影响非常有限[13]。众所周知,靶向药物是维持治疗的最佳选择,它们的毒性比化疗低,而且一般易于使用。因此,近年来针对SCLC靶向治疗的研究受到关注,但大多数结果都是阴性[13]。靶向治疗药物如受体酪氨酸激酶抑制剂、抗血管生成抑制剂、Notch信号通路抑制剂、Hh信号通路抑制剂、Bcl-2 抑制剂、极光激酶 A 抑制剂的临床试验正在进行中[14]。
安罗替尼是我国自主研发的一种口服、新型多靶点小分子受体酪氨酸激酶抑制剂(TKI),可强效抑制VEGFR,PDGFR,FGFR 和 c-Kit 等多个靶点,有抑制肿瘤血管生成及肿瘤生长的双重作用[15,16]。研究表明,安罗替尼对非小细胞肺癌(NSCLC)、软组织肉瘤、甲状腺髓样癌、食管鳞癌、肾癌、结直肠癌等多种实体瘤患者有效[17]。研究表明在难治、多线复发的SCLC患者中,安罗替尼的PFS提高了3.4个月,疾病风险降低了81%。此外,安罗替尼治疗脑转移的患者疾病进展风险降低了85%。
本例患者治疗期间局部进展,改变治疗方案后局部控制有效,但发生转移,TKI联合手术、放疗及化疗,提高局控,缓解症状,延长生存,耐受良好,无明显不良反应。

