胫骨骨巨细胞瘤根治术后多发胸腰椎转移1例
王 野,朱庆三,刘昊川,宋显吉,刘宇龙,朱朋飞,夏子博,栾双蔚,邬佼汐,武云涛
(吉林大学中日联谊医院 脊柱外科,吉林 长春130033)
1 病例资料
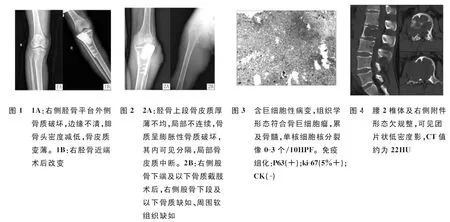
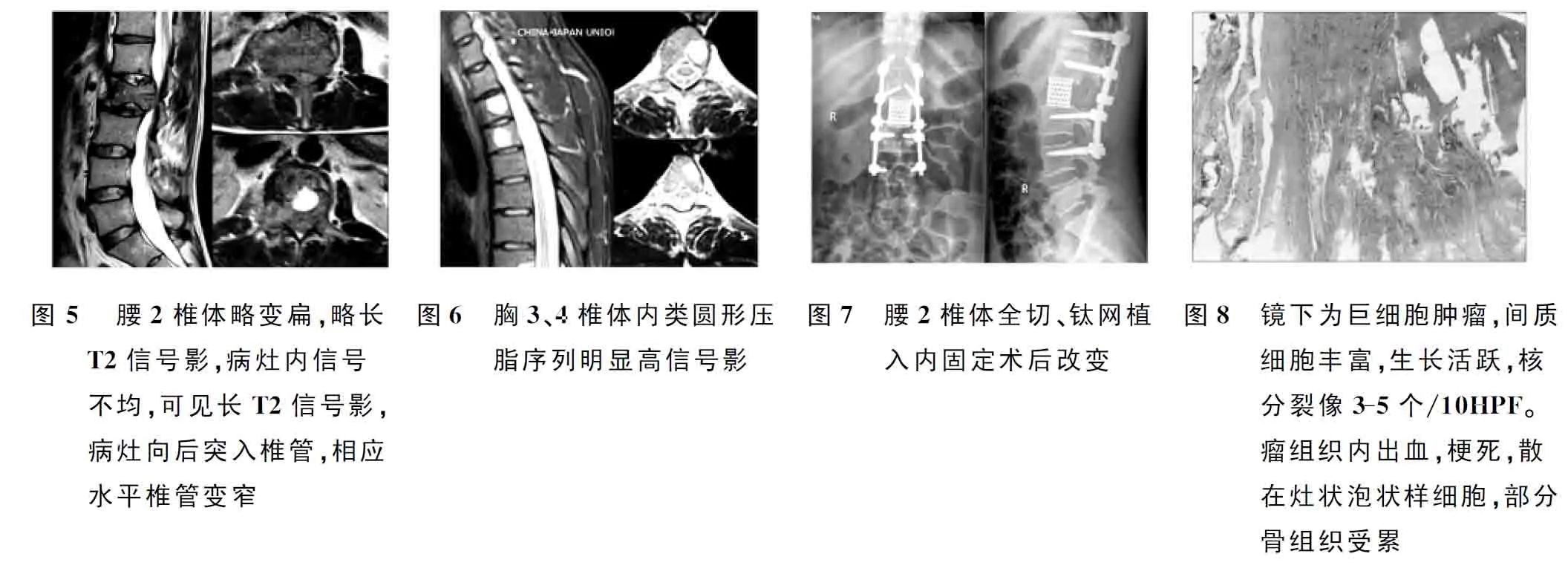
患者男,27岁,以主诉“右小腿肿痛伴活动受限3天”入院,病程中无恶心,呕吐及明显体重减轻。查体:右胫骨近端外侧明显肿胀,肤色略红,压痛(+),触之无波动感、搏动感及活动感,皮温较健侧略高,X线片示右侧胫骨平台外侧骨质破坏,边缘不清,腓骨头密度减低,骨皮质变薄(图1A)。穿刺病理见少许单核细胞及多核细胞,考虑为骨巨细胞瘤。诊断:右胫骨近端骨巨细胞瘤。于2013年1月29日行右胫骨近端肿物切除、骨水泥填充内固定术(图1B)。组织病理结果符合侵袭性骨巨细胞瘤。术后患者未行相关预防复发治疗。术后4年,患者因“外伤致右侧膝关节肿痛伴活动受限2天”再次入院。查体:右膝关节肿胀、静脉曲张,屈曲畸形,右胫骨外侧一高出皮肤表面3 cm、大小约5 cm×10 cm肿物,无移动度,皮温高,局部压痛(+)。右下肢X线片示右胫骨上段骨质形态欠规则,骨质密度减低,呈肥皂泡样膨胀,骨皮质变薄,周围软组织明显肿胀,其内可见斑片状略高密度影(图2A)。CT检查示右胫骨上段骨皮质厚薄不均,局部不连续,骨质呈膨胀性骨质破坏,其内可见分隔,局部骨皮质中断。全身骨扫描示右侧胫骨上端骨盐代谢异常,局部骨皮质不连续,未见典型多发骨转移。于2017年2月22日穿刺,病理结果回报为侵袭性骨巨细胞瘤。于2017年3月2日行右下肢高位截肢术(图2B),术后病理结果为侵袭性骨巨细胞瘤(图3)。术后患者未予以相关预防复发措施及定期随访复查。截肢术后15个月,患者因“腰背部疼痛进行性加重3个月”再次入院,入院前约1周无明显诱因出现左大腿前侧麻木,病程中体重轻度减轻。查体:脊柱正常生理曲度存在,腰背部活动明显受限。腰背部压痛及叩击痛(+),左侧大腿前侧可查及明显浅感觉减退。 X线示腰2椎体形态欠规则,骨质密度减低,呈肥皂泡样膨胀。进一步行CT检查见腰2椎体内可见团块状异常密度影,其内密度均匀,周围骨质变薄,向后突入椎管、压迫脊髓(图4)。MRI示腰2椎体略扁,椎体中后部及右侧椎弓根向周围膨胀,其内可见团块状长T1略长T2信号影,边界较清,压脂序列呈稍高信号,病灶内信号不均,可见结节状长T1长T2信号影,压脂序列呈明显高信号(图5)。全身骨显像示腰2椎体形态不规则,局部骨质破坏及软组织密度影,伴放射性分布异常,胸椎3、4、8、10、11局部密度减低,放射性分布基本正常(考虑其均为骨转移所致可能性大)。胸椎MRI示胸3、4椎体内可见多发类圆形等长T1、长T2信号影,压脂序列呈明显高信号,较大者位于胸3椎体(图6)。超声引导下,俯卧位,经偏右侧腰部皮肤、皮下组织及肌肉,穿刺进入腰2椎体肿瘤取病理,镜下见含有巨细胞病变,间质单核细胞可见核分裂像。患者于2018年5月29日行腰2椎体360°全切、钛网置入植骨融合内固定术(图7),术后病理结果符合骨巨细胞瘤(图8)。胸3、4椎体无临床症状,且病灶切除难度较大,未采取外科治疗方法,术后予以Denosumab靶向治疗控制病情进展,预防复发,术后一年内定期随访,未见复发,胸椎椎体内瘤体大小未见明显变化。
2 讨论
骨巨细胞瘤(GCTB)虽然是最常见的原发性骨肿瘤之一,但仍是最具争议和讨论的骨肿瘤之一[1],大多数研究认为GCTB是一种良性的局部侵袭性肿瘤,少数研究[2]认为GCTB是一种低度恶性肿瘤,极少数研究认为GCTB是一种反应性疾病,而不是肿瘤。组织学检查显示GCTB具有良性组织学特征,但表现出局部破坏行为, GCTB生物学行为复杂多变,呈侵袭性生长,并具有局部复发倾向,部分患者发生转移或肉瘤变,预后极差。本例患者术后出现局部复发,且发生罕见骨转移,符合生物学行为复杂多变的研究报道。临床上,GCTB病理及影像分级是手术方式筛选的重要依据。Jaffe将GCTB病理分为三级,但是单纯的病理分级在临床上往往无法反映GCTB的生物学行为。因此,Enneking和 Campanacci根据影像表现及临床症状提出不同GCTB分级。GCTB临床分级越高,其局部复发可能性越大。Prosser[3]回顾性分析137例初发GCTB病例发现:病灶刮除后,Campanacci Ⅰ、Ⅱ级病例局部复发率为7%,Campanacc Ⅲ级病例局部复发率为29%。病灶刮除术是GCTB最常用的手术方式,清除肿瘤的同时能最大限度地保留骨关节结构和功能,但复发率较高,广泛切除主要应用于Ⅲ级或其他方式无法切除的肿瘤[4],边缘或广泛切除可明显降低GCTB复发,但尚无明确报道手术方式可以影响GCTB的转移率。有研究表明[5-7],病理性骨折表明疾病更具侵袭性,局部复发和转移扩散风险较高。 本例患者病灶刮除术后4年出现局部复发,二次入院时X线示局部软组织肿胀,局部骨皮质不连续,提示具有侵袭性,穿刺病理符合侵袭性骨巨细胞瘤,属Enneking分级和Campanacci分级 III级,适合广泛切除或直接行高位截肢术[8-10],予以高位截肢手术,术后15个月患者出现多发胸腰椎转移。由于脊柱的骨巨细胞瘤(SGCT)有着较高的复发风险,大范围的全脊椎切除术是首选的手术方式,首次选择较为彻底的手术方式是降低SGCT局部复发的关键[11-13]。在行椎体的全切或次全切除术后应当行脊柱的功能重建,常见的功能重建材料有自体骨、同种异体骨、骨水泥、钛网、前路钛板和后路椎弓根螺钉,可根据手术方式的不同选择重建材料组合使用。本例患者第三次入院,考虑为胫骨骨巨细胞瘤腰2椎体转移,有较高的复发率及侵袭性,予以腰2全椎体360°切除、钛网置入、自体髂骨移植,后路椎弓根螺钉内固定,术后患者恢复良好,疼痛症状消失,术后佩戴腰部支具及义肢可简单活动,术后3月患者可自如活动,生活质量明显改善。
Denosumab是一种人工合成、完全人源化、可与RANK 配体结合的单克隆抗体[14],对人源RANK配体具有很高的亲和力和特异性,具有较好的骨吸收抑制作用,是以破骨细胞RANKL/RANK信号调控通路为靶点,降低骨肿瘤的进展[14,15]。有研究报道,Denosumab 对难以切除或不可切除的骨巨细胞瘤有显著的治疗效果。Rut-kowski 等人报道[16],术前应用denosumab 新辅助疗法治疗 GCTB 患者可获得有利的手术降期效果。本例患者初次手术及二次截肢术后均未对GCTB予以足够的重视,术后均未采取相应的预防复发及转移的措施,第三次术后患者行denosumab靶向治疗,预防胸椎GCTB的病情进展及局部复发,术后一年内定期随访复查影像学,肿瘤大小均未见明显变化,提示denosumab治疗效果良好。但denosumab在临床应用上仍有并发症,如颌骨坏死、低钙血症、非典型股骨骨折和免疫受损相关感染等[17],因此,denosumab的长期用药安全性、停药指征和远期疗效仍是今后的研究重点。本例患者在术后一年内坚持使用denosumab控制病情进展,暂未出现相关并发症,但其停药时机及远期的疗效仍有待商榷。
骨巨细胞瘤的复发和转移是治疗的难点,虽然骨巨细胞瘤的复发并不像恶性肿瘤那样致命,但是由于复发所带来的再次手术或者远处转移、恶变等问题的存在,给患者带来的影响也不容忽视,我们建议临床医生在面对GCTB时,应充分结合病理特点和影像特点,术前确定病理及临床分级,制定最佳治疗方案,术前术后选择合适的辅助治疗,最大程度的保留骨组织结构与功能,同时降低局部复发风险、防止恶变。同时,我们仍需国内外学者深入研究,改良手术方式、预防复发和转移。

