以糠醛为原料的δ-戊内酯合成及应用研究进展
徐榕徽, 王国胜
(沈阳化工大学 化学工程学院;辽宁省高校化工技术重点实验室, 辽宁 沈阳110142)
内酯是一类可用作溶剂和提取剂的化学品,也是合成许多生物医学产品、纤维和农药的中间体[1]。δ-戊内酯作为药物中间体,曾被广泛应用于医药合成领域[2]。由于δ-戊内酯自身易聚合,形成的均聚酯和与其他化合物形成的聚交酯有较好的生物相容性和生物降解性,在生物医学工程、降解塑料与高附加值包装材料等领域受到亲睐[3]。随着δ-戊内酯用途的扩大和市场需求量增加,找到一种廉价且可再生的原料、研究出简单的合成路线和研制出温和的反应条件是目前需要解决的问题。作为δ-戊内酯的上游产品,糠醛是由生物质原料如玉米芯等农副产品中的纤维素或戊聚糖在酸作用下水解再环化脱水得到的产品,工艺简单,已基本实现工业化[4]。糠醛结构中有呋喃环和醛基存在,具有醛、醚、二烯烃的化学性质,能发生加氢、氧化和脱碳等反应,因此以糠醛为原料制备高附加值化学品一直是国内外的研究热点。本文以糠醛为原料,对糠醛衍生物环戊酮、糠醇、四氢糠醇、1,5-戊二醇和四氢呋喃的制备,以及它们进一步转化制备δ-戊内酯的研究进行了综述,并简要介绍了δ-戊内酯的应用,以期发展以生物质平台化合物糠醛为原料制备δ-戊内酯进而制备可降解聚酯的绿色循环产业。
1 δ-戊内酯的合成
以糠醛为原料制备δ-戊内酯主要有3种途径:环戊酮途径、糠醇/四氢糠醇-1,5-戊二醇途径和四氢呋喃途径,具体过程如图1所示。
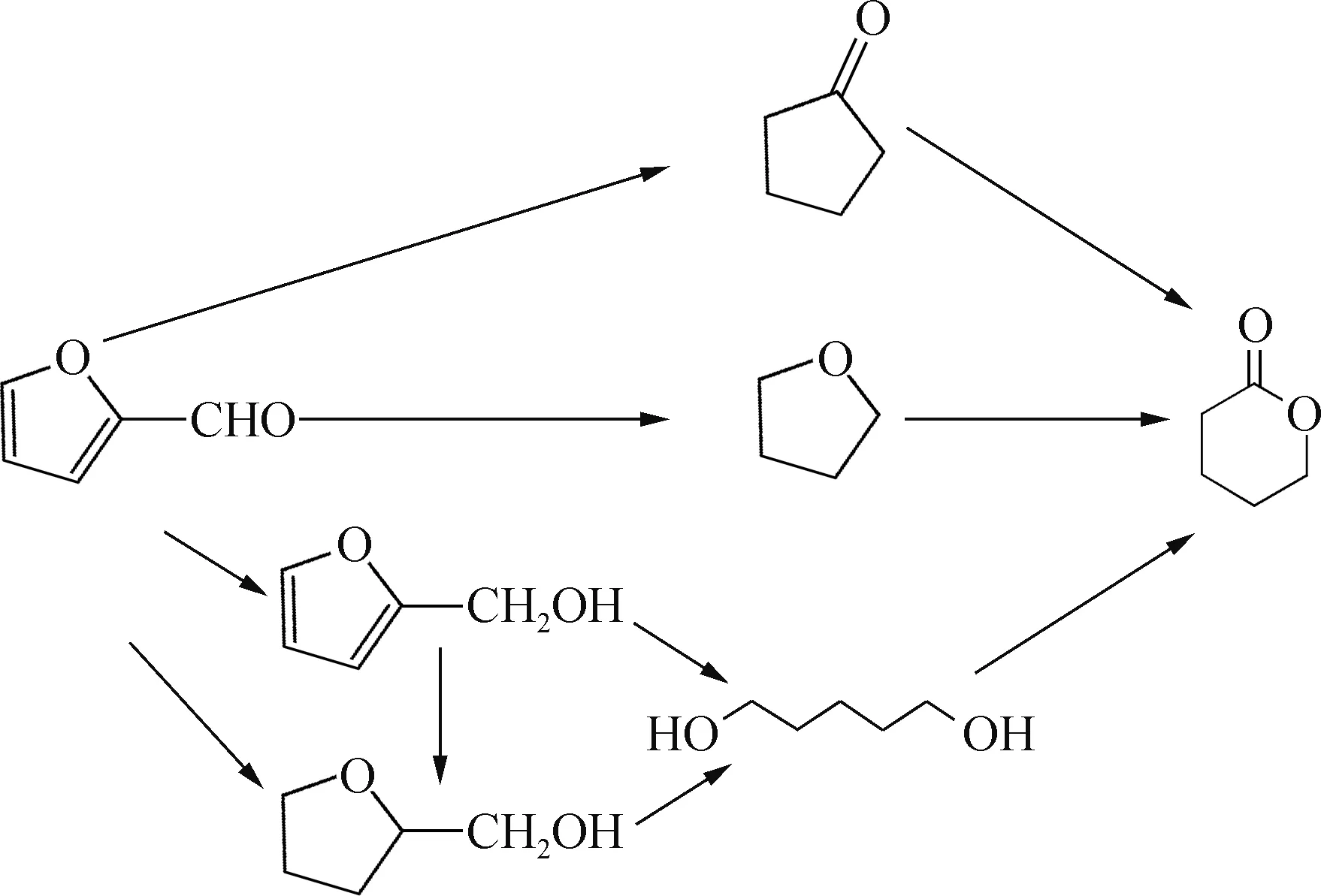
图1 以糠醛为原料制备δ-戊内酯Fig.1 Preparation of δ-valerolactone from furfural
1.1 环戊酮途径


图2 糠醛制环戊酮[7]
1.1.2环戊酮制δ-戊内酯 环戊酮制δ-戊内酯为典型的Baeyer-Villiger(BV)反应,环戊酮的羰基在过氧化物亲核进攻下产生的中间体发生基团迁移后重排得到了δ-戊内酯。目前的研究都围绕过氧酸、双氧水和分子氧为氧化剂展开。有机过氧酸既是氧化剂又是催化剂,可以保证体系无水,避免δ-戊内酯水解。Friess[10]早期提出以过氧苯甲酸为氧化剂,δ-戊内酯得率可达78%。酸性最强的过氧三氟乙酸被认为是效果最好的有机过氧酸氧化剂,反应最快,得率最高[11]。Emmons等[12]使用过氧三氟乙酸氧化环戊酮,δ-戊内酯得率达88%。但有机过氧酸不稳定,易爆炸,价格高,反应产生的副产物有机酸污染环境,需要大量碱性试剂处理,增加生产成本。无机过氧酸盐可以避免有机过氧酸的相关危险,María等[13]制备了SiO2/KHSO5,在二氯甲烷为介质条件下,δ-戊内酯得率可达到96%,但SiO2/KHSO5利用率低,消耗量大。
双氧水的氧化能力不及过氧酸,需要开发活性好的催化剂(固体酸、水滑石、金属配合物、金属氧化物和生物酶等)加速酮的催化。Lei等[14]以乙醇为溶剂,AlCl3为催化剂,双氧水为氧化剂,在70 ℃下反应24 h,δ-戊内酯得率可达99%,但反应速率极低,耗时长,产量小。Mello等[15]制备了过羧乙基化的二氧化硅功能型固体酸催化剂,以双氧水为氧化剂,在超临界CO2环境下进行氧化反应,环戊酮转化率能达到92%,固体酸催化剂可回收。Pillai等[16]研究了Sn交换水滑石为催化剂的情况,SnO2中的Sn位点可激活环戊酮的羰基,并在乙腈和过氧化氢形成的过氧化物亲核进攻下发生重排生成δ-戊内酯(得率16%)。王佳等[17]在最优条件:环戊酮0.025 mol,催化剂Sn/W-2-600用量为环戊酮质量的40%,n(过氧化氢)/n(环戊酮)=1.5,n(丙酸)/n(环戊酮)=13.5,反应时间4.5 h,真空度为0.07 MPa,制得得率72.26%的δ-戊内酯。Bradley等[18]研究了在温和碱性条件(Mg/Al/MeOH)中,环戊酮与过氧化氢经Baeyer-villiger(BV)方法制δ-戊内酯,得率为30%,避免了许多以过氧化氢作为氧化剂的BV方法大量使用Sn的问题。Uyanik等[19]以Li、Ga等M[B(C6F5)4]n高选择性的金属配合物作催化剂,该催化过程是高效的氧化联级过程,产物收率可高达98%,且反应温和,但催化剂制备工艺复杂。Rios等[20]以尿素与过氧化氢络合物为氧化剂,乙酸乙酯为溶剂,南极洲念珠菌B脂肪酶为底物催化制备δ-戊内酯,但δ-戊内酯和脂肪酶仍会发生进一步反应,δ-戊内酯得率为30%。
分子氧也可作为氧化剂制备δ-戊内酯,由于分子氧的活性差,需要引入醛类作为分子氧的共氧化剂。Kaneda等[21]以苯甲醛为分子氧的共氧化剂,氧化环戊酮制δ-戊内酯,四氯化碳为溶剂时得率可达63%。Li等[22]开发了Co3O4为催化剂,苯甲醛为分子氧的共氧化剂,使环戊酮制δ-戊内酯得率达到了75%。Zheng等[23]制备了Cu-Fe3O4@mSiO2催化剂,避免了有毒金属钴的使用,同样选择苯甲醛为分子氧的共氧化剂,δ-戊内酯得率也能达到75%,并解释了催化剂在该反应中起电子转移的作用。
综上所述,在环戊酮制δ-戊内酯过程中,以过氧酸为氧化剂进行均相反应制δ-戊内酯的方法,时间短,得率高,但因过氧酸对环境的污染使之逐步被淘汰。双氧水氧化法是目前工业生产的主要方法,反应过程相对温和,得率较高,但水的引入抑制反应进行,易造成产物水解。以分子氧作为氧化剂进行的气液相反应,反应条件较苛刻,但分子氧是一种绿色安全的氧化剂,因此将其用于环戊酮制δ-戊内酯的研究是未来的热点。
1.2 糠醇/四氢糠醇-1,5-戊二醇途径
1.2.1糠醛制糠醇及四氢糠醇 糠醇(C5H6O2)和四氢糠醇(C5H10O2)均是糠醛加氢的产物,催化剂的性质决定加氢反应的阶段性和选择性。糠醛制糠醇主要以Ni系催化剂和Cu系催化剂为主。Li等[24]以制备的细铁掺杂Ni-B非晶态催化剂催化糠醛加氢制糠醇,结果表明:该催化剂展现了良好的活性,在100 ℃和1 MPa条件下,糠醇得率达到100%;Nagaraja等[25]制备了Cu/MgO催化剂,在180 ℃和常压的条件下,糠醇得率96%。糠醇制四氢糠醇研究主要以Ni基催化剂展开。赵会吉等[26]以骨架镍催化剂,在氢压为 5.0~6.0 MPa的反应条件下,糠醇制四氢糠醇得率约97%。马兴全[27]以改进的WRC-Ⅱ型催化剂在50~100 ℃和0.8~1.2 MPa条件下,使糠醛一步加氢催化得到四氢糠醇,得率大于90%。
1.2.2糠醇及四氢糠醇制1,5-戊二醇 1,5-戊二醇(C5H12O2)为无色黏稠液体,常用作有机合成中间体和化学溶剂。以糠醇为中间体制得1,5-戊二醇选择性较低。Gao等[28]制备了钙钛矿型Cu-LaCoO3催化剂,140 ℃和氢压6 MPa 条件下,戊二醇总选择性55.5%(其中,1,5-戊二醇和1,2-戊二醇的选择性之比约为3 ∶1)。
四氢糠醇作为中间体制备1,5-戊二醇研究较多。Schniepp等[29]以Al2O3为催化剂催化四氢糠醇得到二氢吡喃,在水蒸气条件下生成羟基戊醛,再与亚铬酸铜在150 ℃、高压加氢条件下反应得到1,5-戊二醇,得率70%。Tomishige课题组[30-33]选用Rh-负载型催化剂催化四氢糠醇制1,5-戊二醇,其中Rh-ReOx/C的活性最高,在水为溶剂,氢压8 MPa,100 ℃条件下反应24 h,四氢糠醇转化率99%,1,5-戊二醇选择性95%;而以Rh/SiO2为催化剂时,1,5-戊二醇选择性只有18%,1,2-戊二醇选择性61.7%;并提出Rh金属颗粒与添加剂金属之间金属键是催化剂高效性的关键。Chatterjee等[34]以Rh/MCM- 41为催化剂,在14 MPa超临界CO2、氢压4 MPa和80 ℃条件下反应24 h,四氢糠醇转化率80.5%,1,5-戊二醇选择性91.2%。
糠醛制糠醇及四氢糠醇的工艺已经成熟,产率几乎达到100%。但以糠醇及四氢糠醇制1,5-戊二醇的过程反应条件苛刻,催化剂成本过高。大部分催化剂的选择性较低,产物中会伴随副产物1,2-戊二醇的生成,分离成本较高。
1.2.31,5-戊二醇制δ-戊内酯 1,5-戊二醇脱氢制δ-戊内酯要经过羟醛缩合反应过程。1,5-戊二醇先被转化为5-羟基戊醛,缩合成环后的羟基再次脱氢生成δ-戊内酯,如图3所示。

图3 1.5-戊二醇制δ-戊内酯
1,5-戊二醇中氢原子可与氧结合成水分子实现氧化脱氢。Huang等[35-36]在不同焙烧温度下制备了Au/FeOx催化剂以及γ-AlOOH和γ-Al2O3负载的Au纳米级催化剂,并用于催化1,5-戊二醇脱氢制δ-戊内酯,结果发现:1,5-戊二醇转化率最高能达到92%,但δ-戊内酯选择性最高只能达到33.6%,这是由于δ-戊内酯不稳定,酸性条件再次催化δ-戊内酯水解生成5-羟基戊酸导致的。Mitsudome等[37]选择碱性更强水滑石(TH)作载体,制备了Au/TH高效纳米级催化剂,在40 ℃下分子氧氧化1,5-戊二醇,δ-戊内酯得率98%,该过程避免了高温,且催化剂可在不降低活性前提下回收。由于纳米Au催化剂成本高,该工艺目前仅在研究阶段。
1,5-戊二醇也可单纯通过催化剂促使氧-氢和碳-氢断裂脱氢。Suzuki等[38]以Ir配合物为催化剂,n(1,5-戊二醇) ∶n(Ir)=200 ∶1,常温常压条件下反应24 h,δ-戊内酯得率达到95%。德国BASF公司Pinkos等[39]申报了1,5-戊二醇气相催化脱氢专利技术,在260~350 ℃温度范围内,0.05~1.00 MPa压力下,CuO/SiO2和稀土Ce、Yb、Lu改性CuO/SiO2为催化剂,1,5-戊二醇的转化率接近99%,δ-戊内酯的最大选择性达到了95.0%。冯世宏等[40]采用溶胶-凝胶法制备了3%CeO2-CuO/ZnO/Al2O3,反应温度为563 K,气时空速为5 h-1,反应时间为5 h,V(氢气) ∶V(1,5-戊二醇)=2 ∶1,氢压0.12 MPa,此时,1,5-戊二醇的转化率为93%,δ-戊内酯的选择性和得率最大值分别达到94%和87.4%。该方法为1,5-戊二醇气相催化脱氢制备δ-戊内酯的中试和工业放大性研究提供了基础数据和实验依据。最近报道了濮阳迈奇科技公司以1,5-戊二醇为原料,以自制掺杂多助剂的新型铜基催化剂经常压脱氢、真空精馏等工艺实现了δ-戊内酯工业化生产[41]。
以1,5-戊二醇制δ-戊内酯是近几年研究的热点,但氧化脱氢过程不可避免地需要使用贵金属催化剂,且成本较高,所以用多金属掺杂催化剂直接进行脱氢过程的方法更适合δ-戊内酯的工业生产。
1.3 四氢呋喃途径
1.3.1糠醛制四氢呋喃 工业上将糠醛与水蒸气混合物通入填充Zn-Cr-Mn金属氧化物的反应器,在400~420 ℃下脱羰基制呋喃;然后以骨架镍为催化剂,于80~120 ℃呋喃加氢制得四氢呋喃[42]。由于生产能耗大,这种工业生产模式逐步被淘汰,近些年对其研究也鲜有报道。
1.3.2以四氢呋喃制δ-戊内酯 Bhattacharyya 等[43]用四氢呋喃、水和CO为原料,以镍的卤素化合物为催化剂,在高温高压条件下制备了δ-戊内酯,其中以NiI2为催化剂能达到最高得率32.1%。由于工艺条件苛刻,戊内酯得率低,已鲜有人研究。
1.4 其他途径
糠醛拥有众多衍生物,除上述几种途径外还可以通过催化加氢和催化氧化生产有机酸、酸酐和酯类等各类精细化学品[44],其中δ-羟基戊醛、2-丁烯酸甲酯、α-呋喃醛、1,5-戊二醛、δ-羟基戊酸、2,3-二氢吡喃等均可为原料生产δ-戊内酯[2],但是由于工艺繁琐,产量低,所以鲜有研究。
2 δ-戊内酯的应用
2.1 合成医药中间体
δ-戊内酯结构广泛存在于各种具有生物活性和光学活性的化合物中,如大环内酯类抗生素(泰利霉素、可利霉素等)[45],β-三氟甲基-β-羟基-δ-戊内酯及其衍生物[46]。δ-戊内酯可以合成多种重要的药物中间体:δ-戊内酯还原合成2,3-二氢呋喃用于前列腺素类药物合成[47];δ-戊内酯与硝基苯作为初始原料经系列反应制抗血栓药物Apixuban[48];δ-戊内酯与D-苯苷氨醇合成3-甲基-2-哌啶酮类物质[49];δ-戊内酯与环己胺反应得到用于抗血小板聚集药物N-环己基-5-氯丁基-1H-四氮唑[50];以D-苯甘氨醇和δ-戊内酯为原料合成的六元环内酰胺进而制得的(R)-1-(2-羟基-1-苯乙基)-3-甲基-2哌啶酮可用于生物碱的制备[51];由δ-戊内酯为起始原料得到的Guadinomic酸对细菌III型分泌系统可以表现出很高的抑制效应[52]。
2.2 合成聚酯
由于δ-戊内酯可自身聚合为均聚酯,也可与其他化合物形成聚交酯,因此广泛应用于材料领域。由ε-己内酯和δ-戊内酯合成的聚ε-己内酯-co-δ-戊内酯表现出良好的延展性和机械性能[53]。δ-戊内酯与聚醚二醇合成的嵌段共聚物具有良好的力学性质和生物相容性[54]。ε-己内酯和δ-戊内酯的共聚物可应用于防污涂料,可降解黏合剂,δ-戊内酯的加入降低了聚己内酯的结晶度从而克服了聚己内酯降解时间长的缺点[55]。而δ-戊内酯的均聚酯与其他聚交酯立体络合形成的超分子共聚物由于立体络合作用极大提高了共聚物的结晶度,进而提高了材料的热阻和力学性质[56]。甲氧基聚乙二醇和聚戊内酯两亲二嵌段共聚物可负载疏水性抗癌药物紫杉醇,从而大大提高药物的表观水溶性,是疏水性药物制备和传递的理想材料[57]。随着人们对可生物相容性和可生物降解性的植入式给药系统(IDDS)的开发,研究发现该系统能在人体内长时间持续释放药物,具有提高治疗效果、减少全身毒性和提高患者依从性的潜力,因此以δ-戊内酯为基础的聚合物药物输送器成为近些年的研究热点[58]。
3 结 语
综述了以糠醛为原料制备δ-戊内酯的3种主要途径:环戊酮途径、糠醇/四氢糠醇-1,5-戊二醇途径和四氢呋喃途径,总结了δ-戊内酯在合成医药中间体和聚酯方面的应用研究进展。由于糠醛可由生物质转化得到,δ-戊内酯具有低温自聚合性能,且聚酯材料具有可生物降解性能,因此以糠醛为原料生产可生物降解聚酯材料是一种绿色可持续的发展方向。但是,由糠醛制备δ-戊内酯的3种途径不同程度上存在合成路线长、催化剂价格高、反应压力高、温度高和氧化技术不完善等问题。加大催化技术创新研究力度,开发合成路线短、催化剂廉价适用、反应条件温和和氧化剂安全绿色的工艺是未来的研究重点。由于糠醛制糠醇及四氢糠醇收率高,利于实现工业化生产,因此糠醛经糠醇及四氢糠醇制δ-戊内酯最具开发前景。

