基于Py-GC×GC-qMS的玉米芯热解产物在线检测
李文斌, 郑云武, 卢 怡, 郑志锋,4*
(1.云南省生物质能源国际联合研究中心;云南省生物质高效利用工程实验室;云南省高校生物质化学炼制与合成重点实验室,西南林业大学, 云南 昆明 650224; 2.西南林业大学 材料科学与工程学院, 云南 昆明650224;3.林业生物质资源高效利用技术国家地方联合工程研究中心,西南林业大学, 云南 昆明 650224; 4.厦门市现代农业生物质高值化技术重点实验室(厦门大学);福建省生物质高值化技术工程研究中心(厦门大学);厦门大学 能源学院, 福建 厦门 361102)
随着人口和经济的快速发展,化石燃料的过度使用对环境造成的负面影响日益加剧,世界各地将目光逐渐转向来源广泛、储存量大的生物质能源。生物质能源作为一种原料来源丰富的可再生能源,可以用来替代化石能源,具有广阔的应用前景和经济效益[1]。生物质热解是在无氧或缺氧条件下发生的热化学反应,是一种成本合理且操作简单的生物质转化利用方法,该技术的主要优势在于有望以较低的成本和较高的转化效率应用于生物质原料[2-3]。生物质热解过程中可产生液体产物,一般称之为生物油,生物油是一种复杂的有机混合物,包括许多高价值的化学品,但大多数高价值化学品含量很低[4]。其次,由于生物油具有不稳定性、酸度大和腐蚀性,使其不能直接作为燃料应用,需要进一步的精制或重整。
玉米芯是一种储存量大且可再生的生物质资源,通过热化学转化技术可将其进行高值化利用。姚锡文等[5]利用热重-质谱联用技术研究了玉米芯在不同热解条件下的热解机理和气相产物的分布及变化趋势,但并没有提及液相产物及一些重要的工业化学品。Lu等[6]利用Py-GC-qMS研究了玉米芯在不同温度下的热解产物分布,结果表明检测到的热解产物大约有100种,但由于检测器的灵敏度不够使得其中一小部分产物并不能被谱库检索到。全二维气相色谱-质谱联用(GC×GC-qMS,2D-GC)通常可以分离更多的色谱峰,有利于被分析物之间的分离,从而获得更高质量的质谱,弥补了GC-qMS(1D-GC)在分离化合物过程中存在共洗脱作用而导致部分化合物鉴别出现错误的缺陷[7-9]。另外四极杆质谱仪(qMS)较为便宜,GC×GC与快速扫描模式下运行的qMS相结合,可以满足实验要求的数据采集速率[10-11]。因此,本研究利用Py-GC×GC-qMS装置对玉米芯热解产物进行在线检测分析,考察温度对热解产物的影响,以期为选择性制备高价值化学品提供理论基础数据。
1 实 验
1.1 材料
玉米芯,2017年9月采集于云南省昆明市某农田,经自然干燥后粉碎过筛选择粒径范围在0.075~0.180 mm之间的粉末,并于105 ℃ 的鼓风干燥机中干燥24 h,自然冷却后取出,备用。玉米芯的元素分析采用德国元素公司生产的Vario EL元素分析仪测定,测得C 39.99%、 H 5.37%、 N 0.53%和O(差减法)54.11%。工业分析(以空气干燥基计)采用煤的工业分析方法(GB/T 28731—2012),测得水分7.0%、灰分4.8%、挥发分73.2%和固定碳15.0%。利用范式分析法测得纤维素36.12%、半纤维素39.36%、木质素22.64%和部分抽提物(色素、生物碱、树脂、鞣制、萜类和水溶性碳水化合物等)1.88%。
1.2 实验装置及热解实验方法
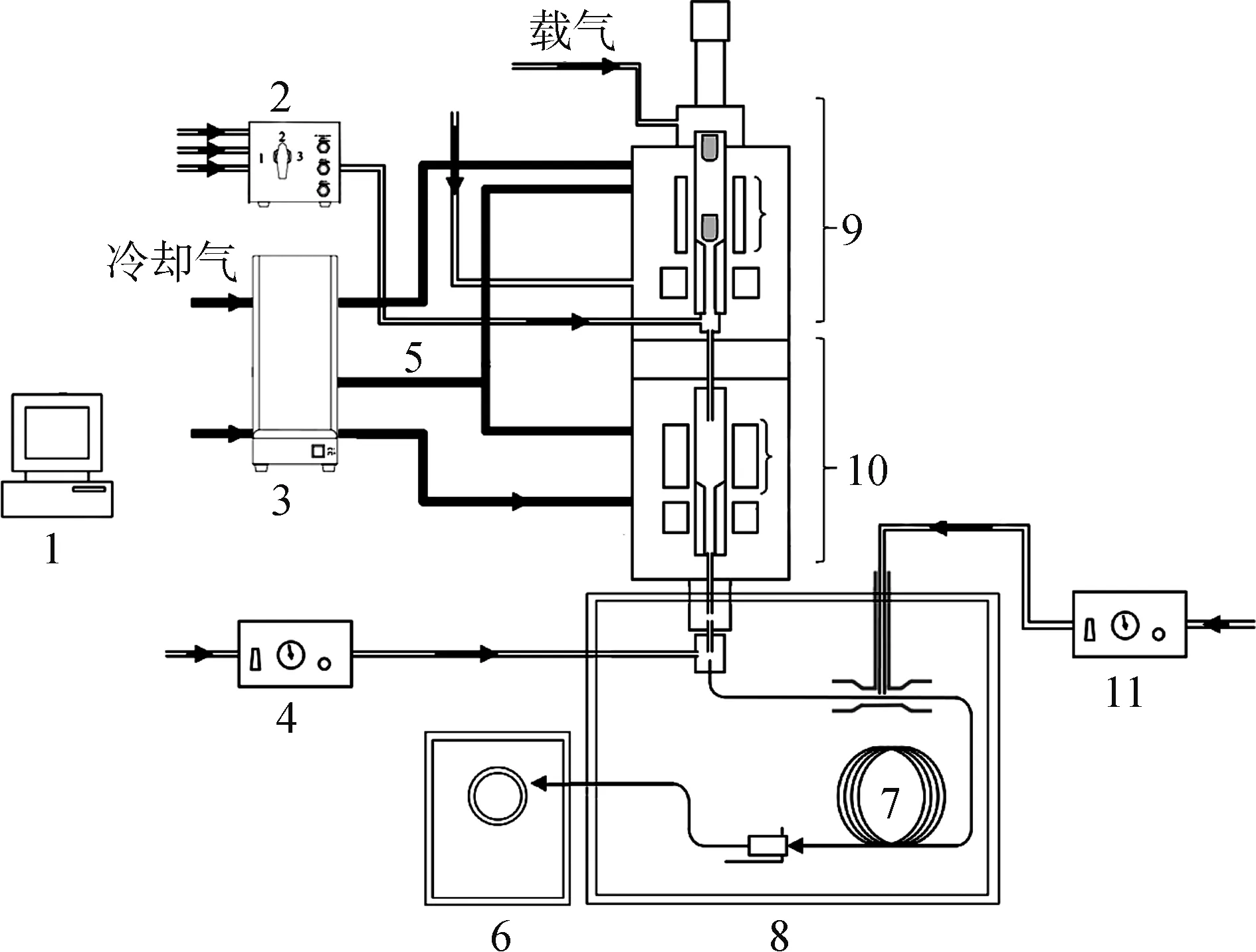
1. 控制电脑 control PC; 2. 流量控制器 flow control; 3. 温度控制器 temperature controller; 4. 载气选择器selective sampler; 5.炉加热控制线 furnace control cable; 6. 质谱系统 MS system; 7. 二维色谱柱2D-chromatographic column; 8. 气相色谱系统 GC system; 9. 一阶反应器 1st reactor; 10. 二阶反应器2nd reactor; 11. 微喷冷阱器 microjet cryo-trap图1 生物质在线热解系统示意图Fig.1 Schematic diagram of pyrolysis system
玉米芯在线热解装置如图1所示,采用美国Tandem μ-Reactor Rx-3050 TR型热裂解仪器(Py)和日本岛津公司的GC/MS-QP2020型气相色谱-质谱联用(GC×GC-qMS)仪。Py的热解温度设定为550 ℃,热解时间为18 s,升温速率为5 ℃/s。由于导热性能差,玉米芯实际热解温度低于设定值。称取约0.5 mg 样品置于第一阶反应器样品杯备用位置,载气为99.999%高纯氦气。热解完成后由GC-qMS(1D-GC)或GC×GC-qMS(2D-GC)对热解产物进行在线分析检测。用仪器自带的NIST-14和NIST-14s标准质谱库对热解产物进行分析检索,进行3组重复性实验取平均值。
1.3 产物分析
1.3.1GC-qMS分析 色谱柱型号:Alloy-1(40 m×0.25 mm×0.25 μm)。GC程序:柱箱温度为40 ℃;进样口温度为240 ℃;采用分流进样模式,分流比为60 ∶1;流量控制方式为压力控制;高纯氦气(99.999%)为载气且流量为1.34 mL/min,吹扫流量为3 mL/min。程序升温条件为:40 ℃保持2.0 min,以5 ℃/min升到180 ℃,再以10 ℃/min升到260 ℃。MS程序:离子源温度为230 ℃;接口温度为250 ℃;溶剂延迟时间为0 min;数据采集时间为0~36 min;m/z范围为45~500。
1.3.2GC×GC-qMS分析 利用GC×GC-qMS对玉米芯裂解蒸气进行了分析,色谱柱型号:Rxi-5MS+BPx-50。该系统配有调制器ZX1-GC×GC,调制周期为8 s,附加加热器温度为350 ℃,热喷持续时间为0.35 s。第一根色谱柱为弱极性色谱柱,型号为Rxi-5MS (30.0 m×0.25 mm×0.25 μm),第二根色谱柱为强极性色谱柱,型号为BPx-50 (2.5 m×0.1 mm×0.1 μm)。GC×GC-qMS数据处理采用GCMS Solution系统软件采集,二维可视化采用ChromSquare v.2.1软件。选取MS谱库且相似度检索选择大于75%,GC含量大于0.05%。GC程序:柱箱温度为40 ℃;进样口温度为240 ℃;采用分流进样模式,分流比为30 ∶1;流量控制方式为线速度控制;载气为高纯氦气且流量为0.8 mL/min,吹扫流量为5 mL/min。程序升温条件:40 ℃保持5 min,以4 ℃/min升到260 ℃保持5 min,再以10 ℃/min升到300 ℃保持2 min。MS程序:离子源温度为250 ℃;接口温度280 ℃;溶剂延迟时间1.5 min;数据采集时间2~60 min;m/z范围45~500。
2 结果与讨论
2.1 GC-qMS分析
采用GC-qMS对玉米芯在线热解的生物油组分进行初步检测,图2(a)为玉米芯在热解温度为550 ℃、热解时间18 s条件下的总离子色谱图。
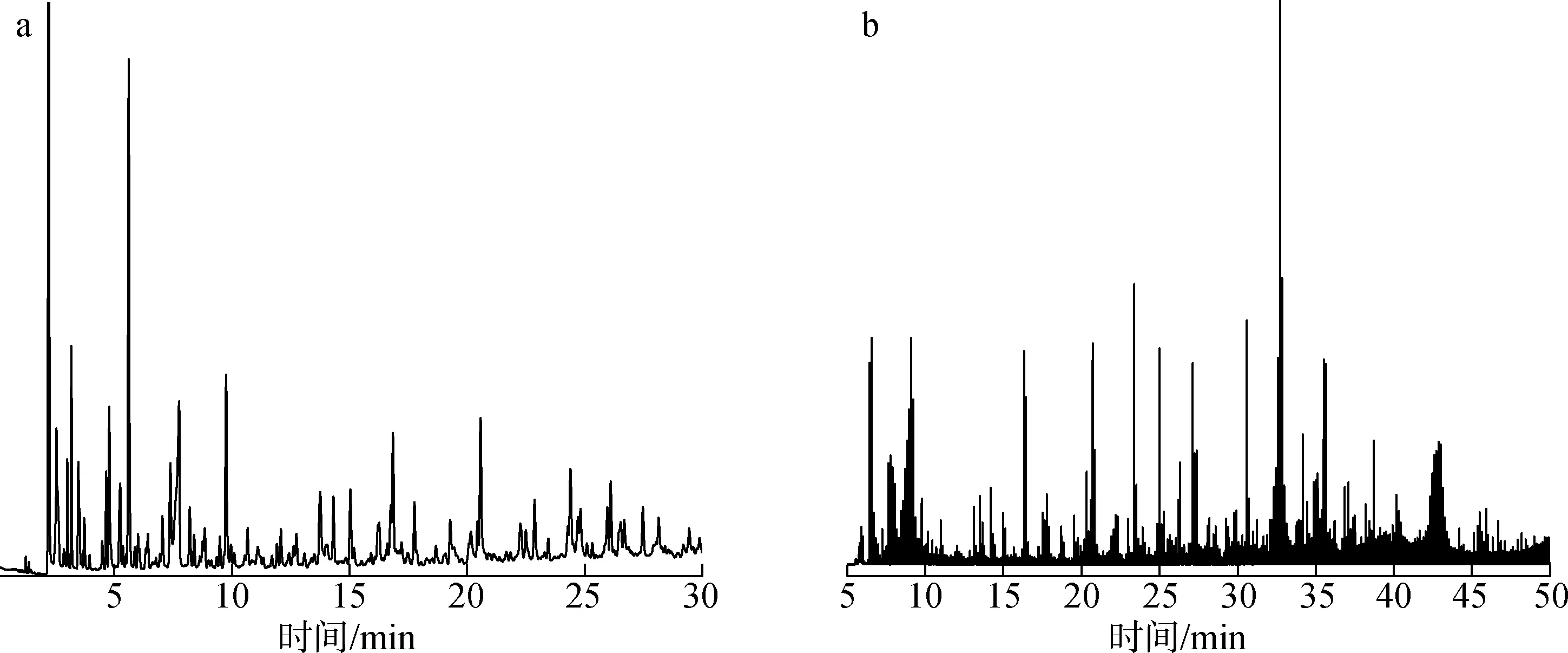
a.Py-GC-qMS; b.Py-GC×GC-qMS
利用GC-qMS初步鉴定出58种化合物,根据热解产物的化学类别将MS采集到的化合物分为10类,其数量和GC含量分别为8种醇类(8.56%)、 2种酸类(8.25%)、 3种醛类(4.54%)、 7种酮类(15.95%)、 3种酯类(4.27%)、 6种呋喃类(17.02%)、 4种酚类(9.33%)、16种碳氢化合物(28.12%)、 3种含氮类(2.01%)和6种其他类(1.95%),检测结果与Lu等[6]的研究结果相似。其中,主要成分包括1,4-戊二烯(9.80%)、 2,3-二氢-苯并呋喃(8.23%)、乙酸(7.78%)、 4-羟基-2-甲基苯乙酮(5.92%)、 1-羟基-2-丙酮(3.68%)和1,2-环戊二酮(3.49%)。
2.2 GC×GC-qMS分析
图2(b)为玉米芯在热解温度550 ℃、热解时间18 s条件下,采用GC×GC-qMS对玉米芯热解产物在线分析得到的总离子色谱图,图3为该条件下热解产物分布的二维(2D)视图以及三维(3D)视图。
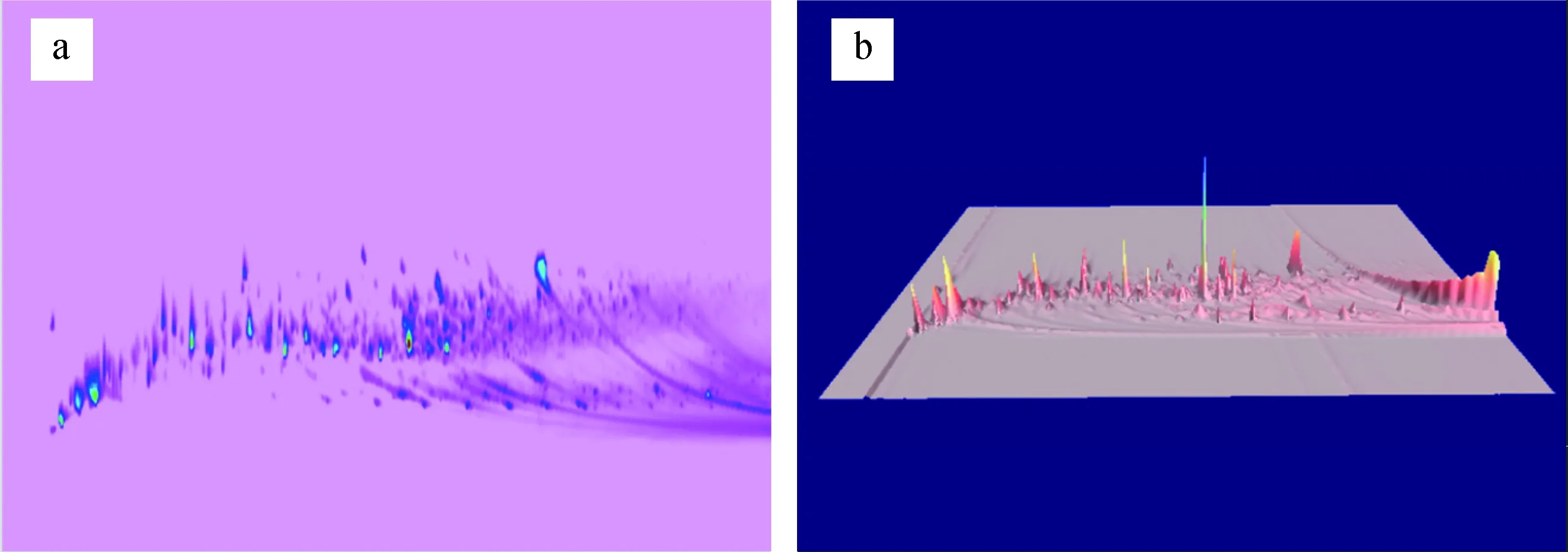
a.2D; b.3D
采用GC×GC-qMS方法初步鉴定出191种化合物,其数量和GC含量分别为21种醇类(4.19%)、7种酸类(1.96%)、10种醛类(3.24%)、28种酮类(13.57%)、5种酯类(0.62%)、31种呋喃类(20.32%)、16种碳氢化合物(8.11%)、40种酚类(21.25%)、10种含氮类(8.49%)、5种糖类(9.63%)和18种其他类(8.62%)。主要成分包括2,3-二氢-苯并呋喃(9.15%)、 1,6-脱水-β-d-吡喃葡萄糖(8.80%)、糠醛(5.21%)、 1,2-二甲基肼(4.94%)、 3,3-二甲基-1,2-环氧丁烷(4.83%)、1,2-环戊二酮(3.80%)、苯酚(3.14%)和2-甲氧基- 4-乙烯基苯酚(2.22%)。
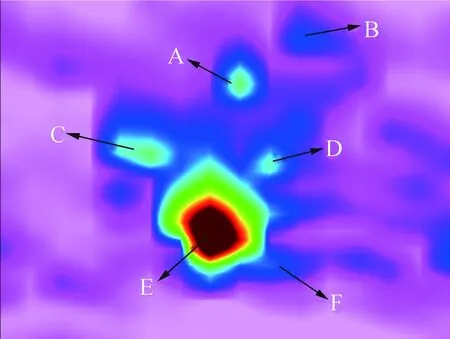
A.1,4∶3,6-二脱水-α-d-吡喃葡萄糖1,4∶3,6-dianhydro-alpha-d-glucopyranose; B.5-羟甲基糠醛5-hydroxymethylfurfural; C.邻苯二酚catechol; D.2-异丙氧基苯酚2-isopropoxyphenol; E.2,3-二氢苯并呋喃benzofuran,2,3-dihydro-; F.2-乙基-5-甲基-苯酚phenol,2-ethyl-5-methyl-图4 等高线图中重叠化合物的二维分离Fig.4 Two dimensional separation of overlapping compounds in contour map
从GC-qMS和GC×GC-qMS对玉米芯热解产物分析结果可以得出:2D所检测到的化合物种类和数量较1D相比更全面,检索到的化合物数量基本达到了1D的3倍多。这主要是由于1D气相色谱分析过程中单个色谱柱的分离能力不足,尽管色谱仪的技术和分析方法不断发展,但这个问题仍然存在,重叠峰通常使化合物鉴定和准确定量更显复杂化。而2D气相色谱由于具备高峰容量、强分离能力、更高灵敏度和分离空间中有序分布等优势,可以对生物质热解产物进行更详细和准确的分析[10],但最大的缺陷是操作复杂且成本较高,因此没有被广泛应用。但必须指出的是,尽管在空间平面上可以看到近200个已解析且部分重叠的峰,但笔者仍然认为会发生共洗脱情形。这主要是因为商业图书馆缺乏相对的标准质谱,而未来的研究应该基于标准质谱的进一步完善。
图4为图3的局部轮廓图,可以明显地看到6种化合物在二维色谱柱上的分离情况,分别为1,4∶3,6-二脱水-α-d-吡喃葡萄糖(C6H8O4)、邻苯二酚(C6H6O2)、 2,3-二氢苯并呋喃(C8H8O)、 5-羟甲基糠醛(C6H6O3)、 2-异丙氧基苯酚(C9H12O2)和2-乙基-5-甲基-苯酚(C9H12O)。这6种化合物的极性有差异,因此这些化合物在二维色谱柱上可以被分离。与GC-qMS相比,GC×GC-qMS具有如下优点[11-12]: 1) 可以容纳更多的峰容量; 2) 极性不同的色谱柱和调制器的加入使得组分的分离和检测的灵敏度显著提高; 3) 可以得到组分的二维结构谱图及三维谱图下物质分布趋势,用于同类物质的定性及族类物质的分析; 4) 增加了分析物峰的信噪比(S/N),增加的S/N与其高分辨率相结合,最大限度地提高了所获得的质谱的纯度,从而使样品的识别更加准确。
2.3 热解温度对GC×GC-qMS分析时产物分布的影响
玉米芯主要由纤维素、半纤维素和木质素组成,且三大组分在热解过程中存在着相互作用[13]。随着温度的升高,玉米芯热解产物的数量逐渐增加,350、 400、 450、 500、 550和600 ℃时,热解产物中组分数量分别为119、 155、 169、 179、 191和192种。利用GC×GC-qMS检测到的GC含量和数量变化的具体结果如表1所示,各组分中主要产物GC含量变化趋势如表2所示。
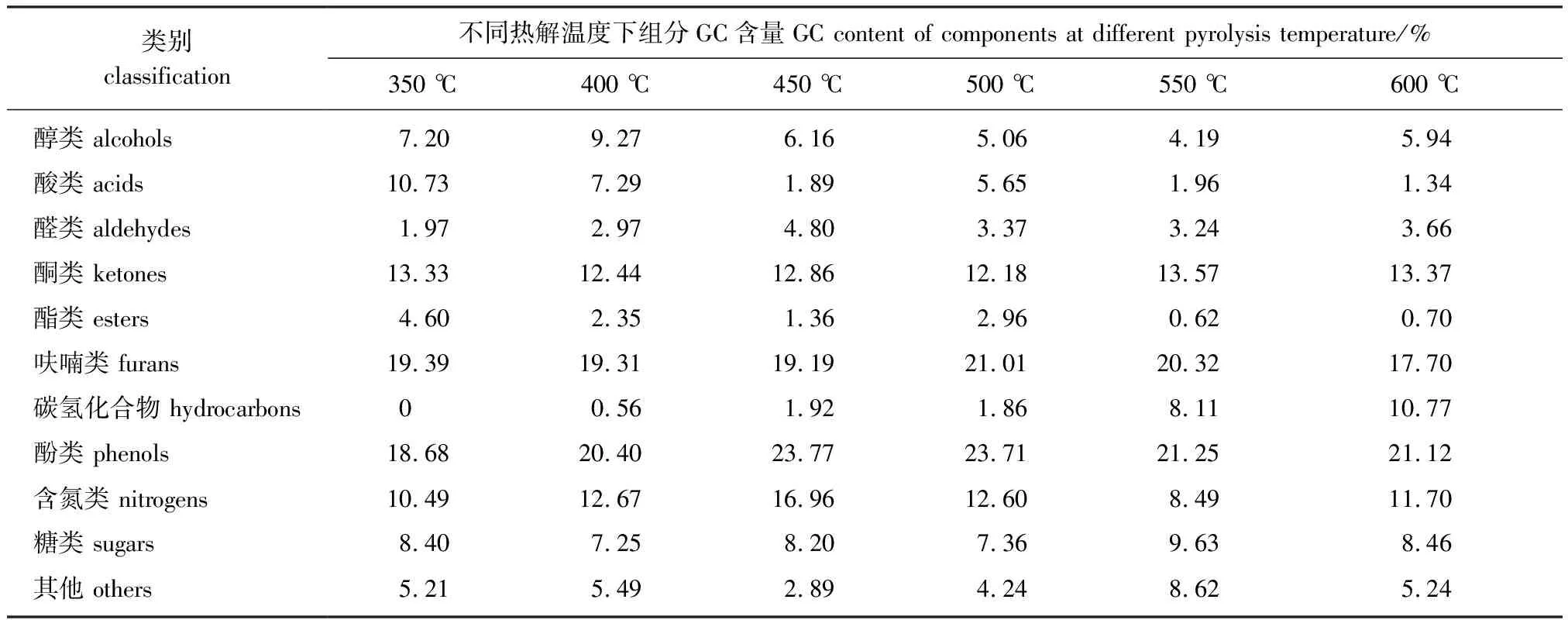
表1 不同温度下玉米芯热解产物的GC含量
由表1和表2可得,醇类和酯类化合物在低温条件下易生成,高温条件下易发生二次裂解。醇类主要组分为3-丁烯-1,2-二醇和2,5-二甲基-3,4-己二醇,前者随温度的升高持续降低,后者随温度的升高先增加后降低。酯类主要组分为2-羟基乙基丙烯酸酯,温度对其影响非常明显且在450 ℃后GC含量为0。
酸类化合物主要来源于纤维素和半纤维素的热解,是生物油的酸性和腐蚀性的来源[14]。酸类物质在低温下易生成,当温度升高时酸性物质经历二次裂解生成一些小分子醛酮类化合物以及CH4、CO2和H2O等[15]。酸类在350 ℃时达到最大值,主要有甲酸、乙酸、丙酸等。温度对甲酸的GC含量影响最大,在400 ℃时达到最大值,但在500 ℃后消失。乙酸和丙酸分别在400和500 ℃时达到最大值。
醛和酮主要来源于纤维素和半纤维素的热解。温度对醛类化合物的影响并不明显,在450 ℃时达到最大值,之后其GC含量基本不变,说明醛类物质可以通过二次裂解产生。醛类主要的成分为丁二醛,在400 ℃条件下GC含量最高。醛组分活性很强,在储存或加热过程中易发生缩合和缩聚反应,会影响生物油的化学稳定性[16]。纤维素和半纤维素在热解过程中解聚形成单体,这些大分子单体开环和断裂可以形成酮类化合物[17]。温度对酮类化合物的影响不明显,其GC含量均保持在一个较高的范围内且在550 ℃时达到最大。酮类主要包括1,2-环戊二酮、 3-甲基-1,2-环戊二酮和1-羟基-2-丁酮,分别在350、 500和450 ℃达到最大值。
纤维素和半纤维素热解开环再环化可以形成呋喃环,然后脱水重排形成呋喃类化合物[18-19],温度对呋喃类化合物的影响并不明显,其GC含量在500 ℃时达到最大值,主要产物有糠醛、 2(5H)-呋喃酮和2,3-二氢-苯并呋喃。糠醛的GC含量比2,3-二氢-苯并呋喃低得多,在这3种呋喃化合物中,温度对2(5H)-呋喃酮的影响最大,随着温度的升高其GC含量先升高后不断降低。高温条件有利于糠醛和2,3-二氢-苯并呋喃的生成,但600 ℃时糠醛的GC含量有所降低,这可能与随着温度的升高而引起的裂解反应的增强有关。呋喃类物质氧含量较高,生物油的化学稳定性会受到不同程度的影响,但有些呋喃衍生物具有特定的化学性能和价值[20]。
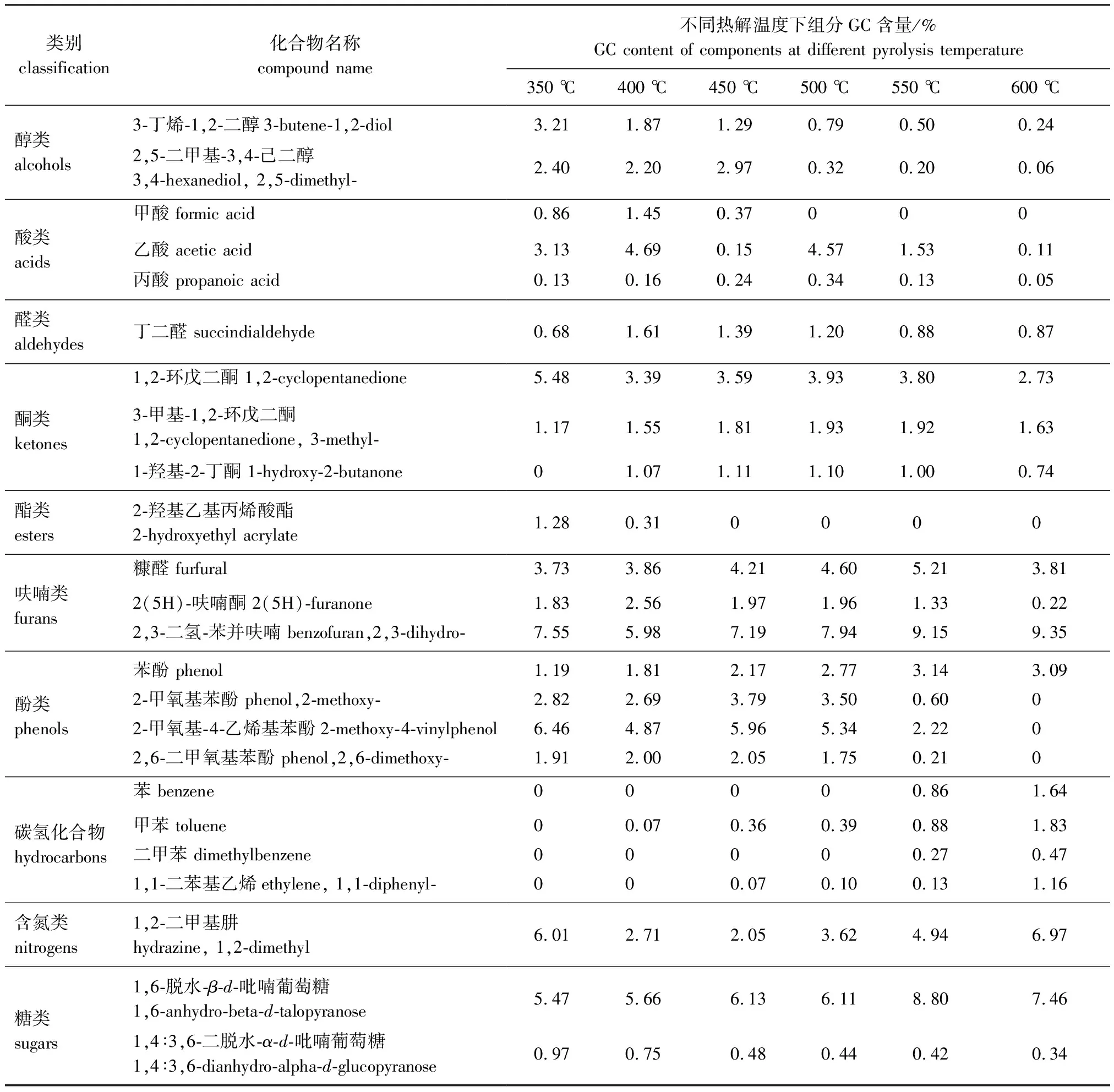
表2 温度对热解产物主要组分的影响
酚类化合物是玉米芯热解产物的主要成分,具有较高的附加值[21]。酚类化合物来源于木质素的裂解,碎裂过程中可产生小分子酚、木质素单体聚合物、苯环及其含氧衍生物和焦炭[22]。随着温度的升高,酚类化合物呈现出先增加后减少的趋势,在450 ℃时GC含量达到最大值。酚类主要包括苯酚、 2-甲氧基苯酚、 2-甲氧基- 4-乙烯基苯酚和2,6-二甲氧基苯酚,分别在550、 450、 350和450 ℃条件下达到最大值。
含氮物质(如吡咯、吡啶、吲哚和苯胺类化合物)是药物和重要化学品的主要成分或中间体[23],但这些物质在玉米热解产物中的GC含量极低。含氮化合物主要组分为1,2-二甲基肼,高温或低温均能促进其生成。碳氢化合物主要包含了烷烃、烯烃、炔烃、苯及苯系物,在低温条件下很难形成。碳氢化合物的形成会增加生物油的热值,但值得关注的是多环芳烃(PAHs)具有毒性且在癌症发病中有潜在作用[24]。热解温度的升高,碳氢化合物的GC含量持续增加,600 ℃达最大值。其主要成分包括轻质芳烃(苯、甲苯和二甲苯)和1,1-二苯基-乙烯,且这4种组分均在600 ℃时达最大值。糖类化合物主要来源于纤维素和半纤维素的分解,主要为1,6-脱水-β-d-吡喃葡萄糖和1,4∶3,6-二脱水-α-d-吡喃葡萄糖,其GC含量分别在550和350 ℃达到最大值。温度对2种化合物的影响差异很大,高温更容易促进1,6-脱水-β-d-吡喃葡萄糖的生成,而低温更容易促进1,4∶3,6-二脱水-α-d-吡喃葡萄糖的生成。
3 结 论
3.1利用热裂解-全二维气相色谱-质谱联用(Py-GC×GC-qMS)仪对玉米芯热解产物进行在线分析。结果发现:在550 ℃热解18 s时,Py-GC-qMS共检索到58种化合物,包括醇、酸、醛、酮、酯、呋喃类、碳氢化合物、酚类和含氮类;Py-GC×GC-qMS共检索到191种化合物,相比Py-GC-qMS还多检测出了糖类。2D-GC可以识别更多的化合物,检测到的化合物数量达到1D-GC的3倍多。
3.2通过GC×GC-qMS对不同温度下玉米芯热解产物分布的分析可得:低温条件下醇类、酯类、酸类化合物易生成,GC含量分别在400、 350和350 ℃时达到最大值。温度对醛类、酮类和呋喃类化合物的影响并不明显,醛类在450 ℃时达到最大值,之后其GC含量基本不变;酮类的GC含量均保持在一个较高的范围内且在550 ℃时达到最大;呋喃类GC含量在500 ℃时达到最大值。随着温度的升高,酚类化合物呈现出先增加后减少的趋势,在450 ℃时GC含量达到最大值,而碳氢化合物的GC含量持续增加,600 ℃时达最大值。温度对含氮类和糖类化合物的影响也不明显,其GC含量分别在450和550 ℃下达到最大值。

