叉头框转录因子M1和转移相关基因1蛋白在非小细胞肺癌中的表达及其与临床特征和预后的相关性分析
杨 昕,刘 芳,杜 静,张继朋
肺癌发病率、病死率位居恶性肿瘤首位,是一个严重影响人群健康和生活质量的公共卫生问题。非小细胞肺癌(non-small cell lung cancer, NSCLC)是肺癌最常见类型,占肺癌的80%~85%[1]。手术是早期NSCLC的首选治疗手段,而治疗失败的原因主要为肿瘤晚期转移及恶性程度较高所致,其中肿瘤转移是多种因素引发的生物学行为。肿瘤转移涉及多个基因产物,其中转移相关基因1蛋白(crosshead box transcription factor M1, MTA1)、叉头框转录因子M1(transfer related gene 1 protein, FOXM1)在肿瘤的发生、发展中起着重要作用,有望成为肿瘤治疗的新靶点。本研究探讨FOXM1和MTA1在NSCLC中的表达及其与临床特征和预后的相关性,现报告如下。
1 资料与方法
1.1一般资料 选取2012年6月—2014年2月陕西中医药大学第二附属医院收治的符合纳入及排除标准的行手术治疗的86例NSCLC,其中男63例,女23例;年龄25~81(63.15±6.93)岁;病程6个月~1.1年,平均7.69个月;肿瘤直径1.36~6.58 cm,平均3.96 cm;TNM分期为Ⅰ期16例,Ⅱ期20例,Ⅲ期31例,Ⅳ期19例;吸烟72例;术后接受放疗21例,接受化疗11例;肿瘤部位为左肺41例,右肺45例;肿瘤分化程度为低分化25例,中分化43例,高分化18例。本研究经医院伦理委员会批准。
1.2纳入及排除标准
1.2.1纳入标准:①所有患者均符合NSCLC诊断标准[2];②所有患者均行手术治疗,术中及术后均经病理学检查确诊为NSCLC。
1.2.2排除标准:①合并血液系统或免疫系统疾病者;②存在其他部位恶性肿瘤者;③有严重原发性肝肾功能不全者;④临床资料不完整或缺乏准确性者。
1.3观察指标 记录患者的临床资料,包括年龄、性别、TNM分期、吸烟史、肿瘤部位等,检测FOXM1、MTA1表达情况,随访5年(电话随访、短信随访及回院复查),观察疾病转移(复查影像学结果发现转移病灶)、预后情况,分析FOXM1、MTA1表达与NSCLC患者临床特征的关系。
1.3.1FOXM1检测:所有患者手术切除病灶常规固定制作石蜡标本,切成厚4 μm薄片,采用SP法进行免疫组织化学染色(免疫组化),操作步骤参考美国Santa Cruz公司的试剂盒说明书,同时利用磷酸盐缓冲液代替一抗作为阴性对照。若FOXM1胞核或胞质出现棕黄色颗粒即为阳性细胞。所有免疫组化结果均由两位病理科医师在双盲条件下进行独立判断,按照文献[3]进行染色判读,将(-)和(+)计为阴性,(++)计为弱阳性,(+++)计为强阳性,并将弱阳性和强阳性计为阳性。
1.3.2MTA1检测:所有患者手术切除病灶常规固定制作石蜡标本,切成厚4 μm薄片,标本常规脱蜡脱水,经高压抗原修复2 min,抗原修复液为枸橼酸盐缓冲液,3%过氧化氢溶液作用10 min以阻断内源性过氧化物酶活性,鼠抗人MTA1多克隆抗体按1∶100稀释后于4℃环境下孵育过夜,次日取出后于室温恢复30 min,磷酸盐缓冲液清洗,滴加即用型二抗,37℃作用30 min后用磷酸盐缓冲液清洗,DAB染色,复染后封片,置于高倍显微镜下观察。用已知MTA1阳性表达的NSCLC组织作为阳性对照,磷酸盐缓冲液代替一抗作为阴性对照。鼠抗人MTA1多克隆抗体来源于美国Abcam公司,兔抗鼠二抗及DAB显色液购自迈新生物技术公司。MTA1阳性表达为细胞核出现棕黄色颗粒,根据免疫组化结果进行半定量分析计数[4],若≤6分为低表达,>6分为高表达。

2 结果
2.1免疫组化结果 FOXM1阳性表达76例,阴性表达10例,阳性率为88.37%,其中强阳性52例,弱阳性24例;MTA1高表达68例,低表达18例,高表达率为79.07%。34例生存,52例死亡,生存率39.53%。
2.2FOXM1、MTA1在NSCLC患者不同临床特征中的表达情况 是否吸烟、肿瘤分化程度、是否发生远处转移的NSCLC患者FOXM1表达情况比较差异有统计学意义(P<0.05或P<0.01),是否吸烟、不同TNM分期、不同肿瘤直径、不同肿瘤分化程度、是否发生远处转移的NSCLC患者MTA1表达情况比较差异有统计学意义(P<0.05或P<0.01)。见表1。

表1 FOXM1、MTA1在NSCLC患者不同临床特征中的表达情况
注:FOXM1指叉头框转录因子M1,MTA1指转移相关基因1蛋白,NSCLC指非小细胞肺癌
2.3影响NSCLC患者预后的单因素分析 单因素分析显示,年龄、是否吸烟、TNM分期、肿瘤直径、肿瘤分化程度、是否发生远处转移、FOXM1及MTA1表达情况是影响NSCLC患者预后的相关因素(P<0.05或P<0.01)。见表2。
2.4影响NSCLC患者预后的多因素分析 多因素logistic回归分析显示,年龄≤60岁、吸烟、TNM分期Ⅲ~Ⅳ期、肿瘤直径>3 cm、肿瘤分化程度低分化、发生远处转移、FOXM1表达阳性、MTA1高表达为影响NSCLC患者预后的独立危险因素(P<0.05或P<0.01)。见表3。
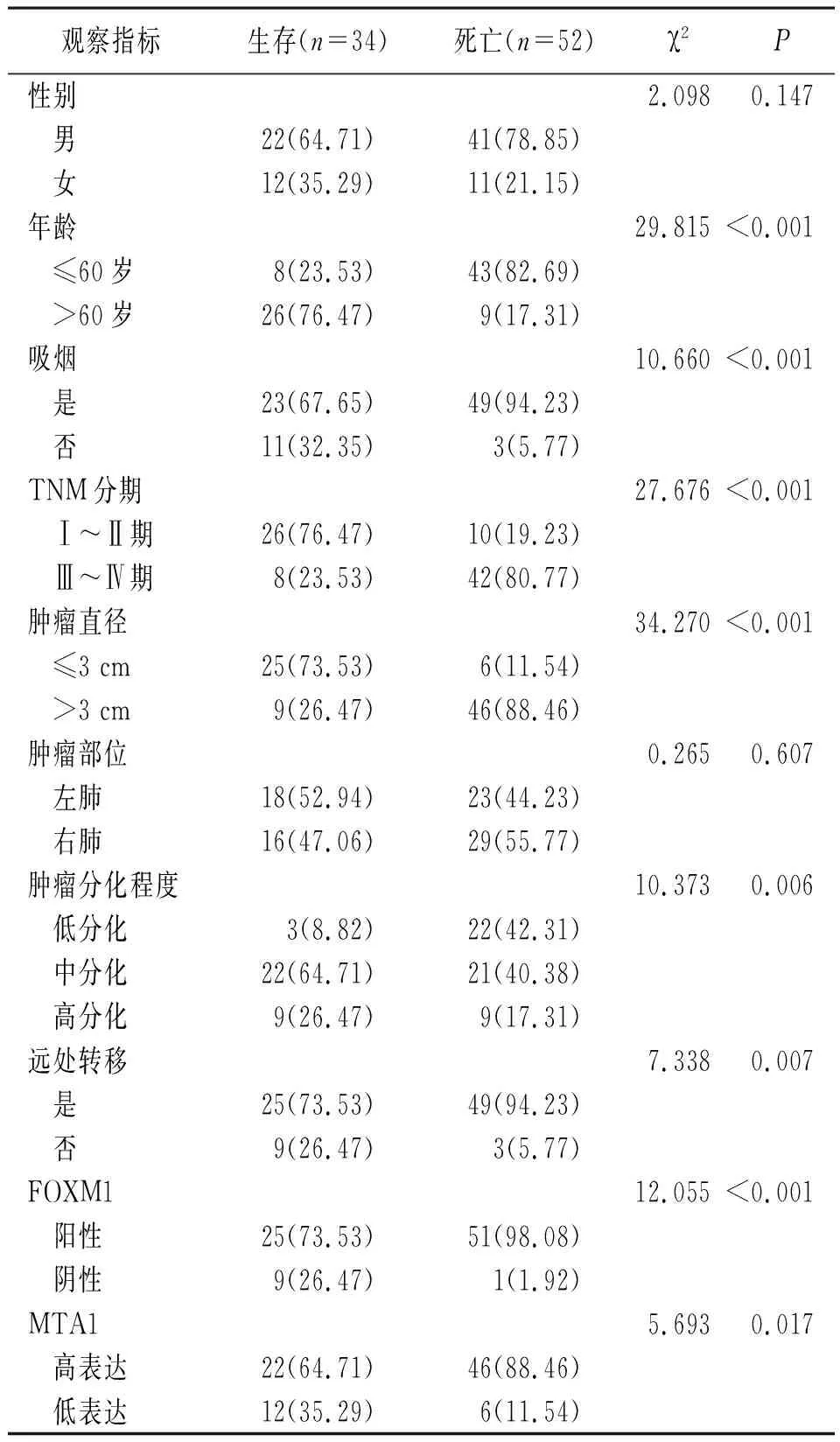
表2 影响NSCLC患者预后的单因素分析[例(%)]
注:NSCLC指非小细胞肺癌,FOXM1指叉头框转录因子M1,MTA1指转移相关基因1蛋白
3 讨论
肺癌是我国发病率、病死率最高的恶性肿瘤,全球肺癌的发病率占患癌总数的15%,且呈逐年上升趋势。肺癌早期无特征性临床表现,早期正确诊断率低,晚期肺癌患者往往已不能行根治性手术治疗或手术治疗后易复发,直接影响患者的生存时间[5-8]。有研究认为,肿瘤组织中FOXM1表达与肺癌临床病理因素存在一定相关性[9]。有学者发现FOXM1在NSCLC中呈高表达,参与肺血管的形成、肿瘤细胞的增殖、浸润和转移,并与NSCLC的预后相关,抑制其表达可延缓肿瘤的发生、发展[10]。付军科等[11]运用RNA干扰技术下调FOXM1表达水平,发现通过下调FOXM1表达水平可降低肺癌细胞的侵袭能力,进而降低肺癌细胞基质金属蛋白酶-2表达,推测FOXM1有望作为NSCLC治疗的新靶点。
本研究结果显示,FOXM1阳性表达76例,阴性表达10例,阳性率为88.37%;MTA1高表达68例,低表达18例,高表达率为79.07%,表明FOXM1、MTA1与NSCLC发生、发展密切相关。有文献报道,FOXM1失调对恶性肿瘤细胞增殖、肿瘤新生血管生成及肿瘤细胞侵袭均有一定的影响,且FOXM1在中低分化的鳞癌细胞中更易检测,同时FOXM1阳性表达与NSCLC的分化程度、TNM分期、淋巴结转移密切相关[12-14]。本文发现FOXM1表达与是否吸烟、肿瘤分化程度、是否发生远处转移存在密切相关性,与高映浩等[15]报道一致。转移相关基因是一类新发现的与肿瘤发生、转移有关的基因家族,其中MTA1由核小体重构及组蛋白脱乙酰基酶复合物构成,参与核小体重塑及组蛋白去乙酰化[16-18]。

表3 影响NSCLC患者远期预后的多因素logistic回归分析
注:NSCLC指非小细胞肺癌,FOXM1指叉头框转录因子M1,MTA1指转移相关基因1蛋白
有研究证实,MTA1表达阳性与FOXM1高表达存在相似之处,均具有促进肿瘤细胞恶性增殖的作用,并且MTA1在多种人类肿瘤中呈异常高表达,参与肿瘤血管生成及细胞侵袭和转移过程[18-20]。本研究多因素logistic回归分析显示,FOXM1表达阳性、MTA1高表达为影响NSCLC患者预后的独立危险因素,提示FOXM1、MTA1表达与NSCLC的转移和预后密切相关,推测FOXM1、MTA1可能成为NSCLC肿瘤细胞转移的标志物,故探索FOXM1、MTA1在NSCLC发生、发展中的生物学和分子学机制有助于进一步解析NSCLC的生物学行为。
综上所述,FOXM1表达阳性、MTA1高表达为影响NSCLC患者预后的不良因素,临床应提高警惕。然而,本研究不足之处在于样本量较小,研究结论需加大样本量以进一步证实。

